培养方式对灵芝酸合成的影响及固态发酵条件的优化
陈 红,方 磊,余晓斌
(江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏无锡 214122)
培养方式对灵芝酸合成的影响及固态发酵条件的优化
陈 红,方 磊,余晓斌*
(江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏无锡 214122)
先比较灵芝振荡培养、振荡-静置两阶段结合培养和固态发酵培养对总灵芝酸及灵芝酸Mk、灵芝酸S、灵芝酸T和灵芝酸Me合成的影响。并以玉米粉为主要的固态发酵基质,利用Plackett-Burman(PB)实验筛选影响总灵芝酸合成的主要因素,然后以最陡爬坡实验、中心组合设计和响应面法对影响灵芝酸合成的主要因素进行优化。确定最优培养条件为:39.0 g玉米粉(含水量38.0%)/瓶,1.08%蚕蛹粉,0.86%蔗糖,0.08%柠檬酸三铵,0.13%硫酸镁,0.22% KH2PO4,0.02% VB1,接种量20%,培养温度29.5 ℃,发酵时间为10 d。在此条件下,玉米灵芝菌丝体混合粉末中总灵芝酸含量到达了24.93 mg/g,灵芝酸Mk、灵芝酸S、灵芝酸T含量分别达到了0.86、0.69和3.69 mg/g。灵芝固态发酵法生产三种灵芝酸单体具有较好的应用前景。
灵芝菌丝体,固态发酵,Plackett-Burman(PB)设计法,响应面法
灵芝(Ganodermalucidum)自古以来就是中国的名贵中药,是一种隶属于真菌门、担子菌纲、多孔菌科、灵芝属的药用真菌[1-2]。药理研究表明,灵芝三萜可抑制肿瘤细胞、抗病毒、镇静止痛、抑制组织胺释放等功能[3-6]。野生的灵芝非常稀少,人工栽培灵芝子实体技术和菌丝体液体培养技术得到快速发展[7-8],灵芝固态发酵生产菌丝体技术研究的相对较少。灵芝子实体中三萜类物质的种类丰富,其中灵芝酸A、B和C的含量较高,而菌丝体中的三萜主要是灵芝酸T、灵芝酸S和灵芝酸R等[9]。在液体静置培养条件下灵芝酸Mk、灵芝酸T、灵芝酸S和灵芝酸Me的含量远高于振荡培养,目前灵芝液体发酵研究的热点主要是采用振荡-静置两阶段培养来提高灵芝酸的产量[10-11]。
谭显东等[12]按照“双向发酵”理论,以三七渣为原料固态发酵生产灵芝,可以获得具有独特功能的药性菌质,实现三七渣的资源化利用、减少固态废弃物的排放等。付铭等[13]以大米为固态发酵基质培养灵芝菌丝体,灵芝米粉中含有非常丰富的赖氨酸和灵芝多糖等功能性物质。韩建荣等[14]利用灵芝固态发酵降解玉米粉中的淀粉,还原糖和蛋白质的含量大幅提高,增加了玉米粉的消化吸收率和营养价值。本文中先比较灵芝振荡培养、振荡-静置两阶段结合培养和灵芝固态发酵培养对总灵芝酸及灵芝酸Mk、灵芝酸S、灵芝酸T和灵芝酸Me合成的影响,来探究灵芝固态发酵高产灵芝酸单体的可行性;再以玉米粉为主要的固态发酵基质,优化培养条件来提高总灵芝酸和灵芝酸单体含量。
1 材料与方法
1.1 材料与仪器
实验菌株 安徽灵芝菌种,糖化学与生物技术教育部重点实验室筛选及保存;玉米粉 无锡市欧尚超市;冰醋酸、乙醇、乙酸乙酯 上海国药集团;甲醇、乙腈 阿拉丁试剂有限(中国)公司;其它实验所用试剂均为分析纯。
G180T灭菌锅 美国致微仪器有限公司;日立U-3900紫外可见光分光光度计 日本日立株式会社;安捷伦1260高效液相色谱仪 美国安捷伦科技公司;1525型半制备液相色谱仪 沃特世科技(上海)有限公司;三重四级杆液质联用仪 美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 培养基及培养条件液体振荡培养 培养基(g/L):40可溶性淀粉,5麸皮,2.25 KH2PO4,1.5 MgSO4,0.005 VB1,pH5.60,121 ℃高压蒸汽灭菌20 min;培养条件:接种量为10%,温度为30 ℃,摇床转速为160 r/min,培养时间为7 d。8000 r/min离心5 min,收集灵芝菌丝体,放置到60 ℃干燥箱中烘干至恒重。液体振荡-静置培养:培养基(g/L):40可溶性淀粉,5麸皮,2.25 KH2PO4,1.5 MgSO4,0.005 VB1,pH5.60,121 ℃高压蒸汽灭菌20 min;培养条件为:接种量为10%,温度为30 ℃,摇床转速为160 r/min,振荡培养时间为6 d,转接到平板上,静置培养8 d。取灵芝静置培养的上层菌丝体,洗涤后放置到60 ℃干燥箱中烘干至恒重。固态发酵:培养基(250 mL三角瓶):50 g/瓶玉米粉(含水量为38.0%),1.08%蚕蛹粉,0.86%蔗糖,0.08%柠檬酸三铵,0.22% KH2PO4,0.16%硫酸镁,0.02% VB1,121 ℃高压蒸汽灭菌40 min;培养条件:接种量20%,培养温度30 ℃,发酵时间为10 d。培养结束后,玉米灵芝菌丝体放置到60 ℃干燥箱中烘干至恒重。
1.2.2 灵芝酸检测波长的选择 称取实验室制备的灵芝酸Mk(纯度≥95%)适量,溶于甲醇,定容得标准溶液。稀释到适宜的浓度后,在191~600 nm内进行扫描,确定灵芝酸的检测波长[15]。
1.2.3 总灵芝酸的提取及测定 取烘干后振荡培养的灵芝菌丝体、液体振荡-静置培养灵芝菌丝体上层和玉米灵芝菌丝体混合物,粉碎机粉碎后,分别称取一定量的菌丝体粉末用乙醇提取三次,合并提取液,用乙酸乙酯萃取两次,减压除去乙酸乙酯,用甲醇溶解定容,稀释适宜浓度,在231 nm波长下测定吸光度[16]。
1.2.4 灵芝酸单体的制备 灵芝酸样品液用大孔树脂纯化和浓缩后,用0.22 μm有机滤膜过滤,灵芝酸单体的半制备液相的条件[17]:X Bridge C18柱子;流动相为乙酸水溶液(乙酸的体积分数为0.1%)(A)-乙腈(B),等度洗脱的浓度V(A)∶V(B)=25%∶75%,流速为3 mL/min;PDA检测器,检测波长为231 nm;柱温25 ℃;进样量400 μL。分管收集目标物质,鉴定制备的灵芝酸单体纯度。
1.2.5 灵芝酸单体的检测方法 用高效液相测定菌丝体中各灵芝酸单体含量,液相条件为:ZORBAX SB-C18色谱柱(250 mm×4.6 mm,5 μm);流动相:乙酸水溶液(A)-乙腈(B),梯度洗脱的浓度为(0~30 min:65% B→100% B;30~40 min:100% B);PDA检测器,检测波长为231 nm;柱温30 ℃;进样量20 μL;流速为1 mL/min。
2 结果与分析
2.1 检测波长的确定
灵芝酸Mk在波长为191~600 nm的吸光度曲线如图1所示,灵芝酸在波长为217、231 nm出现了两个吸收峰极值,甲醇和乙腈在波长为210 nm左右有较强的紫外吸收,对实验有较大的干扰,后续的实验中选择的检测波长为231 nm。

图1 灵芝酸的紫外可见光光谱图Fig.1 Absorption spectrum of the ganoderic acid
2.2 灵芝酸单体的结构分析
图2c和图3c分别表示RT=6.63灵芝酸单体的正负离子质谱图,根据图2c中出现的493.1、553.0、613.1、630.1和635.0分别代表的结构为[M-2OAc]+、[M-OAc]+、[M+H]+、[M+NH4]+和[M+Na]+质谱信号峰;图3c中,在m/z 611.5处峰,代表了[M-H]-质谱信号,所对应的M值与灵芝酸T的分子量612相符合,初步鉴定为灵芝酸T[19]。
图2d和图3d分别表示RT=7.78灵芝酸单体的正负离子质谱图,根据图2d中出现的495.6、554.9、568.9、和577.1分别代表的结构为[M-OAc]+、[M+H]+、[M+NH4]+和[M+Na]+质谱信号峰;图3d中,在m/z 553.5处峰,代表了[M-H]-质谱信号,所对应的M值与灵芝酸Me的分子量554相符合,初步鉴定为灵芝酸Me[19]。

图2 灵芝酸Mk(a)、S(b)、T(c)和Me(d)的正离子质谱图Fig.2 Positive-ion mass spectra of GA-Mk(a),GA- S(b),GA-T(c)and GA-Me(d)
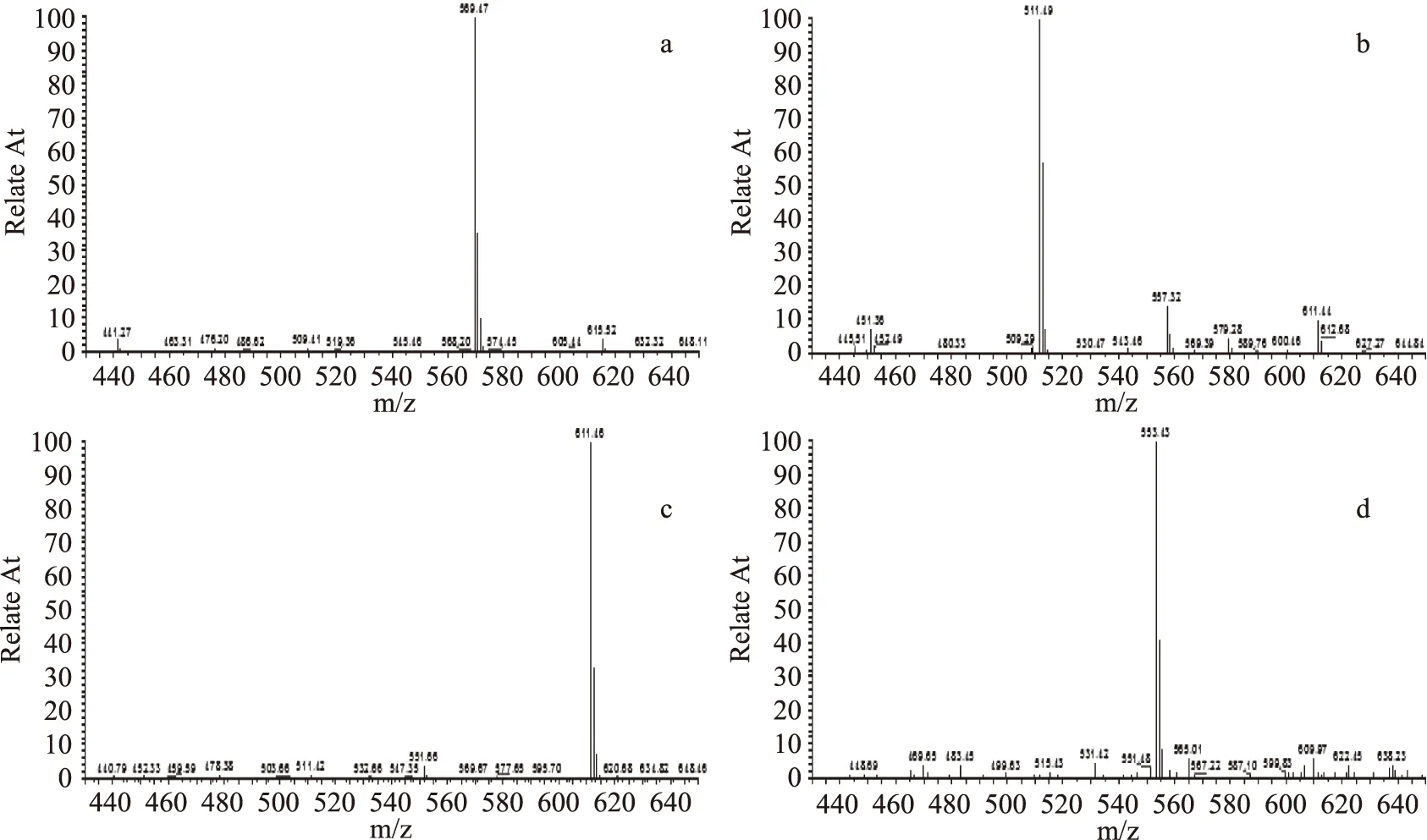
图3 灵芝酸Mk(a)、S(b)、T(c)和Me(d)的负离子质谱图Fig.3 Negative-ion mass spectra of GA-Mk(a),GA- S(b),GA-T(c)and GA-Me(d)
2.3 灵芝酸单体纯度的鉴定及高效液相色谱峰面积和浓度的线性关系
取经半制备液相制备的四种灵芝酸单体,通过HPLC检测其纯度,纯度均≥95%。取适量的灵芝酸Mk,灵芝酸S,灵芝酸T和灵芝酸Me(经质谱初步鉴定)定容后,稀释得到不同浓度标准液,检测灵芝酸单体峰面积与其浓度的线性关系,结果如表1所示,四种灵芝酸在适宜的浓度下,峰面积与浓度的线性关系拟合度高。

表1 峰面积与灵芝酸浓度的关系Table 1 Linear relationships between peak area and ganoderic acids concentration
2.4 培养方式对灵芝酸单体合成的影响
如图4可见,灵芝液体振荡-静置两阶段培养上层菌丝体中总灵芝酸含量高达46.74 mg/g,是振荡培养菌丝体的2.19倍,这与骆军鑫[20]和钟建江[11]等研究结果一致;两阶段培养的菌丝体中灵芝酸Mk、灵芝酸S、灵芝酸T和灵芝酸Me含量分别为2.30、2.34、4.67、1.53 mg/g,而振荡培养并未检测出这四种灵芝酸单体的存在,证明两阶段培养法的菌丝体醇提物中灵芝酸种类及含量明显优于液体振荡培养法。固态发酵的玉米灵芝菌丝体粉末中总灵芝酸为14.83 mg/g,灵芝酸Mk、灵芝酸S和灵芝酸T含量分别为0.57、0.46和2.20 mg/g,未检测到灵芝酸Me,这是首次报道灵芝固态发酵产灵芝酸Mk、灵芝酸S和灵芝酸T。静置培养上层菌丝体中鲨烯合成酶、羊毛甾醇合成酶和3-羟基-3-甲基戊二酰-乙酰辅酶A的转录水平是振荡培养的4.3、2.1和1.9倍,其基因表达量的上调是灵芝酸合成提高的主要原因[11]。通过振荡-静置两阶段培养来提高灵芝菌丝体中的灵芝酸的种类及含量已经有大量的文献报道,但该法也存在一定的局限性。灵芝液体振荡-静置培养条件的要求较为严格,培养周期较长,且仅有液体表面形成白色菌丝层中的灵芝酸种类及含量有较大的提高,不利于扩大化生产。本实验中采用灵芝固态培养的玉米灵芝菌丝体中也含有振荡-静置培养上层菌丝体中存在的灵芝酸Mk、灵芝酸S和灵芝酸T。相对于振荡-静置培养,固态培养的总灵芝酸及几种灵芝酸的单体含量较低,但在扩大培养、培养的效率及成本等方面有很大的优势,具有较好的研究前景。

表2 PB实验设计(n=12)Table 2 Design of PB test(n=12)
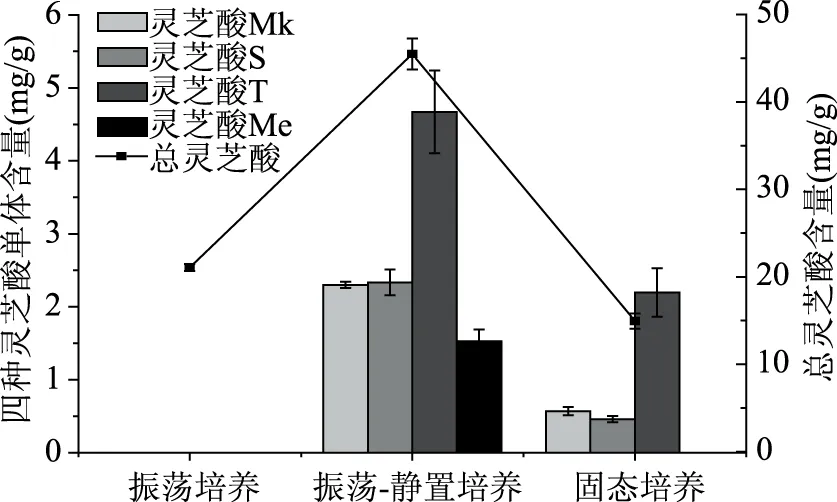
图4 不同培养方式下灵芝酸种类及含量Fig.4 Ganoderic acid contents under different culture conditions
2.5 固态发酵条件的优化
由2.4的分析可知,灵芝在不同培养条件下灵芝酸的种类及含量有较大差别,以玉米等可食性固态基质,发酵生产灵芝酸Mk、灵芝酸S和灵芝酸T等具有抗癌活性的天然物质,具有较好的发展潜力。在灵芝固态发酵中,灵芝酸单体的含量与总灵芝含量呈正相关,为简便后续的数据分析处理,在固态发酵中以总灵芝酸含量为优化的指标。
2.5.1 PB实验及结果 采用PB两水平法对灵芝固态发酵培养中9种因素进行了考察,筛选影响灵芝固态发酵产灵芝酸的主要因素。PB的实验因素和水平见表3,实验设计方案见表2。经Design Expert 8.0.6软件建模后,所建模型p值为0.0406<0.05,证明该模型效果显著。9个因素中,瓶装量、硫酸镁添加量和培养温度对灵芝菌丝体中总灵芝酸含量的影响显著,结果见表3。
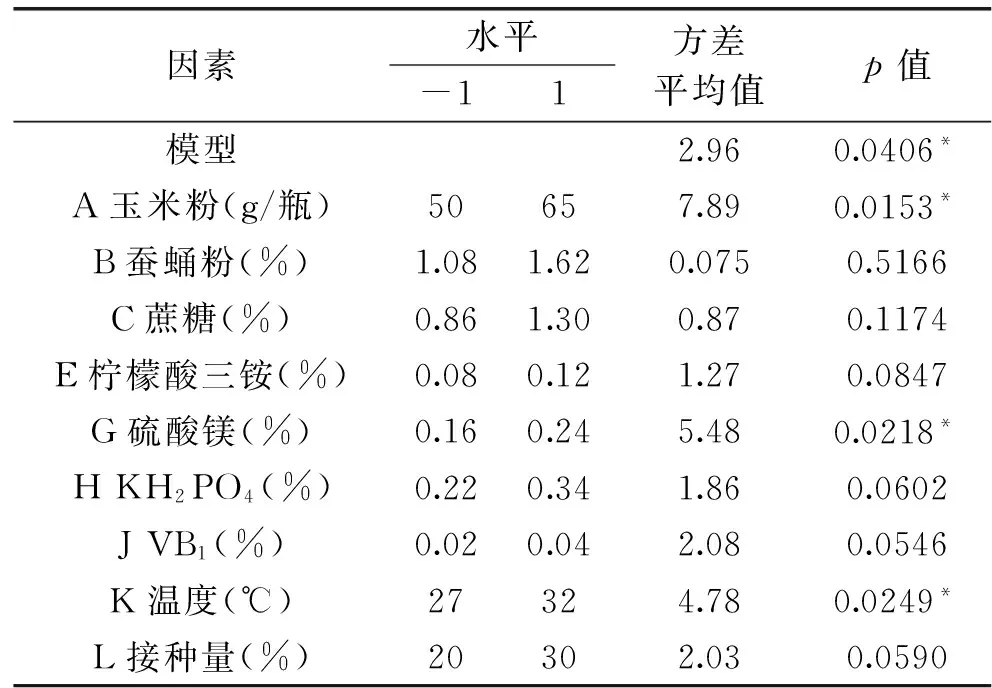
表3 PB实验因素水平及效应分析Table 3 Factors,levels and efficiency evaluation of Placket-Burman experiment
注:“*”表示显著。

表4 最陡爬坡实验Table 4 Design of the steepest ascent experiment
2.5.2 最陡爬坡实验 由PB实验可知瓶装量、硫酸镁添加量和培养温度是影响总灵芝酸合成的3个显著因素,因此根据这3个因素效应的大小比例设定其变化方向及其变化步长进行最陡爬坡实验。实验设计及结果如表4所示,可知最优总灵芝酸含量在编号2和4之间。
2.5.3 响应面实验的优化分析
2.5.3.1 响应面实验设计 依据中心组合实验设计原理,做三因素三水平共15个实验点的响应面分析。A(瓶装量,g/瓶),B(硫酸镁,g/kg),C(温度, ℃),Y(总灵芝酸含量,mg/g),响应面实验方案及实验结果见表5。

表5 响应面实验方案及实验结果Table 5 Design and results of response surface experiment
2.5.3.2 响应面曲面方差分析 表6分析可知,模型p=0.0004<0.01,失拟误差p=0.4407>0.05,说明该模型回归显著;该模型的R2=0.98,说明该模型与实际拟合度高,自变量与响应值之间线性关系显著,可用于固态发酵产灵芝酸的理论预测。利用Design Expert 8.0.6软件对表5进行多元回归拟合,得到总灵芝酸二次回归方程模型:Y=23.36-3.49A-0.22B+1.50C-0.32AB-0.03AC+0.44BC-2.60A2-2.88B2-4.20C2。

表6 回归模型的方差分析结果Table 6 Results of variance analysis of regression mode
注:*p<0.05,模型或考察因素显著;**p<0.01模型或考察因素极显著。
2.5.3.3 两因素交互影响 总灵芝酸含量的响应面分析如图5所示,灵芝酸含量的响应面开口均向下,总灵芝酸含量和3个因素呈现明显的二次抛物线关系。利用Design Expert 8.0.6软件中多元二次回归模型对灵芝酸含量进行估算,对二次抛物线函数模型进行极值分析,预测三因素的最佳组合为:瓶装量38.92 g/瓶,硫酸镁添加量1.30 g/kg,培养温度29.47 ℃时,该模型预测极大值Y=24.59 mg/g。

图5 两因素交互影响总灵芝酸含量的响应曲面图分析Fig.5 Response surface analysis of the recovery rate affected by two-factors
2.5.4 验证实验 为了验证模型的准确性和有效性,对预测的最佳发酵条件进行调整,调整后的培养条件:39.0 g/瓶玉米粉,1.08%蚕蛹粉,0.86%蔗糖,0.08%柠檬酸三铵,0.22% KH2PO4,0.13%硫酸镁,0.02%VB1,接种量20%,培养温度29.5 ℃,每组3重复实验,实验结果如图6所示。总灵芝酸含量在灵芝固态发酵10 d后达到了最高为(24.93±0.51) mg/g,说明该回归模型能准确预测固态发酵中总灵芝酸的含量,灵芝酸Mk、灵芝酸S和灵芝酸T的含量分别为0.86、0.69和3.69 mg/g。

图6 发酵时间对灵芝酸合成的影响Fig.6 Effect of cultivation duration on the production of ganoderic acid
3 结论
本实验先鉴定了从振荡-静置培养上层菌丝体中提取的四种灵芝酸单体;再比较不同培养方式对总灵芝酸及灵芝酸单体合成的影响,证实了灵芝固态发酵能合成在振荡-静置两阶段培养菌丝体上层中存在的灵芝酸Mk、灵芝酸S和灵芝酸T;固态发酵条件经优化后,玉米灵芝菌丝混合粉末中总灵芝酸含量达到了24.93 mg/g,提高了68.11%,其中灵芝酸Mk、灵芝酸S和灵芝酸T的含量分别为0.86、0.69和3.69 mg/g。相较于振荡培养和振荡-静置培养,灵芝固态发酵产三种灵芝酸单体有更广阔的应用前景。
[1]叶鹏飞,张美萍,王康宇,等. 灵芝主要成分及其药理作用的研究进展综述[J]. 食药用菌,2013,21(3):158-161.
[2]林志彬. 灵芝的现代研究[M]. 第四版. 北京:北京大学医学出版社,2015:1-441.
[3]Xu J W,Zhao W,Zhong J J. Biotechnological production and application of ganoderic acids[J]. Applied Microbiology and Biotechnology,2010,87(2):457-466.
[4]Gao J J,Min B S,Ahn E M,et al. New triterpene aldehydes,lucialdehydesA-C,fromGanodermalucidumand their cytotoxicity against murine and human tumor cells[J]. Chemical and Pharmaceutical Bulletin,2002,50(6):837-840.
[5]Cui M L,Yang H Y,He G Q. Submerged fermentation production and characterization of intracellular triterpenoids from Ganoderma lucidum using HPLC-ESI-MS[J]. Journal of Zhejiang University Science B,2015,16(12):998-1010.
[6]刘高强,丁重阳,王晓玲. 灵芝三萜类化合物的抗癌作用机制研究进展[J]. 菌物学报,2007,26(3):470-476.
[7]金鑫,刘宗敏,黄羽佳,等. 我国灵芝栽培现状及发展趋势[J]. 食药用菌,2016(1):33-37.
[8]Zhu L W,Zhong J J,Tang Y J. Significance of fungal elicitors on the production of ganoderic acid and Ganoderma polysaccharides by the submerged culture of medicinal mushroomGanodermalucidum[J]. Process Biochemistry,2008,43(12):1359-1370.
[9]于华峥,刘艳芳,周帅,等. 灵芝子实体、菌丝体和孢子粉化学成分的比较[J]. 食品与生物技术学报,2016(8):823-827.
[10]Xu J W,Zhao W,Zhong J J. Isolation and characterization of a novelGanodermalucidumgene that differentially expressed between shaking culture and liquid static culture[J]. Genes & Genomics,2011,33(6):645-651.
[11]Xu J W,Xu Y N,Zhong J J. Production of individual ganoderic acids and expression of biosynthetic genes in liquid static and shaking cultures ofGanodermalucidum[J]. Applied Microbiology and Biotechnology,2010,85(4):941-948.
[12]谭显东,胡伟,王浪,等. 利用三七渣固态发酵灵芝菌的研究[J]. 环境污染与防治,2015,37(7):61-65.
[13]铭付,洁冮,狄文婷,等. 大米为基质灵芝菌丝体固态发酵条件的优化[J]. 食品工业科技,2014,35(2):186-192.
[14]韩建荣,赵文婧,高宇英. 灵芝固态发酵降解玉米淀粉的初步研究[J]. 食品与发酵工业,2004,30(7):59-61.
[15]庞庭才,胡上英,甘红. 红菇色素超声波提取及其稳定性和抗氧化性研究[J]. 食品与发酵工业,2015,40(11):222-227.
[16]钱竹. 灵芝酸的液体发酵及其分离纯化的研究[D]. 无锡:江南大学,2006.
[17]陈鸳谊,李行诺,张翠萍,等. 高效制备液相色谱在天然产物分离中的应用[J]. 药学进展,2010,34(8):337-343.
[18]李英波. 从灵芝菌丝体中高效分离制备抗肿瘤灵芝酸单体的研究[D]. 上海:华东理工大学,2013.
[19]Keypour S,Rafati H,Riaha H,et al. Qualitative analysis of ganoderic acids inGanodermalucidumfrom Iran and China by RP-HPLC and electrospray ionisation-mass spectrometry(ESI-MS)[J]. Food Chemistry,2010,119(4):1704-1708.
[20]骆军鑫,张劲松,贾薇,等. 培养方法对灵芝菌丝体胞内三萜产量和抗肿瘤活性的影响[J]. 上海农业学报,2014,30(2):33-37.
Influence of different cultivation methods on ganoderic acid synthesis and solid-state fermentation condition optimization
CHEN Hong,FANG Lei,YU Xiao-bin*
(Key Laboratory of Carbohydrate Chemistry and Biotechnology,Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China)
Compared shake culture,two-stage culture process by combining shake culture with static cultureand solid-state fermentationofGanodermalucidum,analyzed the influence of different cultivation methods on total ganoderic acid,ganoderic acid Mk,ganoderic acid S,ganoderic acid T and ganoderic acid Me synthesis. Corn was used as the main medium to produce ganoderic acids,Plackett-Burman(PB)design was applied to screen potential key factors associated with total ganoderic acid content. Then,the steepest ascent experiment,central composite design and response surface methodology were applied to optimize the significant factors.The final results were as follows:39.0 g solid substrate(moisture content 38.0%)shake flask,1.08% silkworm chrysalis powder,0.86% sucrose,0.08%tri-ammonium citrate,0.22% KH2PO4,0.13% MgSO4,0.02% VB1,culture temperature 29.5 ℃,and fermentation time 10 days. Under this condition,the total ganoderic acids content was 24.93 mg every gram of theganodermalucidummycelium and corn powder,and ganoderic acid Mk,ganoderic acid S and ganoderic acid content reached 0.86,0.69 and 3.69 mg/g,respestively.Production of three ganodericacids byGanodermalucidumsolid-state fermentation has good application prospect.
Ganodermalucidummycelium;solid-state fermentation;Plackett-Burman design;response surface methodology
2016-11-17
陈红(1993-),男,硕士研究生,研究方向:灵芝酸提取、纯化及发酵优化,E-mail:13771099158@163.com。
*通讯作者:余晓斌(1965-),男,博士,教授,研究方向:发酵法生产功能食品因子,E-mail:xbyu@jiangnan.edu.cn。
TS201.3
A
1002-0306(2017)11-0167-06
10.13386/j.issn1002-0306.2017.11.023

