白皮杉醇抑制前列腺癌细胞株增殖、迁移与侵袭*
李章春 , 李 珀, 邓超男, 罗 恒
(1黔南民族医学高等专科学校基础医学部,贵州 都匀 558000; 2贵州医科大学附属医院病理科,贵州 贵阳 550004;3贵阳市第一人民医院泌尿外科,贵州 贵阳 550003)
白皮杉醇抑制前列腺癌细胞株增殖、迁移与侵袭*
李章春1△, 李 珀2, 邓超男2, 罗 恒3
(1黔南民族医学高等专科学校基础医学部,贵州 都匀 558000;2贵州医科大学附属医院病理科,贵州 贵阳 550004;3贵阳市第一人民医院泌尿外科,贵州 贵阳 550003)
目的: 观察白皮杉醇对前列腺癌细胞株DU145的细胞活力、迁移与侵袭能力的作用并初步讨论其机制。方法: CCK-8法检测不同浓度白皮杉醇(0、5、10、20、40和80 μmol/L)作用不同时间(12、24、36和48 h)对DU145细胞活力的影响;划痕实验与Transwell小室法分别检测白皮杉醇对DU145细胞迁移与侵袭能力的影响;Western blot法检测p-JAK2与p-STAT3的蛋白水平。结果: CCK-8法结果显示白皮杉醇呈浓度依赖性抑制DU145细胞的活力;给予白皮杉醇干预后,细胞迁移数和侵袭数显著减少,p-JAK2与p-STAT3蛋白水平显著下降。结论: 白皮杉醇呈浓度依赖性抑制前列腺癌细胞的生长,并具有抑制细胞迁移与侵袭的作用,其机制可能与抑制JAK2/STAT3信号通路有关。
白皮杉醇; 细胞活力; 细胞迁移; JAK2/STAT3信号通路
前列腺癌(prostate cancer,PCa)是老年男性常见的一种恶性肿瘤,在全球各种癌症的死亡率中位居第二[1]。我国的前列腺癌发病率低于西方发达国家,但随着生活水平的提高以及饮食结构的改变,老龄化人口的逐渐增多,前列腺癌的发病率呈逐渐上升的趋势,严重地影响我国老年男性健康[2]。前列腺癌的发病机制至今尚未清晰,大多数患者确诊时已处于肿瘤中晚期,并出现骨转移,导致患者预后不良[3]。
白皮杉醇(piceatannal,PIC)主要存在于葡萄、大黄和甘蔗中,不稳定,易氧化[4]。研究表明其分子结构中存在2个苯环和多个羟基,它们与白皮杉醇的抗氧化与清除氧自由基作用相关。多项研究发现白皮杉醇能够抑制促使肿瘤细胞发生发展的酶,如环氧化酶、过氧化氢酶、细胞色素P450和核苷酸还原酶等,进而干扰肿瘤细胞的生长,从而发挥抗肿瘤的作用[5]。此外,白皮杉醇具有抗氧化作用,减缓过量活性氧和自由基对DNA的损伤,降低癌症的发生率[6]。本文拟研究白皮杉醇对前列腺癌细胞株DU145的活力、迁移和侵袭能力的作用,并探讨其初步的作用机制。
材 料 和 方 法
1 实验材料
人前列腺癌DU145细胞株购自上海中科院细胞库;白皮杉醇购自成都德思特生物技术有限公司;青霉素和链霉素购自华北制药集团公司;胰蛋白酶购自Sigma;CCK-8试剂购自武汉博士德生物工程有限公司;抗p-JAK2与p-STAT3抗体购自Santa Cruz。
2 方法
2.1 细胞的培养、传代 将DU145细胞加入含有10%胎牛血清,青霉素与链霉素各1×105U/L的RPMI-1640培养液,置于37 ℃、5% CO2的恒温培养箱中培养,2~3 d 更换培养基1次。实验取对数生长期细胞。细胞传代:待细胞融合至80%~90%,0.25%胰蛋白酶消化,吹打至细胞悬液,1 000 r/min离心5 min,弃去上清,用培养基重悬,置于恒温培养箱中培养,6 h后换液。
2.2 CCK-8法检测DU145细胞的活力 取在对数生长期的细胞悬液按每孔3×103个接种于96孔板,待细胞贴壁后,分别加入白皮杉醇使最终浓度分别为0、5、10、20、40和80 μmol/L,分别继续培养12、24、36和48 h,弃去上清液,每孔加入CCK-8溶液10 μL,在5% CO2、37 ℃恒温培养箱中培养4 h,用酶联仪于450 nm处测量吸光度(A)。
2.3 实验分组 空白对照组(control),不给药处理;溶剂对照组(vehicle),加入同等剂量的甲醇溶剂;药物组(PIC组),加入40 μmol/L的白皮杉醇;各组进行相应处理后继续培养36 h,进行后续实验。
2.4 划痕实验 收集各组细胞,以2×108/L接种于48孔板中,待细胞融合到80%~90%,用枪头沿着与皿底垂直方向划痕,PBS洗涤3次,加入无血清培养基,置于37 ℃、5% CO2恒温培养箱培养24 h后,观察细胞迁移轨迹,记录数据,计数。
2.5 Transwell小室检测细胞侵袭能力 将4 ℃预冷的无血清培养基稀释Matrigel,使终浓度为1 g/L,于小室底部中央垂直加入100 μL稀释后的Matrigel,37 ℃温育使成胶状。将处于对数生长期的各组细胞,计数后调整细胞浓度为5×108/L,于Transwell小室的上室中加入100 μL细胞悬液,下室中加入含10%胎牛血清的RPMI-1640培养液。在5% CO2、37 ℃恒温培养箱中培养24 h,PBS洗2次,10%甲醛固定15 min,结晶紫染色30 min,于倒置显微镜下观察计数。
2.6 Western blot实验 收集各组细胞,用RIPA细胞裂解液裂解,提取总蛋白后采用BCA法定量,调整蛋白浓度。取适量裂解产物,上样后进行SDS-PAGE,电转至硝酸纤维素膜,加入5%脱脂奶粉封闭液室温封闭1 h,孵育相应 I 抗[p-JAK2(1∶1 000)、p-STAT3(1∶1 000)、JAK2(1∶4 000)、STAT3(1∶4 000)和GAPDH(1∶4 000)],4 ℃孵育过夜,洗膜后,室温孵育相应 II 抗1 h,洗膜,使用化学发光法试剂盒对PVDF膜进行曝光显影,成像扫描分析系统测定目的和内参照条带的吸光度。
3 统计学处理
所有数据采用SPSS 15.0统计软件进行分析,实验结果以均数±标准差(mean±SD)表示,多组定量数据两两比较,符合方差齐性要求,各组间均数比较时采用Bonferroni校正的t检验,以P<0.05为差异有统计学意义。
结 果
1 白皮杉醇对DU145细胞活力的影响
结果显示,给予药物干预的细胞存活率显著下降,并随时间延长而存活率降低,至36 h降到最低值,36 h与48 h的相对存活率无显著差异。如图1所示,36 h时20 μmol/L与40 μmol/L白皮杉醇对细胞的活力抑制率分别是(56.36±3.2)%与(44.54±3.2)%,为了得到较好的实验结果,我们选取40 μmol/L白皮杉醇培养细胞36 h进行后续实验。

Figure 1.The effect on the survival rate of DU145 cells by piceatannol. Mean±SD.n=6.
图1 白皮杉醇对DU145细胞相对存活率的影响
2 白皮杉醇对DU145细胞迁移能力的影响
划痕实验结果显示给予药物干预的DU145细胞的迁移能力显著低于空白对照组(P<0.05),空白对照组与溶剂组间无显著差异,见图2。
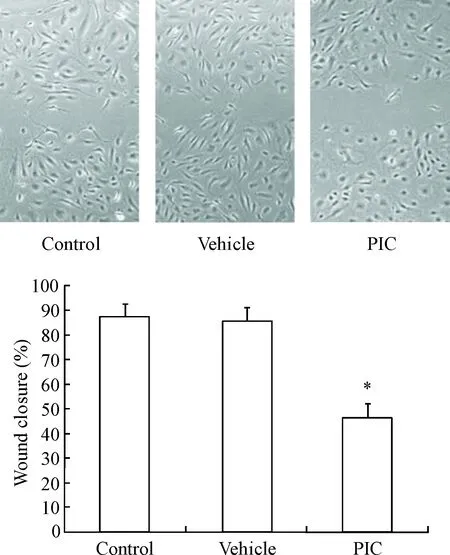
Figure 2.The effect of piceatannol on the migration of DU145 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图2 白皮杉醇对DU145细胞迁移能力的影响
3 白皮杉醇对DU145细胞侵袭能力的影响
Transwell实验结果显示,与空白对照组相比,药物组发生侵袭的细胞数显著降低,差异具有统计学意义(P<0.05),空白对照组和溶剂组侵袭的细胞数之间的差异无统计学显著性,见图3。

Figure 3.The effect of piceatannol on the invasion of DU145 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图3 白皮杉醇对DU145细胞侵袭能力的影响
4 白皮杉醇对p-JAK2与p-STAT3蛋白表达水平的影响
Western blot实验结果显示药物组细胞中的p-JAK2与p-STAT3蛋白水平显著低于空白对照组(P<0.05),空白对照组和溶剂组间差异无统计学显著性。t-JAK2、t-STAT3的蛋白变化水平的差异无统计学显著性,见图4。

Figure 4.The effect of piceatannol on the protein expression of p-JAK2 and p-STAT3. Mean±SD.n=3.*P<0.05vscontrol group.
图4 白皮杉醇对p-JAK2与p-STAT3蛋白表达水平的影响
讨 论
白皮杉醇是白藜芦醇的羟基化类似物,二者具有相似的生物活性,如抗氧化、抗炎、抗癌和清除自由基等[7]。研究发现白皮杉醇可以抑制肿瘤细胞DNA的合成,诱导细胞周期中G1期缩短,降低CDK2和CDK4的含量,并在24 h内抑制CDK2和CDK4的活性[8]。我们研究发现白皮杉醇抑制前列腺癌细胞的存活率,与药物浓度和时间具有依赖性。此外,实验表明白皮杉醇具有抑制前列腺癌细胞迁移数和侵袭数的作用,提示白皮杉醇可能对前列腺癌细胞株的增殖、迁移和侵袭具有抑制作用。
STAT家族是体内一类重要的转录因子,对多种信号的转导具有非常关键的作用,其中STAT3与肿瘤的发生发展关系密切,在多种肿瘤中发现STAT3的异常表达与活化,具有促进肿瘤发生发展的作用[9]。研究发现干扰STAT3表达后,胰腺癌细胞株SW1990体外侵袭力和动物体内转移能力均减弱[10]。JAK家族蛋白包括JAK1、JAK2、JAK3及酪氨酸激酶2四个结构功能相似的蛋白。通常,STAT3以非磷酸化的形式存在于胞浆中,当细胞受到刺激后,STAT3磷酸化后被激活,进入细胞核,通过与靶基因相应的碱基对序列结合,调节基因转录[11-12]。已有报道指出姜黄素的结构类似物通过抑制JAK2/STAT3信号通路,进而促进了人肾癌细胞和黑色素细胞的凋亡[13];另外通过抑制JAK2/STAT3信号通路,抑制乳腺癌细胞周期并抑制肿瘤的生长与转移[14]。我们实验发现给予白皮杉醇干预后,JAK2与STAT3的磷酸化水平均显著下降,提示白皮杉醇可能通过抑制JAK2与STAT3的磷酸化,从而抑制相应癌基因的表达,进而抑制前列腺细胞的活力、迁移与侵袭。
[1] Jemal A, Siegel R, Ward E, et al. Cancer, statitics[J]. CA Cancer J Clin, 2007, 57(6):43-66.
[2] 吴阶平, 顾方六, 郭应禄, 等. 吴阶平泌尿外科学[M]. 济南: 山东科学技术出版社, 2005:965-980.
[3] Edlind MP, Hsieh AC. PI3K-AKT-mTOR signaling in prostate cancer progression and androgen deprivation therapy resistance[J]. Asian J Androl, 2014, 16(3):378-386.
[4] Son Y, Lee JH, Cheong YK, et al. Piceatannol, a natural hydroxylated analog of resveratrol, promotes nitric oxide release through phosphorylation of endothelial nitric oxide synthase in human endothelial cells[J]. Eur Rev Med Pharmacol Sci, 2015, 19(16):3125-3132.
[5] 刘芝兰, 曾春娇, 吴梅青, 等. 白藜芦醇与白皮杉醇及赤松素研究进展[J]. 医药导报, 2013, 3(8):1043-1049.
[6] Seyed MA, Jantan I, Bukhari SN, et al. A comprehensive review on the chemotherapeutic potential of piceatannol for cancer treatment, with mechanistic insights[J]. J Agric Food Chem, 2016, 64(4):725-737.
[7] 李晓霞, 晏日安, 段翰英. 白皮杉醇的合成及抗氧化活性研究[J]. 食品与发酵工业, 2011, 37(4):78-81.
[8] Lee YM, Lim DY, Cho HJ, et al. Piceatannol, a natural stilbene from grapes, induces G1cell cycle arrest in androgen-insensitive DU145 human prostate cancer cells via the inhibition of CDK activity[J]. Cancer Lett, 2009, 285(2):166-173.
[9] 孙 莹, 于 浩, 张 灵, 等. STAT3-siRNA对胃癌细胞株SGC-7901增殖与凋亡的影响[J]. 中国病理生理杂志, 2010, 26(2):393-395.
[10]Qiu Z, Huang C, Sun J, et al. RNA interference-mediated signal transducers and activators of transcription 3 gene silencing inhibits invasion and metastasis of human pancreatic cancer cells[J]. Cancer Sci, 2007, 98(7):1099-1106.
[11]Kim DJ, Chan KS, Sano S, et al. Signal transducer and activator of transcription 3 (Stat3) in epithelial carcinogenesis[J]. Mol Carcinog, 2007, 46(8):725-731.
[12]Frank DA. STAT3 as a central mediator of neoplastic cellular transformation[J]. Cancer Lett, 2007, 251(2):199-210.
[13]Shen XJ, Wang HB, Ma XQ, et al. β, β-Dimethylac-rylshikonin induces mitochondria dependent apoptosis through ERK pathway in human gastric cancer SGC-7901 cells[J]. PLoS One, 2012, 7(7):e41773.
[14]Su JC, Lin KL, Chien CM, et al. Concomitant inactivation of the epidermal growth factor receptor, phosphatidylinositol 3-kinase/Akt and Janus tyrosine kinase 2/signal transducer and activator of transcription 3 signalling pathways in cardiotoxin III-treated A549 cells[J]. Clin Exp Pharmacol Physiol, 2010, 37(8):833-840.
(责任编辑: 林白霜, 罗 森)
Piceatannol inhibits prostate cancer cell proliferation, migration and invasion
LI Zhang-chun1, LI Po2, DENG Chao-nan2, LUO Heng3
(1SchoolofBasicMedicalSciences,QiannanMedicalCollegeforNationalities,Duyun558000,China;2DepartmentofPathology,TheAffiliatedHospitalofGuizhouMedicalUniversity,Guiyang550004,China;3DepartmentofUrinarySurgery,GuiyangFirstPeople’sHospital,Guiyang550003,China.E-mail:medlizhangchun@163.com)
AIM: To investigate the effect of piceatannol on the viability, and the abilities of migration and invasion in the prostate cancer cells.METHODS: DU145 cells were treated with piceatannol at different doses (0, 5, 10, 20, 40 and 80 μmol/L) for different time (12, 24, 36 and 48 h) as indicated. The cell viability was assessed by CCK-8 assay. The migration and invasion abilities of the cells were analyzed by wound healing assay and Transwell assay, respectively. The protein levels of p-JAK2 and p-STAT3 were detected by Western blot.RESULTS: Piceatannol dose-dependently decreased the cell viability. After treatment with piceatannol, the abilities of migration and invasion of the cells were significantly inhibited. Moreover, treatment with piceatannol resulted in marked decreases in the protein levels of p-JAK2 and p-STAT3. CONCLUSION: Piceatannol inhibits the viability, migration and invasion of the prostate cancer cells via regulating the JAK2/STAT3 signaling pathway.
Piceatannol; Cell viability; Cell migration; JAK2/STAT3 signaling pathway
1000- 4718(2017)06- 1130- 04
2016- 11- 16
2017- 02- 22
贵州省卫生厅科学技术基金项目(No. gzwkj2010-1-068)
R730.23; R965
A
10.3969/j.issn.1000- 4718.2017.06.028
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0854-8308020; E-mail: medlizhangchun@163.com

