高通量测序技术检测循环血肿瘤DNA在肝细胞癌中的应用
严海强,孙志为,孟春城,陈业盛,张丽菊,卢洪巧
(1.云南省中医学院,云南 昆明 6505042;2.云南省第一人民医院肝胆外科,云南 昆明 650034)
高通量测序技术检测循环血肿瘤DNA在肝细胞癌中的应用
严海强1,2,孙志为2*,孟春城2,陈业盛2,张丽菊2,卢洪巧2
(1.云南省中医学院,云南 昆明 6505042;2.云南省第一人民医院肝胆外科,云南 昆明 650034)
肝细胞癌是全球最常见的恶性肿瘤之一,中国已是世界“肝癌第一大国”,它严重危害着世界各国人民的身体健康。由于当前常规的影像学及血清学检查早期诊断率低,加之肝细胞癌恶性程度高,预后差等特点,临床确诊患者大多数为中晚期,失去了手术机会,防治形势非常严峻。目前研究显示,肝细胞癌与DNA缺陷关系密切,肝癌患者早期外周血即可检测到循环血肿瘤DNA。随着测序技术的飞速发展,如今的高通量测序技术为测定循环血肿瘤DNA提供了技术支持,本文总结了近年来基于高通量测序技术检测循环血肿瘤DNA在肝细胞癌的基础和临床应用方面的经验,以期能对肝细胞癌的诊治带来有益帮助。
高通量测序技术;循环血肿瘤DNA;肝细胞癌
肝细胞癌(hepatocellular carcinoma,HCC,以下简称肝癌)是世界范围内肿瘤发病率第五顺位的恶性肿瘤[1],我国是肝癌的高发国家,2008年统计数据显示我国肝癌发病率占全球总发病率的40%[2],成为“全球第一大国”,且近年来肝癌在我国恶性肿瘤死亡率中从第3顺位上升至第2顺位[3]。从病因学来看,在全球范围,丙型肝炎病毒(hepatitis c virus,HCV)感染是肝癌的主要病因,我国肝癌的病因因素主要有乙型肝炎病毒(hepatitis b virus,HBV)感染、食物黄曲霉毒素(aflatoxin,AF)污染、长期酗酒以及农村饮水蓝绿藻类毒素污染等,其中首要因素就是HBV的感染[4]。我国肝癌发病率及死亡率居高不下,且有上升趋势,已经严重危害着我国居民的身体健康,造成了巨大的社会及经济负担,防治形势非常严峻。由于肝癌的早期诊断对于有效治疗和长期生存至关重要, 因此, 目前十分强调肝癌的早期筛查和早期监测。
1 肝癌的诊疗现状
1.1 HCC的诊断
HCC是根据临床表现、检查结果,针对不同情况进行综合诊断的,而这种诊断流程比较适用于有明显临床症状的中晚期肝癌患者,绝大多数无明显临床症状早期肝癌患者,我们只能进行常规检查来筛查。我们发现就目前的筛查方式来看,肝癌的早期诊断率仍然较低,绝大多数发现患病后已到中晚期。目前临床上诊断肝癌的方法虽然较多,如核磁共振、超声、CT、肿瘤标记物检测等。但无论是超声、核磁共振还是CT,对肝原发性病变的性质有时难以肯定,肝硬化失代偿期单纯通过影像学资料来鉴定肝癌和肝硬化结节比较困难,同时,影像学检查不易发现体积较小的肿瘤,所以存在较大的漏检率,虽肿瘤标记物检测对于发现早期肝癌相比影像学有优势,能比影像学提前3~5个月发现肿瘤或肿瘤的复发、转移,但国内外研究证实,其对于诊断早期肝癌也存在一定的漏检率[5]。
1.1.1 超声
超声作为一种无创、实时、便捷的影像检查方法,在肝癌的诊断和治疗领域已有广泛的临床应用,但研究报告显示,常规彩超对于肝癌的诊断确诊率只有69.6%[6],对于小肝癌(病灶大小≤2 ㎝)许-刘[7]等人研究显示应用超声造影(CEUS)的诊断确诊率可达87.3%,可以发现常规彩超对于肝癌确诊率很低,虽CEUS对于早期肝癌的确诊率较高,不容乐观的是仍然有12.7%的早期肝癌患者得不到有效诊治。
1.1.2 CT和MRI
国外有研究显示,在不考虑肝癌病灶大小的情况下,MRI和CT的诊断确诊率区间分别为77%~100%和77%~91%,当病灶>2 ㎝时,两者确诊率接近100%,而当病灶≥1 ㎝且≤2 ㎝时,MRI的确诊率降到45%~80%,C T的确诊率降到40%~75%,当病灶<1 cm,病变性质不能描述,建议随访[8]。我们发现病变大小是一个决定MRI和CT确诊率的重要因素,病灶越小其确诊率越低,故而对肝癌的早期诊断也不佳。
1.1.3 肿瘤标记物检测
肝癌患者的血清学肿瘤标记物检测是目前作为其早期诊断主要手段之一,其中应用最广泛的血清学肿瘤标志物甲胎蛋白(alpha fetoprotein,AFP)于肝癌的早期临床检测取得了显著成效,但综合多数研究发现其敏感度只有39%~65%,特异度只有65%~94%,且约有10%~30%的肝癌患者AFP为阴性[9]。国外还有研究结果表明,甲胎蛋白异质体3(hs-AFP-L3)可能是一个有价值的生物标志物检测早期肝癌,但其灵敏度和特异性也只有40.4%和81.1%[10]。虽高兴的是有研究发现Des-γcarboxyprothrombin-1一羧基凝血酶原(DCP)、高尔基体糖蛋白73(GP73)、甲胎蛋白(AFP)三指标联合检测对肝癌的早期诊断的阳性检出率达到86.8%[11],但还是有多达13.2%的患者不能检出。综上我们可以发现肝癌患者的早期诊断仍然是很困难的,所以早期的防治形势很严峻。
1.2 HCC的治疗
肝癌的早期诊断率仍然较低,绝大多数发现患病后已到中晚期,其中只有有限的病人(少于30%),可以应用包括手术切除、肝脏移植、射频消融术、肝动脉栓塞术/肝动脉化疗栓塞术(transarterial embolization/ chemoembolization,TAE/TACE)、分子靶向治疗、多学科综合治疗(multidisciplinary team,MDT)等治疗方式进行治疗,且其预后及预期寿命都很难预测[12]。而其中这大部分已失去有效治疗的中晚期患者,只能行对症支持治疗的姑息治疗手段,以期改善临终生活质量,也就造成了医疗资源的极大浪费,医疗成本的显著增加。目前对于肝癌治疗外科手术仍是首选,且研究发现小肝癌(早期肝癌)术后生存率(无瘤生存率):5年为85.0%(64.3%),10年为67.9%(42.2%)[13],因此肝癌早诊断于其防治意义特别重大。
考虑到肝癌的高度复杂性和高度异质化,目前在肝癌的临床治疗中,特别强调规范化的多学科合作的综合治疗,同时在这基础层面上,提出要针对于每个患者自身具体情况及某一患者的疾病不同阶段进行评估,以期达到精准化的个体治疗。本文通过对比肝癌常规诊疗方式,结合当今先进技术,提出高通量测序技术检测循环血肿瘤DNA在肝细胞癌的应用一旦技术成熟,将极大提高肝癌的早期诊断率,甚至达到100%的早期诊断率,今后将会对于肝细胞癌的诊治带来极大的帮助。
2 循环血肿瘤DNA(circulating tumor DNA,ctDNA)
研究发现,在分子层面上某些具有特殊功能基因的空间结构的改变,是肿瘤发生的根源所在。这些结构的改变是肿瘤发生发展的分子基础,一般表现在单一或多种基因突变、重组等,其结果是原癌基因的激活或抑癌基因的失活,同时在肿瘤不同生长时期,自身原癌基因或抑癌基因的激活程度是有显著差别的[14]。通常情况下从首发的基因空间结构改变到最终发生临床肿瘤,一般需要数年甚至数十年时间跨度。因此,如果我们可以在基因空间结构改变到转变成为肿瘤的这个时间跨度内,设法筛检到患者血液内肿瘤自身产生的特异性核酸,那么以其为标志物,我们就有期实现对肿瘤的发生、发展进行实时检测,从而可以有效的诊断和预测,设计良好的治疗方案达到最优疗效[15]。大量研究发现,一些具有侵袭和微转移生物学特性的肿瘤细胞,早期可以通过浸润和损害宿主结缔组织进入血管和淋巴管。此外,不恰当的诊疗操作也会促使肿瘤细胞人为因素扩散,从而进入外周血液循环系统。通常我们把因自身扩散和转移,或着因诊疗操作诱发进入人体外周血的肿瘤细胞称为循环血肿瘤细胞(circulating tumor cell,CTC)[16]。如上述,技术上假如可以在早期肿瘤患者的外周血液中检测到循环肿瘤细胞,然后进一步了解肿瘤细胞的基因突变情况,那么对于肿瘤病人的早期诊断以及个体化的精细治疗是具有非常重要的意义17。但数据表明,在早期肿瘤患者的外周血中肿瘤细胞的数量是极少的,一般情况下在约1×108个白细胞或者5×1010个红细胞中只有几个至十几个不等的肿瘤细胞,对于这些通过外周血液循环进行转移的细胞,现有常规的影像学及血清肿瘤标记物等检测方法,是无法直接观测的。庆幸的是循环血肿瘤DNA是除循环肿瘤细胞外,实现肿瘤分子水平诊断的另一种更为行之有效的方法。循环血肿瘤DNA(ctDNA)是循环血中游离于细胞外的机体内源性肿瘤DNA,一般认为肿瘤游离DNA主要来源于凋亡与坏死的肿瘤细胞。
循环血肿瘤DNA是一种无细胞状态的胞外肿瘤DNA,广泛存在于人体体液中,主要包括在血液、脑脊液以及滑膜液等体液中,其存在方式有两种形式,其一是游离DNA,包括单链DNA结构或双链DNA结构以及单链与双链DNA混合结构三种类别,其二是DNA-蛋白质复合物。早在1947年Mandel和Metais就发现了循环核酸。经过一段时期,Leon等人在1977年第一次发现了肿瘤患者血清或血浆中的ctDNA浓度值较高,大约是正常人10~100倍,这一结论的问世,为后续对肿瘤分子诊断研究,带了前所未有的新思路和新方法18。目前,对于肿瘤患者外周血循环ctDNA升高的原因有多种解释,但普遍接受的观点有以下3种:a、外周血循环肿瘤细胞及其局部或远处微转移灶的裂解;b、原发肿瘤内的肿瘤细胞的坏死或程序性凋亡;c、增生旺盛的肿瘤细胞自发性释放核苷酸[19]。据文献研究报告,上述对于外周血循环ctDNA升高的原因中,增生旺盛的肿瘤细胞自发性释放核苷酸及原发肿瘤内的肿瘤细胞的坏死或程序性凋亡,能更好的解释外周血ctDNA浓度的升高,因为,如果用外周血循环肿瘤细胞及其局部或远处微转移灶的裂解来解释太过牵强,依据我们检测到的肿瘤患者外周血ctDNA浓度来推算,若要满足这一测值要求,那么血液中应含肿瘤细胞至少要达到1000~10000个/mL,而实际能检测到肿瘤细胞<10个/mL,显然这一观点不是最优的解释20。鉴于ctDNA与肿瘤的相关性高,具有显著的特异性,同时相比于从数量庞大的血细胞中检测出数个肿瘤细胞,往往更容易从高浓度的外周血中发现ctDNA,同时对比于影像学、血清学等常规检测方法发现的肿瘤组织发生阶段,外周血ctDNA浓度的变化要远早于其发现的阶段,甚至在肿瘤刚刚萌发的时候ctDNA浓度就有改变。因此ctDNA更加适合作为肿瘤早期诊断的标志物。时至今日,通过对肿瘤患者外周血循环核酸中ctDNA进行实时定量和定性检测,将有望应用在临床肿瘤的早期诊断、判断疗效、评估预后、随访跟踪等方面,从而成为一种新的特异、快捷、方便、微创或无创的肿瘤分子生物学检测方法。
3 ctDNA突变基因检测
虽然ctDNA相对于循环肿瘤细胞在血液中的含量较高,但在循环核酸总量中所占比例是非常低的,因为血液中绝大多数循环核酸是来源于正常细胞凋亡所释放的(称之为野生型),仅少数来源于肿瘤细胞的核酸即ctDNA(称之为突变型)。数据表明,在肿瘤患者早期其ctDNA占循环核酸总量仅有0.01%~1.7%,即使在中晚期肿瘤患者中其所占的比例也只有8%~10%[21]。此外,突变型与野生型结构上并没有显著差别,通常只有一个或数个碱基的差别,因此基因带来的理化特性变化很小,无疑使得ctDNA检测变得极为困难,这也就对于其检测的技术提出了更高的要求,要求具有更高的灵敏度和特异度。当今,ctDNA检测的“金标准”是核酸序列分析技术,即DNA测序技术,常规聚合酶链式反应(polymerase chain reaction,PCR)技术,这种测序技术仅能检测到样本中比例高于20%的突变型,但由于外周血中大量野生型的存在,故难以满足检测外周血循环核酸中低含量突变型核酸(ctDNA)的要求[22]。现如今随着测序技术的飞速发展,二代测序技术即高通量测序技术,为这种检测提供了可能。
4 高通量测序技术(High-throughput sequencing)
随着技术的发展,自2005年以来,以Roche公司为首的454技术、Illumina公司的Solexa技术和ABI公司的SOLiD技术为标志的高通量测序技术相继诞生,极大的改善了之前的这种困境。虽然高通量测序技术建立的时间不长,但发展非常快。已经应用于基因组,包括测序和表观基因组学以及功能基因组学研究的许多方面[23]。时至今日,由于DNA测序技术的进一步改进(Schuster,2008),测序的规模也从以往每天只能测定几十到几千个碱基序列发展到了如今的一次进行成千上万个序列精确测定的水平,使得基因方面的研究逐步进入了基因组和后基因组时代(Pan等,2008)。这种以一次并行对几十万到几百万条DNA分子的序列测定和一般读长较短等为标志的技术称为高通量测序技术又称“下一代”测序技术("Next-generation" sequencing technology)[24]。目前,通常所说的高通量测序技术主要是指454 Life Sciences公司、ABI公司和Illumina公司推出的第二代测序技术以及Helicos HeliscopeTM和Pacific Biosciences推出的单分子测序技术,当今一些主流的测序平台归纳如下(表1)。

表1 主流测序平台一览
5 高通量测序技术在肝癌中的应用
5.1 肝癌的早期筛查
研究表明肝癌的发病机制是涉及多个基因突变的复杂过程,目前已发现了众多癌基因与肝癌易感性关联度大,经查阅大量文献发现,截至到2015为止其易感基因有201个之多,其中国内外学者做过荟萃分析的有以下34个基因,分别是:CYP1A1、CYP2E1、EGF、EPHX1、ERCC2、GSTM1、GSTP1、GSTT1、HFE、HLA-DQ、HLA-DQB1、HLA-DRB1、IFNL3、IL10、IL1B、IL6、KIF1B、MDM2、MIR146A、MIR196A2、MIR499A、MTHFR、NAT2、OGG1、PNPLA3、PTGS2、SOD2、STAT4、TGFB1、TNF、TP53、UGT1A7、XRCC1、XRCC3。我国有学者有研究发现与肝癌高度相关的关键基因有11个,分别是:TP53、IL6、TGFB1、TNF、ESR1、VEGFA、HIF1A、STAT1、IFNG、SOD2、GTNNB1[25]。从这些数据可以发现肝癌不是一个单基因突变的恶性肿瘤,且到目前为止也没有很明确位点,但是随着研究的深入,我们可以将一些研究透彻的关键性的基因作为筛查的靶点基因,然后将其制备成DNA文库(CDNA)作为筛查的探针用,同时基于在早期肝癌患者的血液中即有CtDNA存在的分子基础,随后应用高通量测序技术进行检测患者血液中是否存在肝癌相关的CtDNA,以期早期诊断。同时我们还可以利用该技术发现新的与肝癌相关的癌基因,从而进一步扩充CDNA,以不断提高筛查的准确度,不断向着确诊率100%的目的前进,最终以希成为除了组织病理病检之外的另一金标准,我们可以将其称为病检的另一种形式“液体活检”。见图1。
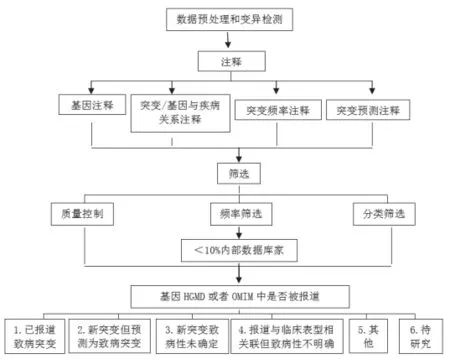
图1 高通量测序数据分析和临床诊断流程
5.2 依据检测出来的靶点指导治疗
随着高通量测序技术的不断发展及应用的进一步成熟,那么对于肝癌早期诊断将变得很简单,也就越来越多的肝癌患者在很早期就被诊断出来,此时癌肿的原发灶都还处于微型病灶,对于现在常规治疗肝癌方法中的“手术切除、射频消融术、TAE/TACE”针对实体肿瘤的这些方式将很少使用了,更多可能是针对靶点的药物治疗,就目前研究来看,针对肝癌的药物治疗有以索拉菲尼为代表的分子靶向治疗及以奥沙利铂联合氟尿嘧啶/亚叶酸钙(FOLFOX)方案为代表的化学治疗。我们发现目前分子靶向治疗药物还只是针对中晚期肝癌的病人进行治疗,且价格昂贵,但在可预期的未来,随着高通量测序技术检测循环血肿瘤DNA在肝癌中的临床应用不断成熟,越来越多的肝癌相关的关键性的靶点被发现,以及针对靶点药敏性不断研究,我们相信会有越来越多的靶向治疗药物问世并将会逐步应用于早期肝癌的治疗,同时可能联合化疗药物一并使用,那么对于肝癌患者的生存时间将会带来极大的提高。
6 展 望
虽然目前在临床上尚没有高通量测序技术检测循环血肿瘤DNA在肝细胞癌的临床应用,但随着技术的发展,随着测序成本的不断降低及对庞大的测序数据处理能力的进一步提高,相信在不久的将来高通量测序技术将会成为一种肿瘤常规的临床检测手段,并为肝细胞癌的早期诊治带来革命性的变革。这些革命性的变革主要会表现在以下几方面:第一、应用上述技术通过对大样本的肝癌患者的全景基因分析,将会有越来越多的肝癌主流治疗方式,将进一步向药物治疗靠拢。第三、根据肝癌患者检测到的不同突变靶点,设计不同的治疗方式,完全达到个体化精准治疗目标。第四、可探究不同作用靶点药物之间联合用药的临床药效关系,从而规范用药方针。鉴于该领域的无限前景,本文尝试综述之。
[1] A.Raza,and G.K.Sood,'Hepatocellular Carcinoma Review:Current Treatment,and Evidence-Based Medicine',World J Gastroenterol,20(2014),4115-27.
[2] S.L.Ye,T.Taka P.Bronowicki,'Current Approaches to the Treatment of Early Hepatocellular Carcinoma',Oncologist,15 Suppl 4 (2010),34-41.
[3] 张 玥,中国肝癌发病与死亡数据集,中华肿瘤杂志,09(2015).
[4] 陈建国.中国肝癌发病趋势和一级预防[A].第十三届全国肝癌学术会议论文集,2011:71-75.
[5] Ertle JM,Heider D,Wichert M,et al.A combination of α-fetoprotein and des-γ-carboxy prothrombin is superior in detection of hepatocellula1159/000346080.
[6] 张晓爽,彩超与mri诊断肝癌的对比分析,中国现代药物应用,17(2015).
[7] 许春梅,超声造影和增强 Ct 对微小肝癌的诊断价值,中国临床新医学,11(2015).
[8] T.Hennedige, and S. K. Venkatesh, 'Advances in Computed Tomography and Magnetic Resonance Imaging of Hepatocellular Carcinoma, World J Gastroenterol,22(2016),205-20.
[9] 谢康珍,肝细胞肝癌早期诊断肿瘤标志物的研究进展,中国实用医刊,05(2015).
[10] N.Tsuchiya,Y.Sawada,I.Endo,K.Saito,Y.Uemura,and T.Nakatsura,Biomarkers for the Early Diagnosis of Hepatocellular Carcinoma,World J Gastroenterol,21(2015),10573-83.
[11] 高 岚,Dcp、Gp73和afp联合检测在肝细胞癌早期诊断中的价值,中国实用医刊,18(2015).
[12] M.J.Song,Hepatic Artery Infusion Chemotherapy for Advanced Hepatocellular Carcinoma,World J Gastroenterol,21(2015),3843-9.
[13] H.Yokoi,and Y.Kawarada,[Current Status of Treatment for Small Hepatocellular Carcinoma] Gan To Kagaku Ryoho,23 (1996),855-61.
[14] Hanahan D,Weinberg RA.The hallmarks of cancer[J]. Cell,2000,100(1):57-70.
[15] Sidransky D.Nucleic acid-based methods for the detection of cancer[J].Science,1997,278(5340):1054-1059.
[16] Pantel K,Brakenhoff RH,Brandt B.Detection,clinical relevance and specec biological properties of disseminating tumour cells [J].Nat Rev Cancer,2008,8(5):329-340.
[17] Anja Sω,lpe,Klaus P,Stefan S,et al.Circulating tumor cell isolation and diagnostics:toward routine clinical use[J].Cancer Res,2011,71(18):5955-59.
[18] Leon SA,Shapiro B,Sklaroff DM,et al.Free DNA in the serum of cancer patients and the effect of therapy. Cancer Res,1977,37(3):646-650.
[19] Schwarzenbach H,Hoon DS,Pantel K.Cell-free nucleic acids as biomarkers in cancer patients [J].Nat Rev Cancer,2011,11(6):426-437.
[20] Anker P,Mulcahy H,Chen XQ,et al.Detection of circulating tumour DNA in the blood (plasmaJserum) of cancer patients.Cancer Metastasis Rev,1999,18(1):65-73.
[21] Holdhoff M,Schmidt K,Donehower R et al.Analysisof circulating tumor DNA to confmn somatic KRAS mutations[J].J Natl Cancer Inst,2009,101(18):1284-1285.
[22] Pao W,Ladanyi M.Epidermal grow factor receptor mutation testing in lung cancer:searching for the ideal method.Clin Cancer Res,2007,13(17):4954-4955.
[23] Mardis E R.Next-generation DNA sequencing methods.Annu Rev Genomics Hum Genet,2008,9:387-402.
[24] Schuster S C.Next-generation sequencing transforms today’s biology.Nat Methods,2008,5(1):16-18.
[25] 上官辉,谭淑燕,张积仁.肝癌易感性相关基因的文献计量学与生物信息学分析[J].中华肿瘤防治杂志,2015,22(04):305-311.
本文编辑:赵小龙
The application of circulating tumor DNA detections based on Highthroughput sequencing in hepatocellular carcinoma
YAN Hai-Qiang1,2, SUN Zhi-wei2, MENG Chun-cheng2, CHEN Ye-sheng2, ZHANG Li-ju2, LU Hong-qiao2
(1.College of traditional Chinese medicine in yunnan province,kunming,yunnan 6505042,China;2. The liver and gallbladder surgery,the first people's hospital of yunnan province of yunnan kunming 650034,China)
Hepatocellular carcinoma is one of the most common malignant tumors in the world. China is the world's first "liver cancer", which seriously endangers the health of people all over the world. As the current conventional imaging and serological examination of early diagnosis is low, combined with high degree of malignancy of hepatocellular carcinoma, poor prognosis and other characteristics, the majority of patients diagnosed in the advanced stage, the loss of surgical opportunities, prevention and treatment situation is very grim. Current studies have shown that hepatocellular carcinoma and DNA defects are closely related, early liver cancer patients can detect circulating tumor DNA. With the rapid development of sequencing technology, high-throughput sequencing technology for the determination of circulating tumor DNA provides technical support, this paper summarizes the recent high-throughput sequencing technology based on detection of circulating tumor DNA in hepatocellular carcinoma of the basic and clinical Application experience, with a view to the diagnosis and treatment of hepatocellular carcinoma can bring useful help.
High-throughput sequencing; Circulating tumor DNA; Hepatocellular carcinoma
R735.7
A
ISSN.2095-8242.2017.020.3950.04
云南省教育厅科学研究基金(NO.2015Z053)
孙志为

