葡萄叶提取物对葡萄生单轴霉菌游动孢子释放、萌发和游动性的影响
杨佳瑶++申红妙++贾招闪++郭金堂++冉隆贤

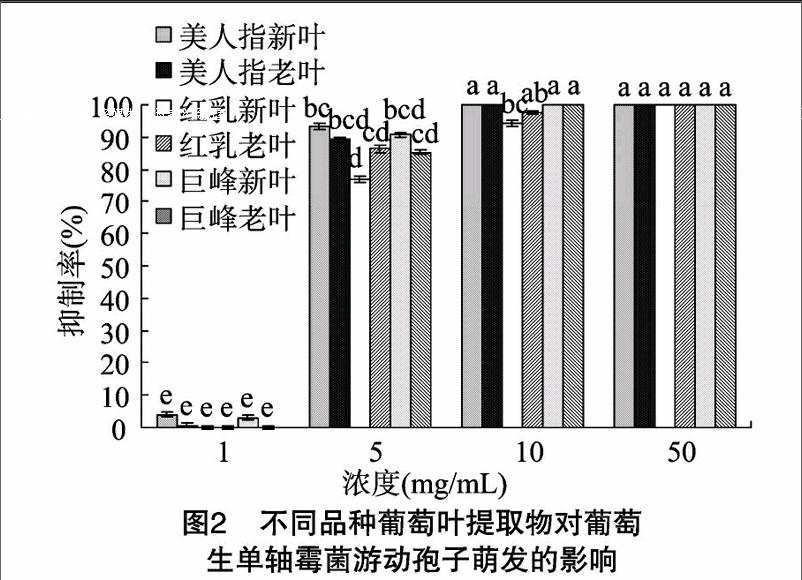
摘要:为了研究不同品种及叶龄的葡萄叶提取物对葡萄生单轴霉菌游动孢子的影响,选用3个葡萄品种,制备其新叶、老叶的乙醇提取物,测定不同提取物对葡萄生单轴霉菌游动孢子释放、萌发和游动性的影响。结果表明,不同品种的葡萄叶提取物对霜霉病菌的游动孢子均有明显的抑制作用,并且新老叶之间差异较小;抗病品种巨峰叶片提取物在浓度为5 mg/mL时对游动孢子释放、萌发的抑制率都能达90%,并能使游动孢子失去游动性;感病品种红乳叶片提取物在浓度为10 mg/mL以上时才能达到上述效果;感病品种美人指叶片提取物在浓度为5 mg/mL时对游动孢子萌发的抑制率可达90%,在浓度为10 mg/mL时才对游动孢子的释放、游动性具有强烈的抑制作用。由结果可知,抗病品种的葡萄叶提取物的抑制效果要好于感病品种,而同一品种的新叶和老叶之间差异基本不显著。
关键词:葡萄霜霉病;叶提取物;葡萄生单轴霉菌;葡萄;游动孢子;霜霉病防治
中图分类号: S436.631.1+9 文献标志码: A文章编号:1002-1302(2017)08-0079-03
葡萄霜霉病是世界上最严重的卵菌病害之一,多发生在雨水较多的地区和年份[1],在我国各葡萄產区均有分布,其病原为葡萄生单轴霉菌[Plasmopara viticola (Berk. et Curt.) Burl. et de Toni],属于藻物界(假菌界)卵菌门卵菌纲霜霉菌目单轴霉属,是一种专性寄生菌,主要危害葡萄的叶片、新梢、卷须、嫩梢、叶柄、花穗梗等[2]。该菌的无性阶段会产生大量孢子囊,在高湿、温暖的条件下,梨形的孢子囊会释放多个具有双鞭毛的游动孢子,当游动孢子靠近气孔后会收缩其鞭毛变为静止孢,随后萌发产生芽管,由气孔侵入寄主。孢子囊可以通过雨水、空气等条件传播后再次进行侵染。在适宜条件下,病菌传播迅速且危害巨大,每年都会给葡萄产业造成巨大的经济损失[3-4]。葡萄生单轴霉菌游动孢子的释放、游动、萌发是病菌完成侵染的关键,也是病害发生最重要的阶段和病害防治的关键时期。Islam等研究发现,2,4-二乙酰基间苯三酚(DAPG)及其衍生物对葡萄生单轴霉菌游动孢子的释放和游动性均有良好的抑制作用[5];Abdalla等研究发现,链霉菌ANK313菌株的代谢产物对葡萄生单轴霉菌游动孢子的游动性具有强烈的抑制作用,同时还表现出对游动孢子具有较强的溶解作用[6]。目前葡萄霜霉病的防治手段以化学农药为主,虽然化学农药具有高效、速效和经济的特点,但是由于大量使用,造成病原产生抗药性、破坏环境及影响人类健康等诸多弊端[7]。植物源农药主要来源于植物体内,其有效成分通常不是单一化合物,而是植物有机体中大部分有机物质。与化学农药相比,植物源农药具有环境相容性好、对非靶标生物安全、不易产生抗药性、生物活性多样、种类多、开发途径多等优点[8]。近年来,利用植物源提取物防治葡萄霜霉病的研究日渐增多,焦文哲研究表明,樟树、桉树、马齿苋的不同有机溶剂提取物对葡萄霜霉病具有很好的防治作用[9];郭秀萍等研究发现,葡萄、委陵菜以及无花果叶片的有机提取物能降低葡萄生单轴霉菌的侵染率[10]。
葡萄作为一种具有抗菌活性的生物质资源,具有广阔的发展前景。葡萄体内包含大量的抗微生物活性的化学成分,如酚酸类、鞣酸类、黄酮类和茋类等[11-12]。Schnee等在葡萄藤提取物中发现,6种物质对葡萄生单轴霉菌具有良好的抑制作用[13];袁茜等研究认为,葡萄叶有机提取物能明显抑制黄瓜、辣椒枯萎菌的生长[14];李晓琼等研究发现,圆叶葡萄叶提取物对南方根结线虫具有较强的毒杀活性[15]。关于葡萄不同抗性品种之间存在的抑菌物质的种类和含量是否存在差异,以及是否都能对葡萄生单轴霉菌游动孢子产生抑制作用尚未见报道。为了测定不同抗性葡萄品种,以及不同叶龄葡萄叶提取物对葡萄生单轴霉菌的抑制作用,本研究选取对霜霉病具有不同抗性的3个葡萄品种,制备其新叶、老叶的乙醇提取物,测定不同乙醇提取物对葡萄生单轴霉菌游动孢子释放、萌发和游动性的影响,旨在为葡萄叶提取物应用于葡萄霜霉病防治提供理论依据。
1材料与方法
1.1试验材料
供试葡萄品种巨峰、红乳、美人指的新叶、老叶均采自河北农业大学苗圃,其中巨峰为抗病品种,红乳、美人指为感病品种[16-17]。从枝条顶端以下算起,第2、3张叶片视为新叶,第6、7张叶片视为老叶。
葡萄生单轴霉菌,分离自河北农业大学苗圃发病叶片。
1.2试验方法
1.2.1葡萄叶提取物的制备将3个品种健康的新叶、老叶分别用清水洗净晾干,放入烘箱内于60 ℃烘至恒质量,用微型植物粉碎机粉碎后过40目筛。分别取过筛的材料,按料液比1 g ∶8 mL与95%乙醇混合,在40 ℃超声提取30 min,用4层纱布过滤;滤液于8 000 r/min离心20 min,取上清液在恒温下旋转蒸发至固态,最后用50%乙醇定容至原植物干样含量为1 g/mL的提取母液[14]。分别将母液用无菌水稀释成1、5、10、50、100 mg/mL备用。
1.2.2葡萄叶提取物对游动孢子释放的影响将新鲜病叶采回,用清水洗净,叶柄用脱脂棉包扎后置于铺有纱布的培养皿中,于20 ℃培养箱中保湿培养2 d,待新孢子囊成熟,用毛笔将孢子囊刷至无菌水中,用单层镜头纸过滤,配成浓度为106个/mL的孢子囊悬浮液[18]。然后将不同浓度葡萄叶提取物分别与孢子囊悬浮液按体积比1 ∶1混合,分别用5%乙醇、无菌水与孢子囊悬浮液按体积比1 ∶1混合作为对照,混合后放置在22 ℃光照培养箱内培养,2 h后置于200倍光学显微镜下观察,每个处理观察20个视野,记录每个视野下游动孢子的数量(个),并计算抑制率,相关公式:
游动孢子释放抑制率=[(对照游动孢子总数-处理游动孢子总数)/对照游动孢子总数]×100%。
1.2.3葡萄叶提取物对游动孢子萌发的影响孢子囊悬浮液的制备同“1.2.2”节,待游动孢子释放后加入NaCl,使悬浮液中NaCl含量为10 mmol/L,轻轻摇晃以促进游动孢子停止萌发[19]。然后将不同浓度葡萄叶提取物与悬浮液按体积比 1 ∶1 混合,分别用5%乙醇、无菌水与悬浮液按体积比1 ∶1混合作为对照,放入22 ℃光照培养箱中培养1 h,镜检游动孢子的萌发数,每个处理检验不少于200个独立的游动孢子,计算游动孢子萌发抑制率,相关公式:
游动孢子萌发抑制率= [(对照游动孢子萌发率-处理游动孢子萌发率)/对照游动孢子萌发率]×100%。
1.2.4葡萄叶提取物对游动孢子游动性的影响将浓度为106个/mL的孢子囊悬浮液置于22 ℃光照培养箱中2 h,待游动孢子被释放后,将悬浮液与不同葡萄叶提取物按体积比1 ∶1混合,分别用5%乙醇、无菌水与悬浮液按体积比1 ∶1混合作为对照,5 min后置于200倍光学显微镜下检查游动孢子的运动状态[20]。每个处理观察不少于15个视野,并记录每个视野下具有游动性的游动孢子数量,计算每个视野下的平均值。
1.2.5数据统计及分析以上试验均重复3次,数据采用SPSS 12.0软件进行统计分析。
2结果与分析
2.1葡萄叶提取物对葡萄生单轴霉菌游动孢子释放的影响
由图1可知,随着处理浓度的增加,3个品种葡萄的新叶和老叶提取物对游动孢子释放的抑制率也显著提高;当浓度为1 mg/mL时,各个品种葡萄的新叶、老叶提取物对游动孢子的释放均无明显抑制作用。巨峰叶片提取物处理浓度为 5 mg/mL 时,对游动孢子释放的抑制率达90%;当浓度提高到10 mg/mL时,对游动孢子释放的抑制率可达95%;当处理浓度为50 mg/mL及以上时可完全抑制游动孢子的释放,且新老叶作用基本相同,与其他处理相比不存在显著差异(图1-a)。红乳叶片提取物对游动孢子释放的抑制能力较弱,新叶、老叶之间无显著差别,当处理浓度为5、10、50 mg/mL时,对游动孢子释放的抑制率均低于巨峰、美人指叶片提取物;当处理浓度达到100 mg/mL时,其抑制率才能达到另两者浓度为50 mg/mL的抑制水平(图1-b、图1-c)。美人指叶片提取物处理浓度为5 mg/mL时,新叶、老叶提取物对游动孢子释放的抑制率分别为75%、58%,存在显著性差异;当处理浓度大于10 mg/mL时,新老叶提取物对游动孢子释放的抑制率均为95%以上,且差异不明显(图1-c)。
2.2葡萄叶提取物对葡萄生单轴霉菌游动孢子萌发的影响
由图2可知,当处理浓度为1 mg/mL时,3个品种葡萄的新叶、老叶提取物均不能明显抑制游动孢子的萌发;当处理浓度为5 mg/mL时,3个品种葡萄的新叶、老叶提取物对游动孢子的萌发抑制率显著提高,只有红乳新叶的抑制率仍较低,为77%,其他葡萄叶提取物抑制率均在90%左右,同品种新老叶提取物之间无显著差异;当处理浓度为10 mg/mL及以上时,3个品种葡萄的新叶和老叶提取物均能明显抑制游动孢子的萌发,且不存在显著差异。
2.3葡萄叶提取物对葡萄生单轴霉菌游动孢子游动性的影响
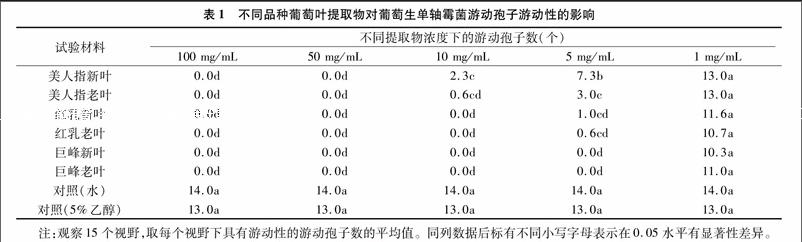
由表1可知,当处理浓度为1 mg/mL时,3个品种葡萄的新叶、老叶提取物均不影响游动孢子的游动性,并且与对照无明显差异,巨峰叶片提取物在处理浓度为5mg/mL及以上时,使游动孢子完全失去游動性,与对照差异显著,并且新叶、老叶的作用相同;红乳叶片提取物在处理浓度为5 mg/mL
时,对游动孢子的游动性产生抑制作用,与巨峰处理无显著差异,但与对照有显著差异;在处理浓度为10 mg/mL及以上时,使游动孢子完全失去游动性,并且新、老叶之间无明显差异;美人指叶片提取物当浓度为5 mg/mL时,对游动孢子的游动性产生抑制作用,并与对照有显著差异,但是显著低于巨峰叶片提取物,新叶的抑制作用也低于老叶,在10 mg/mL浓度下,对游动孢子游动性的抑制作用增强,美人指老叶提取物对游动孢子游动性的影响显著好于新叶提取物,当浓度为 50 mg/mL 及以上时,使游动孢子失去游动性。运动中的游动孢子鞭毛透明,其形态在显微镜下不明显,而失去游动性的游动孢子鞭毛变得清晰可见,并向两侧伸展(图3)。
3结论与讨论
本研究表明,3个葡萄品种新叶和老叶的乙醇提取物对葡萄生单轴霉菌游动孢子的释放、萌发及游动性均有良好的抑制作用。在高浓度下不同葡萄品种、叶龄的葡萄叶提取物对游动孢子均有显著的影响且无明显差异;在低浓度下巨峰叶片提取物的抑制效果最稳定,好于红乳、美人指叶片提取物。相比较而言,抗病品种的葡萄叶提取物的抑制效果要好于感病品种,而同一品种的新叶和老叶之间差异较小。因此可见,在不同抗性品种、不同叶龄葡萄叶中抑菌活性物质的种类没有差别,只是含量有所不同,这与Pezet等的研究结果[20-21]一致。结合葡萄叶提取物对游动孢子3个方面的影响和不同浓度的抑制效果,建议在应用葡萄叶提取物防治葡萄霜霉病时抗病品种提取物采用5 mg/mL以上浓度,感病品种提取物采用 10 mg/mL 以上浓度为宜。
本研究初步探讨了葡萄叶乙醇提取物对葡萄生单轴霉菌游动孢子的抑制作用,但是对于田间防治效果尚须进一步验证。本研究发现,在处理浓度为5 mg/mL时,3个品种葡萄的新叶、老叶提取物都有游动孢子的释放、萌发,但与对照相比其释放的游动孢子大多数为不具游动性的畸形孢子,萌发的游动孢子也存在一定的畸形且芽管短小,其中的作用机制和活性成分尚不明确,今后还须要进一步研究。
植物源农药产品中除有效成分外,还含有其他多种物质。有些物质表现出特殊的生物活性,例如促进植物生长、诱导植物提高抗病性和抗逆性、改善作物的品质等[22]。前人研究发现,葡萄叶有机提取物可以提高葡萄叶片内2种防御酶的活性[10],圆叶葡萄叶乙醇提取物可以增加番茄的高度、鲜质量和根长[15]。关于葡萄叶乙醇提取物是否能诱导葡萄对霜霉病产生抗性以及对葡萄是否具有促生作用也须要做进一步研究。
参考文献:
[1]Wong F P. Burr H N,Wilcox W F. Heterothallism in Plasmopara viticola[J]. Plant Pathology,2001,50(4):427-432.
[2]Agrios G N,Beckerman J. Plant pathology[M]. 6th ed. Burlington:Elsevier Academic Press,2011.
[3]龙世林,胡瑾,房小晶,等. 葡萄霜霉病研究进展[J]. 耕作与栽培,2015(4):65-67.
[4]Kiefer B,Riemann M,Büche C,et al. The host guides morphogenesis and stomatal targeting in the grapevine pathogen Plasmopara viticola[J]. Planta,2002,215(3):387-393.
[5]Islam M,von Tiedemann A. 2,4-Diacetylphloroglucinol suppresses zoosporogenesis and impairs motility of Peronosporomycete zoospores[J]. World Journal of Microbiology & Biotechnology,2011,27(9):2071-2079.
[6]Abdalla M,Win H,Islam M,et al. Khatmiamycin,a motility inhibitor
and zoosporicide against the grapevine downy mildew pathogen Plasmopara viticola from Streptomyces sp. ANK313[J]. The Journal of Antibiotics,2011,64(10):655-659.
[7]何昆,罗宽. 中草药萃取液对植物病原真菌、细菌的抑制作用[J]. 湖南农业科学,2003(1):43-45.
[8]何军,马志卿,张兴. 植物源农药概述[J]. 西北农林科技大学学报(自然科学版),2006,34(9):79-85.
[9]焦文哲. 生防细菌和植物提取物等防治葡萄霜霉病研究[D]. 保定:河北农业大学,2015.
[10]郭秀萍,车永梅,侯丽霞,等. 四种植物提取物对抵御葡萄霜霉病菌的影响[J]. 北方园艺,2012(3):130-133.
[11] Pawlus A D,Waffo- Téguo P,Saver J,et al. Stilbenoid chemistry from wine and the genus “Vitis”:a review[J]. Journal International des Sciences de la Vigne et du Vin,2012,46(2):57-111.
[12]etin E S,Altinoz D,Tarcan E,et al. Chemical composition of grape canes[J]. Industrial Crops and Products,2011,34(1):994-998.
[13]Schnee S,Queiroz E,Voinesco F,et al. Vitis vinifera canes,a new source of antifungal compounds against Plasmopara viticola,Erysiphe necator,and Botrytis cinerea[J]. Journal of Agricultural and Food Chemistry,2013,61(23):5459-5467.
[14]袁茜,周寶利,李之璞. 不同提取条件对葡萄叶提取物抑制两种病原菌活性的影响[J]. 植物保护,2009,35(2):125-127.
[15]李晓琼,唐军,毛润萍,等. 圆叶葡萄叶提取物对南方根结线虫的生物活性[J]. 南方农业学报,2015,46(10):1812-1816.
[16]赵雪艳,张玮,严红,等. 不同葡萄品种对霜霉病的田间苗期抗性评价[J]. 植物保护,2014,40(5):172-175.
[17]李宝燕,王培松,倪寿山,等. 不同葡萄品种对霜霉病的抗性鉴定及相关生理生化研究[J]. 果树学报,2016,33(2):217-223.
[18]杜兴兰,李正楠,姬惜珠,等. 葡萄生轴霜霉菌孢子囊的长期保存[J]. 菌物学报,2008,27(6):908-914.
[19]Riemann M,Büche C,Kassemeyer H,et al. Cytoskeletal responses during early development of the downy mildew of grapevine (Plasmopara viticola)[J]. Protoplasma,2002,219(1/2):13-22.
[20]Pezet R G K,Gindro K,Viret O,et al. Effects of resveratrol,viniferins and pterostilbene on Plasmopara viticola zoospore mobility and disease development[J]. Vitis,2004,43(3):145-148.
[21] Steimetz E,Trouvelot S,Gindro K,et al. Influence of leaf age on induced resistance in grapevine against Plasmopara viticola[J]. Physiological and Molecular Plant Pathology,2012,79(10):89-96.
[22]张兴,马志卿,冯俊涛,等. 植物源农药研究进展[J]. 中国生物防治学报,2015,31(5):685-698.

