脱氢表雄酮对卵巢储备功能下降患者卵巢反应性和IVF-ET结局的影响
龚瑜,周黎明,蔡婕,孙亦婷,赵雅云,夏爱丽
(宁波市妇女儿童医院生殖中心,宁波315012)
脱氢表雄酮对卵巢储备功能下降患者卵巢反应性和IVF-ET结局的影响
龚瑜*,周黎明,蔡婕,孙亦婷,赵雅云,夏爱丽
(宁波市妇女儿童医院生殖中心,宁波315012)
目的 探讨脱氢表雄酮(DHEA)对卵巢储备功能下降(DOR)患者卵巢反应性和IVF-ET结局的影响。 方法 收集2014年10月至2016年8月接受IVF和ICSI治疗DOR患者58例,第一周期采用拮抗剂方案,未服用DHEA(对照组);予服用DHEA至少2个月后,第二周期再次采用拮抗剂(治疗组),周期间隔不超过一年。以外源性促性腺激素用量、天数,周期取消率、FSH、窦卵泡计数(AFC)和卵泡数、获卵母细胞数、获卵率、MII数、正常受精率、优胚数、优质胚胎率、妊娠率为变量,利用配对t检验和卡方检验分析。 结果 对照组和治疗组的Gn总量分别为(36.6±1.9)和(31.4±1.4)支,两组差异有统计学意义(P<0.05)。治疗组比对照组有更高的获卵率(83.7%vs.74.1%,P<0.01)。对照组和治疗组的妊娠例数分别是3例(5.7%)和20例(37.7%),两组具有统计学差异(P<0.01)。 结论 DHEA可改善DOR患者卵巢功能,提高获卵率,改善胚胎质量从而提高IVF妊娠率。另外,DHEA可减少IVF中Gn的用量,为患者降低经济成本。
DHEA; 卵巢储备功能下降; 拮抗剂; 体外受精-胚胎移植
(JReprodMed2017,26(7):675-678)
因卵巢储备功能下降(Diminished ovarian reserve,DOR)而求助于辅助生殖技术(Asistedreproduction technology,ART)的患者在行促排卵时反应不良,获卵少,因此体外受精-胚胎移植(IVF-ET)的妊娠率低。脱氢表雄酮(dehydroepiandrosterone,DHEA)可望改善DOR患者的卵巢反应性和妊娠结局。本文回顾性比较DHEA对同一DOR患者治疗前后的卵巢反应性和妊娠结局,探讨DHEA的作用机制,以提高DOR人群的妊娠率。
资料与方法
一、研究对象及分组
选择2014年10月至2016年8月在本院生殖中心接受IVF和卵胞浆内单精子注射技术(ICSI)治疗的患者58例,年龄29~41岁。纳入标准:窦卵泡计数(AFC)<6个,和/或FSH>10 U/L,双方无染色体异常,无子宫畸形及宫腔内膜疾病。第一周期采用拮抗剂方案,未服用DHEA(对照组);予服用DHEA至少2个月后,第二周期再次采用拮抗剂方案(治疗组),周期间隔不超过一年。其中可纳入数据统计的患者为53例,5例因无可移植胚胎取消周期。
本研究获得医院学术与伦理学委员会许可,入选患者均签署了知情同意书。
二、研究方法
1.观察指标:分析同一患者同一种方案的外源性促性腺激素用量、天数,周期取消率、FSH、AFC和卵泡数、获卵母细胞数、获卵率、MII数、正常受精率、优胚数、优质胚胎率、妊娠率。
2.妊娠判定标准:以胚胎移植后2周,血HCG测定(+),胚胎移植后4周,B超确定胎囊,不包括生化妊娠。
三、统计学分析
结 果
一、两组临床基本情况比较
对照组和治疗组的Gn总量分别为(36.6±1.9)、(31.4±1.4)支,差异有统计学意义(P<0.05),治疗组使用更少的Gn量。两组周期取消率、FSH、AFC和Gn天数均无统计学差异(P>0.05)(表1)。
二、两组促排卵、妊娠情况比较
治疗组比对照组有更高的获卵率(83.7% vs.74.1%),两组差异有统计学意义(P<0.01)。对照组和治疗组的卵泡数、卵母细胞数、MII数、正常受精数、正常受精率、优胚数、优质胚胎率,均无统计学差异(P>0.05)(表1,2)。
三、妊娠结局
对照组和治疗组的妊娠例数分别是3例(5.7%)和20例(37.7%),两组差异具有统计学意义(P<0.01)(表2)。

表1 两组临床基本情况比较[(x-±s),(%)]
注:与对照组比较,*P<0.05
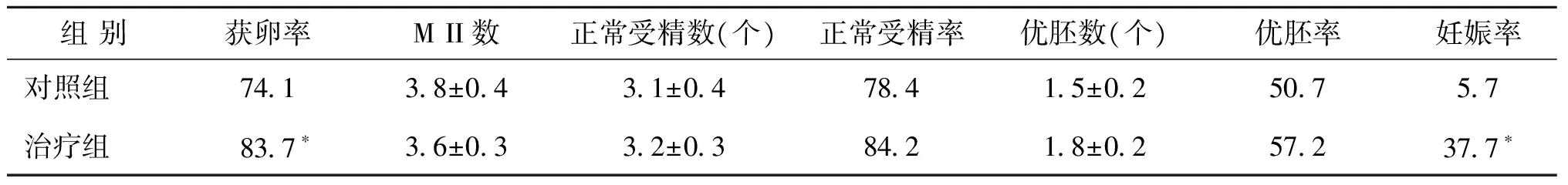
表2 两组促排卵、妊娠情况比较[(x-±s),(%)]
注:与对照组比较,*P<0.05
讨 论
卵巢储备是卵巢产生卵母细胞数量和质量的潜能,其间接反映了卵巢的功能。DOR是指有规律月经的育龄妇女由于各种已知和不明原因引发的卵巢功能障碍,并因此导致的卵巢对刺激的反应性或生育力较同龄人下降。据报道,约有9%~24%的育龄妇女遭遇卵巢储备下降的尴尬,由于全球生育年龄的推迟,这个比例还在不断增加[1]。
一、卵巢储备功能下降的评估方法
卵巢储备功能是影响IVF-ET结局的一个重要因素,DOR患者往往卵巢反应性差,获卵率低、卵母细胞质量差,高流产率和非整倍体率,以及低妊娠率和种植率。目前尚无诊断DOR的统一标准[2],自然周期第2~3 天(即卵泡早期)血清FSH、E2、AFC是最常用的指标。(1)基础FSH水平间接反映了卵巢内储备卵泡的多少,但其受多种激素调节,其波动性影响了其作为评估指标的可靠性,虽然在不同临床研究中得到的FSH与卵巢功能的相关性程度不同,但是均证明了FSH是评估卵巢功能的良好指标。据美国生殖医学协会临床委员会2015年推荐的世界卫生组织(WHO)第二版国际标准,FSH大于10 U/L诊断为DOR具有显著意义[3]。有证据表明,已经检测出FSH异常升高的女性,其在基础FSH处于正常周期进行ART治疗,并不能提高卵巢反应性和妊娠率,因此已经诊断为DOR的患者不需要等待FSH恢复正常后再行ART治疗[3]。(2)基础E2升高提示卵巢储备下降,不能单独作为DOR的诊断标准,与FSH结合提高诊断DOR的灵敏性[3]。在早卵泡期,FSH正常而E2>60~80 pmol/L,卵巢低反应、周期取消率和低妊娠率的发生增加。(3)AFC是指通过阴道超声检测早卵泡期双卵巢平均直径2~10 mm的窦卵泡数目[4]。有META分析表示,AFC为3~6个的患者会伴有卵巢低反应,但无法可靠预测其可否妊娠[5]。另有一些研究表明,低AFC(3~4个)阈值对卵巢低反应的预测特异性有73%~100%,灵敏性9%~73%,因此AFC可以预测IVF患者的卵巢反应性和妊娠结局[6]。有研究表明,AFC<2~6个,同时FSH>10 U/L,无论年轻还是年老女性均卵巢反应低下,临床结局差[7]。但是,AFC的测定与仪器精密性和临床检测医师技术水平密切相关,可能存在一定差异性。因此,临床上通过综合分析血清FSH、E2和AFC,可以很好的预测卵巢储备功能。本研究将AFC<6个,和/或FSH>10 U/L的患者,纳入DOR的诊断。正确辨别DOR的患者,是DHEA改善妊娠结局的前提。
二、DHEA的作用机制
早期,DHEA作为激素替代的一种雄激素而使用,后来逐渐认识到DHEA可以延缓衰老、改善卵巢功能而应用到ART治疗。最近的一次全球调查显示,26%的临床医生对DOR患者进入IVF周期前补充DHEA[8],但是关于DHEA对卵巢反应的作用机制仍是不明确的。关于DHEA的作用机制报道:(1)目前一致认为DHEA能够增加血清中胰岛素样生长因子1(IGF-1)浓度,IGF-1是目前已知的能够提高卵泡和卵母细胞质量的因子[9]。(2)DHEA是一种肾上腺雄激素,可能通过雄激素受体介导作用改善卵泡液环境,增强IGF-I、LH刺激的卵泡雄激素、雌激素的产生,颗粒细胞FSH受体表达增加,从而增加窦前和窦卵泡的数量[10]。(3)也有一些报道DHEA可降低高龄患者流产率,不排除DHEA直接或间接作用于卵母细胞可能,如通过生长激素促进卵母细胞DNA修复,或DHEA直接作用于卵母细胞,增强其线粒体功能[11]。
三、DHEA与妊娠结局的关系
有META分析及一些研究认为,DHEA并不能改善IVF患者的卵巢功能及妊娠结局[1,12-14],这可能与(1)样本量小;(2)实验结果非双盲,患者四处求医,可能同时服用其他药物;(3)DHEA治疗时间是否足够,窦前卵泡发育到促性腺敏感阶段所需要的时间可能是决定DHEA改善卵巢反应的关键因素[15]。该研究认为,虽然DHEA在改善IVF卵巢功能及妊娠结局上无统计学差异,但是有增强卵巢功能和提高妊娠率的趋势。有研究[16]对前次获卵少于4个的患者给予DHEA治疗,40%的患者在下一个周期获得大于4个的卵母细胞,因此,DHEA治疗后可增加获卵数,但正确评估DOR患者是关键。最近的Qin等[17]的META分析则认为,DHEA可改善DOR患者的妊娠结局。国内外的多数研究也支持这一理论[18-20]。本研究认为,DOR患者,在行IVF前予预处理2~6个月,虽不能增加窦卵泡数,但能提高获卵率和妊娠率,提示着DHEA治疗可能与改善卵巢功能,提高卵母细胞质量,从而提高获卵率,进而改善胚胎质量而获得高的妊娠率相关。另外,DHEA治疗后,可以减少Gn用量,减轻患者经济负担。
服用DHEA可产生多毛、痤疮、声音变粗以及女性性欲增强等与雄激素相关的副作用,虽服用DHEA后男性胎儿出生率增高,但未见男胎女性化的表现。长期服用DHEA是否增加与雄激素相关肿瘤的风险还未知。尽管DHEA的机制和安全性未明,仍需要大样本的循证学依据,但目前的研究鼓励DOR患者服用DHEA,以期获得能够生育的机会。
[1] Narkwichean A,Maalouf W,Campbell BK,et al.Efficacy of dehydroepian-drosterone to improve ovarian response in women with diminished ovarian reserve:a meta-analysis[J].Reprod Biol Endocrinol,2013,11:44.doi:10.1186/1477-7827-11-44.
[2] Patrizio P,Vaiarelli A,Levi Setti PE,et al.How to define,diagnose and treat poor responders? Responses from a worldwide survey of IVF clinics[J/OL].Reprod Biomed Online,2015,30:581-592.
[3] Practice Committee of the American Society for Reproductive Medicine.Testing and interpreting measures of ovarian reserve:a committee opinion[J].Fertil Steril,2015,103:e9-e17.
[4] Gizzo S,Andrisani A,Esposito F,et al.Ovarian reserve test:an impartial means to resolve the mismatch between chronological and biological age in the assessment of female reproductive chances[J].Reprod Sci,2014,21:632-639.
[5] Hendriks DJ,Mol BW,Bancsi LF,et al.Antral follicle count in the prediction of poor ovarian response and pregnancy after in vitro fertilization:a meta-analysis and comparison with basal follicle-stimulating hormone level [J].Fertil Steril,2005,83:291-301.
[6] Smeenk JM,Sweep FC,Zielhuis GA,et al.Antimüllerian hormone predicts ovarian responsiveness,but not embryo quality or pregnancy,after in vitro fertilization or intracyoplasmic sperm injection[J].Fertil Steril,2007,87:223-226.
[7] La Marca A,Ferraretti AP,Palermo R,et al.The use of ovarian reserve markers in IVF clinical practice:a national consensus[J].Gynecol Endocrinol,2016,32:1-5.
[8] Patrizio P,Vaiarelli A,Levi Setti PE,et al.How to define,diagnose and treat poor responders? Responses from a worldwide survey of IVF clinics[J/OL].Reprod Biomed Online,2015,30:581-592.
[9] Walters KA,Simanainen U,Handelsman DJ.Molecular insights into androgen actions in male and female reproductive f unction from androgen receptor knock out models[J].Hum Reprod Update,2010,16:543-558.
[10] Nielsen ME,Rasmussen IA,Kristensen SG,et al.In human granulosa cells from small antral follicles,androgen receptor mRNA and androgen levels in follicular fluid correlate with FSH receptor mRNA[J].Mol Hum Reprod,2011,17:63-70.
[11] Ménézo Y,Dale B,Cohen M.DNA damage and repair in human oocytes and embryos:a review[J].Zygote,2010,18:357-365.
[12] Kara M,Aydin T,Aran T,et al.Does dehydroepiandrosterone supplementation really affect IVF-ICSI outcome in women with poor ovarian reserve? [J]Eur J Obstet Gynecol Reprod Biol,2014,173:63-65.
[13] Yeung TW,Chai J,Li RH,et al.A randomized,controlled,pilot trial on the effect of dehydroepiandrosterone on ovarian response markers,ovarian response,and in vitro fertilization outcomes in poor responders[J].Fertil Steril,2014,102:108-115.
[14] Sunkara SK,Pundir J,Khalaf Y.Effect of androgen supplementation or modulation on ovarian stimulation outcome in poor responders:a meta-analysis[J/OL].Reprod Biomed Online,2011,22:545-555.
[15] Gleicher N,Kushnir VA,Weghofer A,et al.The importance of adrenal hypoandrogenism in infertile women with low functional ovarian reserve:a case study of associated adrenal insufficiency[J].Reprod Biol Endocrinol,2016,14:23-29.
[16] Urman B,Yakin K.Does dehydroepiandrosterone have any benefit in fertility treatment? [J]. Curr Opin Obstet Gynecol,2012,24:132-135.
[17] Qin JC,Fan L,Qin AP.The effect of dehydroepiandrosterone (DHEA) supplementation on women with diminished ovarian reserve (DOR) in IVF cycle:Evidence from a meta-analysis [J].J Gynecol Obstet Biol Reprod (Paris),2016,pii:S0368-2315(16)00003-X.
[18] Zangmo R,Singh N,Kumar S,et al.Role of dehydroepiandrosterone in improving oocyte and embryo quality in IVF cycles[J/OL].Reprod Biomed Online,2014,28:743-747.
[19] Bosdou JK,Venetis CA,Kolibianakis EM,et al.Theuse ofandrogensorandrogen-modulatingagentsinpoor responders undergoing in vitro fertilization:a systematic review and meta-analysis[J].Hum Reprod Update,2012,18:127-145.
[20] 赵洪翠,朱亮.脱氢表雄酮(DHEA)在辅助生殖技术中的研究进展[J].生殖与避孕,2012,32:118-123.
[编辑:侯丽]
Efficacy of dehydroepiandrosterone to improve ovarian response and the outcome of IVF-ET in women withdiminished ovarian reserve
GONGYu*,ZHOULi-ming,CAIJie,SUNYi-ting,ZHAOYa-yun,XIAAi-li
IVFcenterofNingboWomenandChildren’sHospital,Ningbo315012
Objective:To investigate the efficacy of dehydroepiandrosterone (DHEA) to improve ovarian response and the outcome of IVF-ET in women with diminished ovarian reserve (DOR).
Methods:The data were obtained from 58 DOR patients with 29 to 41 years old.The patients were and received GnRH-antagonist (GnRH-ant) protocol in the first cycle without DHEA treatment (control cycle);and the patients was given dehydroepiandrosterone at least for 2 months,and then received GnRH-antagonist (GnRH-ant) protocol in the second cycle (treatment cycle).The interval of two cycles was no more than one year.The dose and duration of gonadotropin (Gn) used,cycle cancellation rate,FSH levels,number of AFC and oocyte retrieved,oocyte retrieval rate,number of MII oocytes,normal fertilization rate,number of good embryos,good embryo rate and pregnant rate were compared between the two cycles by paired-samples t-test and Chi-square.
Results:Gn dosage used was significantly lower in treatment cycles than that in the control cycles(31.4±1.4 vs.36.6±1.9 ampoules)(P<0.05).The oocyte retrieval rate (83.7% vs.74.1%)and pregnancy rate (37.7% vs.5.7%)in the treatment cycles were significantly higher than those in the control cycles(P<0.01).
Conclusions:Dehydroepiandrosterone can improve ovarian function in DOR patients and increase oocyte retrieval rate and good-quality embryo rate,as well as IVF pregnancy rate.In addition,DHEA can decrease the Gn dosage used,therefore reduce the cost for patients.
DHEA; Diminished ovarian reserve (DOR); GnRH-antagonist; IVF-ET
10.3969/j.issn.1004-3845.2017.07.011
2016-12-08;
2017-01-18
宁波市自然基金项目(2015A610199)
龚瑜,女,浙江象山人,硕士,生殖医学专业.(*
)

