鼎湖山不同植被类型下土壤肉足虫群落结构的比较研究①
王 超,李亚芳,徐润林*
鼎湖山不同植被类型下土壤肉足虫群落结构的比较研究①
王 超1,李亚芳2,徐润林1*
(1 中山大学生命科学学院,广州 510275;2 中国水产科学院南海水产研究所,广州 510300)
为了解不同植被类型下土壤原生动物群落的特征,采用定性和定量培养法,对采自鼎湖山国家级自然保护区内沟谷常绿阔叶林(A点)、河岸常绿阔叶林(B点)、温带季风常绿阔叶林(C点)、针阔叶混交林(D点)、针叶林-马尾松林(E点)、山地常绿阔叶林(F点)和山顶灌草丛(G点)7种植被下土壤样品中肉足虫的群落组成和数量进行了观察和统计;并借助“普遍分布模型(ubiquity model)”和“生物地理模型(biogeography model)”理论,探讨了土壤原生动物在较小范围内的分布模式。结果显示:在所有土壤样品中,共检出20属31种土壤肉足虫,其中和属出现的物种数最多(各有3种);在全部肉足虫种类中,有8种出现在4个土壤样点中,它们分别是sp.、、、、sp.、、和。对比分析显示:不同植被下的土壤肉足虫群落组成呈一定差异,F点土壤中肉足虫最多(15种),G点土壤中最少(9种);不同植被类型下土壤肉足虫群落的丰度差别很大,最高出现在F点中(29 200 ind./g),最低出现在G点中(3 510 ind./g)。群落相似性比较显示:各样点的土壤肉足虫群落处于中等不相似(0.25 ~ 0.5)到中等相似(0.5 ~ 0.75)的水平。聚类分析表明,A点与F点的土壤肉足虫群落相似性最高;B点与G点的土壤肉足虫群落相似性也较高;D点与其他5个样点的相似性相对较低。单因子相关性分析显示土壤含水量与肉足虫丰度间有极显著的相关性(<0.01),而土壤中NO– 3-N与肉足虫丰度间有显著的相关性(<0.05);多元相关分析表明,鼎湖山土壤肉足虫丰度变化与多个土壤理化因子组合间存在相关性,以(pH + 含水量)组合与土壤肉足虫丰度的相关性最大。CCA分析显示不同的土壤理化因子对肉足虫某具体种的作用存有差异。因此,鼎湖山自然保护区土壤肉足虫的分布更符合“生物地理模型”。
土壤肉足虫;群落结构;动物地理模式;鼎湖山自然保护区
土壤动物是土壤生态系统的重要组成部分,在系统中它们既是消费者也是分解者。在土壤动物众多成员中,土壤原生动物在数量上占绝对优势[1]。土壤原生动物因个体微小且结构复杂,其群落结构及种群丰度可因环境的微小变化而迅速改变[2]。大量的文献表明,原生动物对生存环境的变化敏感,在一定范围内被认为是指示生物,可用于环境评价和监测[3]。虽然与浮游类群相比,人们对土壤原生动物的研究起步较晚,对其规律性的认识也较少,但国内外对土壤原生动物生态学仍有一些报道,如人们发现大气中CO2浓度上升可间接地导致土壤原生动物数量的上升[4];土壤原生动物的丰度与土壤有机质、全氮和全磷含量均呈正相关[5-6]。在群落生态学方面,人们对土壤原生动物也陆续给予了一定的关注[7-13],例如针对典型地带土壤原生动物区系的描述在大尺度上揭示了土壤原生动物在不同纬度间的差异,对大鹏半岛和广州白云山土壤原生动物群落的研究进一步给出了华南地区土壤原生动物的分布特征[7-10]。另外,国内外学者还先后针对我国西南高原、东北长白山地区、南极地区、北欧农田以及针叶雨林等不同生境土壤原生动物群落进行了调查,并分别阐述了土壤原生动物与土壤环境因子以及土壤系统中其他生物类群(微生物和线虫)间的关系[10-14]。
有关原生动物的生物地理分布格局,国际上存在着两种截然对立的观点。①以Finlay为代表的观点认为,人们已基本了解了大多数自由生活的原生动物种类;在多数情况下自由生活原生动物是以包囊形式存在的;由于包囊扩散非常容易,因此它们是全球性分布的;自由生活原生动物的区域物种多样性与全球物种多样性呈很高的比值,故它们在各地的分布并没有明显的差异。这一观点被称为自由生活原生动物的“普遍分布模型(ubiquity model)”理论[15-16]。②以Foissner为代表的“生物地理模型(biogeography model)”理论则认为,大多数自由生活原生动物的分布受区系地理的限制;由于技术手段上的局限性,原生动物的鉴定存在很多困难;鉴定时很多少见种被数量较大的常见种所掩盖,因而人们得到的结果被严重误导[17-18]。为了验证这两种理论的准确性,国内外学者分别在各种生境类型中开展了研究[19-25]。
鼎湖山国家级自然保护区是我国第一个自然保护区。主要保护对象为南亚热带地带性森林植被类型―― 季风常绿阔叶林及其丰富的生物多样性。保护区内生物多样性丰富,生长着约占华南地区植物种类1/4的高等植物,其中,桫椤、紫荆木、土沉香等国家保护植物达22种,鼎湖冬青、鼎湖钓樟等华南特有种和模式产地种多达30种,药用植物更是多达1 000种以上[26],动物1 000余种,是华南地区生物多样性最富集的地区之一,被生物学家称为“物种宝库”和“基因储存库”[27]。鼎湖山国家级自然保护区的森林生态系统具有显著的区域代表性和重要的科研价值,长期以来吸引着众多研究人员的目光,研究的内容涵盖森林群落的组成、结构、功能、演替动力学及其演替模型的构建,群落与土壤理化等指标的关系,土壤营养状况等众多方面[28-31],也有关于包括当地土壤动物在内的生物调查[32-35]。但是目前尚未见到有关鼎湖山森林生态系统中土壤原生动物方面的报道。
本研究在该保护区内选择了数种植被类型土壤,通过对不同土壤样品中肉足虫群落结构的研究,探讨在一个较小空间范围内,土壤原生动物群落与植被种类间的关系,并利用有关结果来阐述土壤原生动物在较小范围内的分布模式。
1 材料与方法
1.1 研究区概况
鼎湖山国家级自然保护区位于广东省肇庆市鼎湖区(23°10′N,112°31′E),总面积约1 133 hm2。该地区属南亚热带季风湿润型气候,夏长冬短,热量丰富,雨量充沛,阳光充足[36];主要植被有自然植被、半自然植被、人工植被3大类型,包括常绿阔叶林、针阔叶混交林、热性常绿针叶(马尾松)林、山地常绿灌丛、山地常绿草丛和人工植被类型,以针阔叶混交林为主[28]。
1.2 样地设置
本研究的目的除了对鼎湖山土壤肉足虫群落进行调查外,还拟探讨土壤原生动物的分布模式,故在设置采样点时,使各采样点间的距离尽可能短以控制研究所涉及的面积尽可能小,以消除由于采样点的距离而导致的群落结构差异。参照前人对鼎湖山自然保护区植被的调查结果[28,37],分别在7种不同的森林群落类型中设置了采样点,分别是:沟谷常绿阔叶林(A点)、河岸常绿阔叶林(B点)、温带季风常绿阔叶林(C点)、针阔叶混交林(D点)、针叶林–马尾松林(E点)、山地常绿阔叶林(F点)和山顶灌草丛(G点)。其中E点是人工植被,D点是由种植的马尾松林不断演替形成的半人工植被,其他各样地是自然植被。
1.3 土壤样品的采集和前期处理
土壤样品一次性采集于2014年8月。参照有关文献报道[38],采样时,在每一植被类型样点(面积1 m × 1 m)的四角和中央等量采集表层(0 ~ 5 cm)土壤,剔除较大的凋落物,混匀后做好标签,带回实验室。将每个土壤样品分成2份,1份用于测试土壤样品理化指标,1份风干处理。
1.4 土壤样品的理化指标测试
本研究测定的土壤理化指标包括土壤含水量、总有机碳、全氮、全磷、全钾、硫酸盐(SO2– 4)、NH4+-N、NO– 3-N含量及土壤pH和电导率(TDS)。各指标的测定方法均参照国家相关标准[39]进行。
1.5 土壤肉足虫分类鉴定
采用“非淹没培养法”[40]对各土壤样品进行培养,在培养的第2、7、14、21和30天取土壤培养液在Nikon E-800显微镜下观察,依据相关文献的描述对观察到的肉足虫进行种类鉴定[2-3, 41-42]。
取已风干好的样品,采用“3级10倍”法[43-44]对土壤肉足虫丰度进行分析。根据预实验,本研究中采用了103、104和105三级稀释倍数。
按照各种肉足虫在不同采样点出现的频率,将肉足虫划分为广布种、常见种、特有种3大类[38]。在本研究中,某种肉足虫在多于或等于5个样点中出现,则该肉足虫为广布种;出现在2到4个样点的肉足虫,则为常见种;如某种肉足虫仅在1个样点中出现,则该肉足虫为特有种。
1.6 数据处理
群落的多样性指数选择Margalef物种丰富度指数,即=(-1)/ln,其中,为群落总种数,为群落的丰度[3,7]。
本研究涉及的数据处理、群落相似性分析(ANOSIM)和等级聚类分析(CLUSTER)分别利用Microsoft Excel 2000软件、SPSS11.5统计软件和PRIMER 5.0软件进行。为分析不同土壤理化因子对土壤肉足虫丰度的作用,本研究中还参照文献[45]对有关数据进行了典型相关分析(canonical correspondence analysis,CCA)。
2 结果
2.1 鼎湖山自然保护区不同植被类型下土壤的理化性质
本研究所采土壤样品的理化指标列于表1。各样点土壤的pH均低于4,呈现出明显的酸性土壤特征。除pH外,各样点其余受检因子间存在着明显的差异,最低值与最高值间相差1倍以上,反映了鼎湖山自然保护区内土壤的异质性明显。
2.2 鼎湖山自然保护区不同植被类型下土壤肉足虫的群落特征
2.2.1 不同植被类型下土壤肉足虫的种类组成 本研究共发现土壤肉足虫20属31种(表2)。其中和属出现的物种数最多(各3种)。不同植被类型下土壤中肉足虫的组成呈一定差异,最多种类(15种)出现在山地常绿阔叶林(F点),最少种类(9种)出现在山顶灌草丛(G点)。在全部31种土壤肉足虫中,有8种在至少一半以上的样点中出现,分别是sp.、、、、sp.、、和。依据种类出现的频率,界定出广布种有8种,占物种总数的25.8%;常见种12种,占物种总数的38.7%;特有种11种,占物种总数的35.2%。由此可见,在鼎湖山自然保护区土壤肉足虫中,广布种较少,而常见种和特有种较多。
2.2.2 不同植被类型下土壤肉足虫的丰度 由表3可见,不同植被类型下土壤肉足虫的丰度差别很大,其中最高的是山地常绿阔叶林(F点)(29 200 ind./g),其次是温带季风常绿阔叶林(C点)(22 700 ind./g)。土壤肉足虫的丰度最低值出现在山顶灌草丛(G点)(3 510 ind./g),然后是针叶林(E点)(4 560 ind./g)。鼎湖山自然保护区不同植被类型土壤中,山地常绿阔叶林(F点)土壤肉足虫群落的多样性指数()最高(5.170),而山顶灌草丛(G点)的多样性指数最低(3.641)。
2.2.3 不同植被类型下土壤肉足虫群落的相似性 各个样点间土壤肉足虫群落的相似性分析见表4。各样点土壤肉足虫的相似性系数位于0.261(B点与D点之间)到0.640(A点与F点之间),这表明各个样点的土壤肉足虫群落处于中等不相似(0.25 ~ 0.5)到中等相似(0.5 ~ 0.75)的水平。
对各个样点间的土壤肉足虫的群落相似性的等级聚类分析(CLUSTER)结果见图1,沟谷常绿阔叶林(A点)与山地常绿阔叶林(F点)的土壤肉足虫群落相似性最高;河岸常绿阔叶林(B点)与山顶灌草丛(G点)的土壤肉足虫群落相似性也较高;针阔叶混交林(D点)与其他5个样点相似性相对较低。
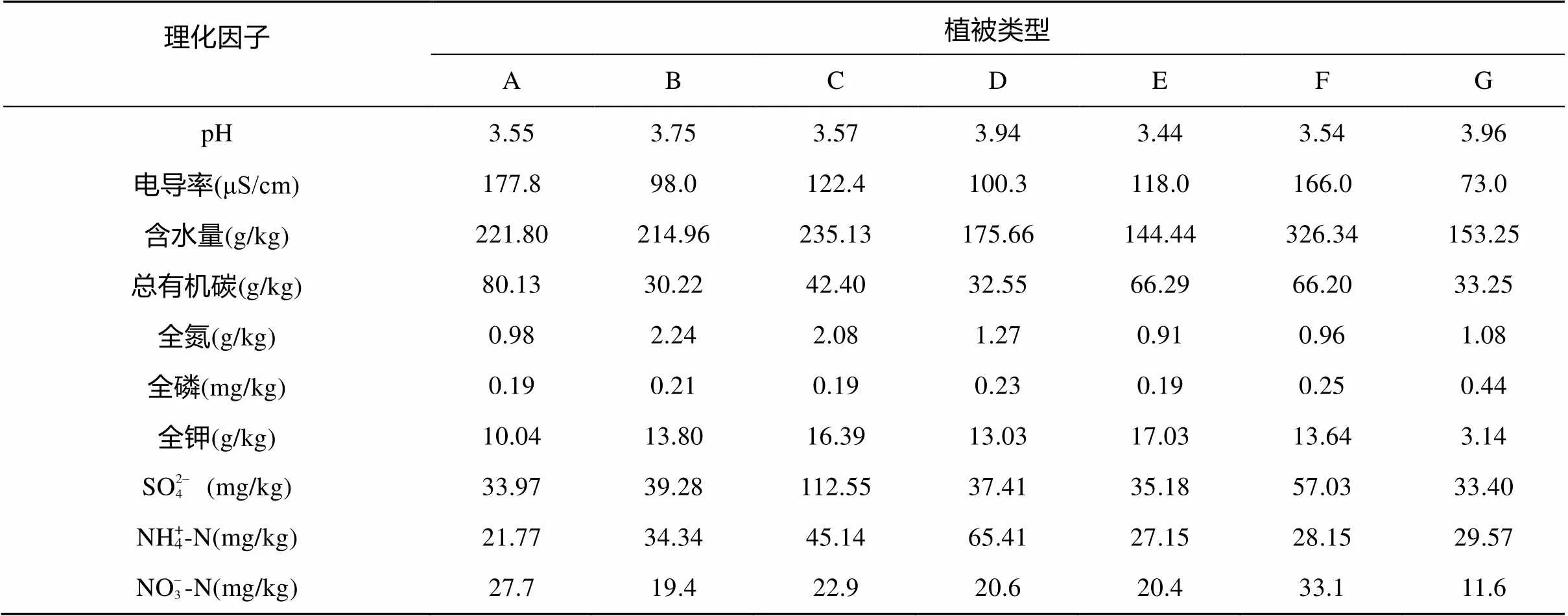
表1 鼎湖山自然保护区不同植被类型下土壤的理化性质
注:表中采样点A表示沟谷常绿阔叶林;B表示河岸常绿阔叶林;C表示温带季风常绿阔叶林;D表示针阔叶混交林;E表示针叶林-马尾松林;F表示山地常绿阔叶林;G表示山顶灌草丛。
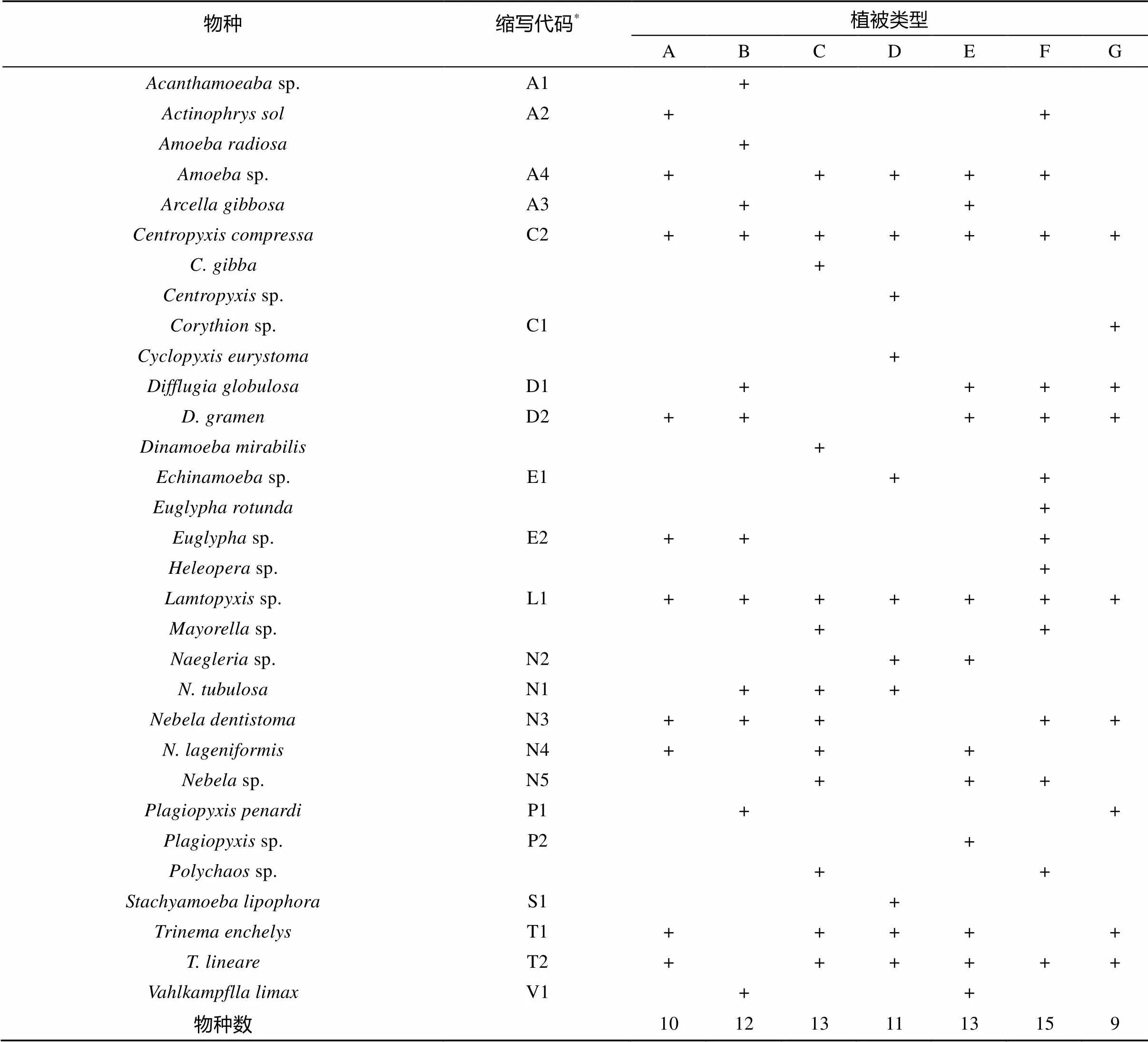
表2 鼎湖山自然保护区不同植被类型下土壤中的肉足虫种类
注:* 为显示在图2中的标识代码。
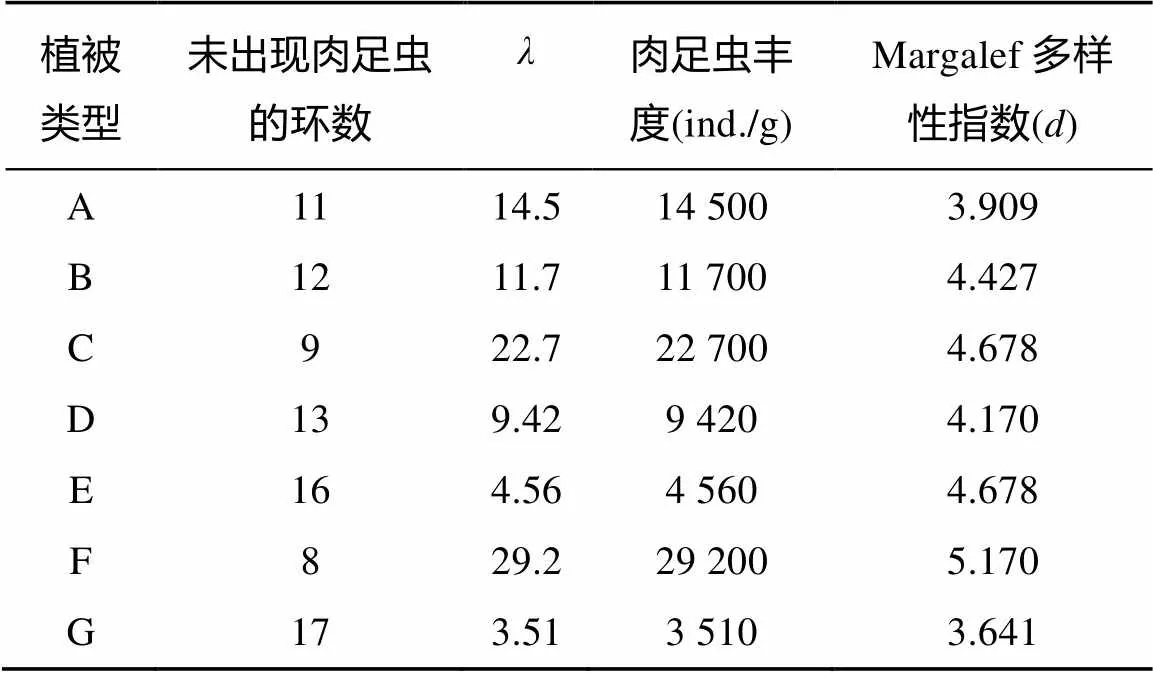
表3 鼎湖山自然保护区不同植被类型下土壤肉足虫的丰度和多样性指数
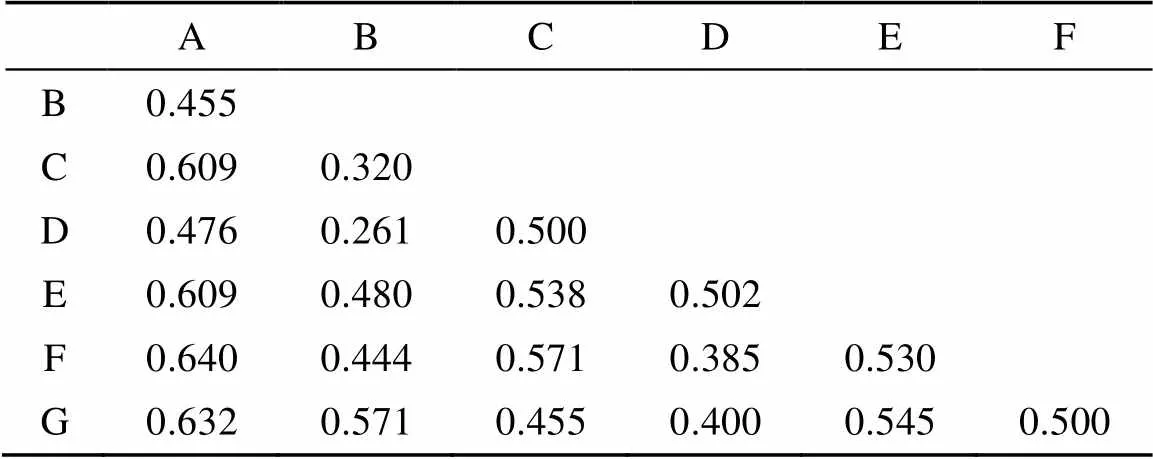
表4 鼎湖山自然保护区不同植被类型下土壤肉足虫群落的相似性分析(ANOSIM)
2.3 鼎湖山自然保护区不同植被类型下土壤肉足虫丰度与理化因子的相关性
双变量相关分析显示:在诸多土壤理化因子间,土壤含水量与肉足虫丰度间存在极显著的相关性(<0.01);而土壤NO– 3-N含量与肉足虫丰度有显著的相关性(<0.05)(表5)。
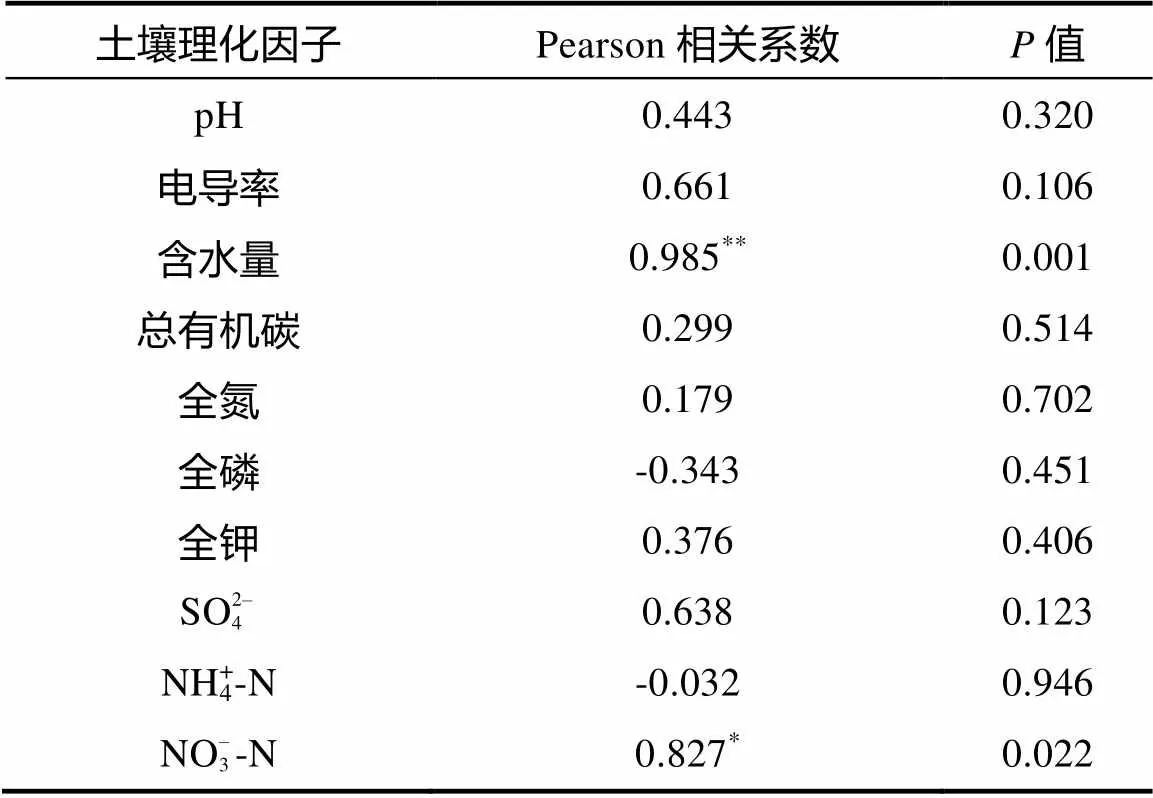
表5 鼎湖山自然保护区土壤肉足虫丰度与各理化因子的相关性
注:** 表示在<0.01水平显著相关,* 表示在<0.05水平显著相关,双尾检验。
多元相关分析表明:鼎湖山自然保护区土壤肉足虫丰度变化与多个土壤理化因子共同作用间存在相关性。以(土壤pH + 含水量)组合对土壤肉足虫丰度的相关性最大(表6)。
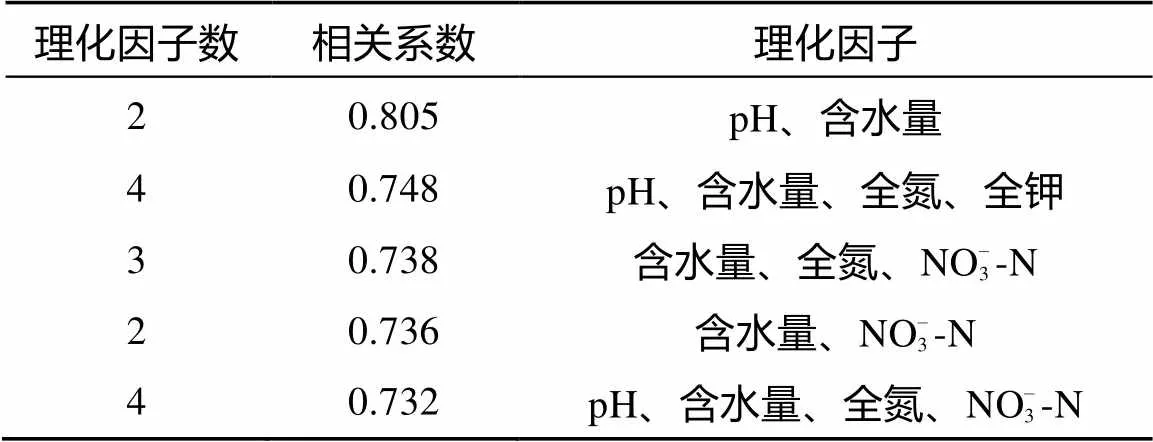
表6 鼎湖山自然保护区土壤肉足虫丰度与土壤理化因子的多元相关分析
通过对各土壤理化因子与各肉足虫种类丰度间典型相关分析(CCA),可发现不同的土壤理化因子对某个具体的肉足虫种类作用是有差异的(图2)。土壤中NH4+-N含量对sp.和sp.分布的影响较大;sp.、spp.的分布受土壤中高含量的含水量、电导率、SO2– 4、NO– 3-N以及低酸碱度(pH)的影响,而spp.、spp.等则受高酸碱度(pH)以及低含水量、电导率、SO2– 4和NO– 3-N含量的影响。出现在排序轴中间的物种则相对受环境因子的影响比较小。
3 讨论
在土壤生态系统中,因为个体较小,原生动物被看作是微型土壤动物;由于运动能力弱,原生动物对土壤的物理结构改变影响较小,但因其数量大、世代时间短、其颗粒性有机物和细菌为主的食性特点,使得原生动物成为了土壤食物网中重要的节点[46]。因此,国内外对土壤原生动物的研究均呈明显上升的趋势[7-8, 10-11, 14, 23, 38, 44, 46-51]。但由于种种原因,专门针对土壤肉足虫群落的研究则相对较少[12, 24-25, 52-54]。
对比国内外不同地区和生境类型,可以发现鼎湖山自然保护区内不同植被下土壤肉足虫群落在种类组成上常见种占多数,其群落的丰度(3.51×103~ 29.2×103ind./g)与广州白云山土壤肉足虫丰度(1.73× 103~ 1.20×105ind./g)[24]相当,但明显低于海南东寨港红树林土壤肉足虫的丰度(94.2×103~ 1204×103ind./g)[23]。究其原因,应该是红树林生境土壤所含营养物量远高于山林土壤,富营养的状况为土壤细菌的大量滋生提供了条件,转而为肉足虫提供了丰富的食物。
将本研究结果与文献结果比较后可发现:鼎湖山自然保护内土壤肉足虫群落组成与广州白云山[24]、海南东寨港红树林[23]、吉林长白山[12]以及厄瓜多尔热带雨林土壤[19]间均存在较大差异,即使在本研究所涉及的7种生境类型间,土壤肉足虫的组成也具明显的不相似性。从这一点讲,土壤肉足虫的分布模式更符合Foissner的“生物地理分布模型”理论。虽然本研究样品均取自海拔高度变化不显著的区域,但依然显现出不同植被类型下土壤肉足虫群落组成的差异,这与针对长白山土壤肉足虫群落研究的结果相似[12]。类似的结果还来自于对更小尺度内土壤样品肉足虫群落的研究:2个相距5 ~ 10 mm土壤样点间的裸肉足虫群落的多样性存在着显著差异[55]。土壤中高度异质的空间结构、化学组成复杂多样的基质为不同大小、物理活动、行为和特征的生物群体提供了各种各样的栖息场所[56],而由于个体细小,原生动物对生境的空间要求势必非常小,所以土壤的异质性为原生动物提供了较其他多细胞动物更多类型的栖息地。因而本研究结果符合Bischoff提出的土壤肉足虫丰度和多样性的分布具有斑块型的特点[57]。
从土壤理化因子的作用考虑,本研究中大多数已测因子对肉足虫丰度的影响不很明显,但多元相关分析又表明了环境理化因子组合对肉足虫丰度的影响还是很明显的。这一结果与其他作者的报道相近,如在长白山,裸肉足虫群落组成和结构主要受土壤pH、NH4+-N以及碳氮比的影响,而海拔和土壤含水量对其没有显著影响[12]。在广州白云山和海南东寨港红树林,土壤肉足虫的丰度均也受到多个土壤理化因子组合的影响[23-24]。非常有意思的是在多个对土壤肉足虫丰度变化作用较大的土壤理化因子组合中,有3个是包含了土壤酸碱度(pH)的(表5),这一结果与宁应之和沈韫芬[38]以及Wall等[58]的观点相吻合,他们均认为小型土壤生物群落分布在很大程度上与土壤pH密切相关。长期以来,研究者一直试图采用指示生物或生物耐污指数等相对简单、直观的手段来监测和评价环境状况,并已做了一些尝试[3,59-61]。遗憾的是,他们常发现在某个环境中被作为指示生物的种类,在另一个环境中则可能不存在。从本研究针对土壤肉足虫群落与土壤理化因子关系的分析结果和国内外其他学者针对土壤原生动物群落与土壤理化因子关系的分析结果均可以看出,简单地使用指示生物作为环境监测和评价的手段明显缺乏准确性。同样,也正是由于土壤系统的复杂性和高度异质性,有关土壤原生动物群落的规律性尚需要开展更多的研究方能得出更全面的信息。
4 结论
鼎湖山自然保护区7种不同植被类型下土壤肉足虫的群落特征表现为在组成上有一定差异,丰度差别很大;不同植被类型下土壤肉足虫群落处于中等不相似到中等相似的水平,沟谷常绿阔叶林与山地常绿阔叶林的土壤肉足虫群落相似性最高,河岸常绿阔叶林与山顶灌草丛的土壤肉足虫群落相似性较高;针阔叶混交林与其他5个样点相似性较低;土壤中含水量和NO– 3-N与肉足虫的丰度具相关性,肉足虫丰度变化与多个土壤理化因子共同作用间具相关性,以(土壤pH + 含水量)组合对土壤肉足虫丰度的相关性最大;不同的土壤理化因子对某个具体的肉足虫种类作用具差异性;土壤肉足虫的组成的明显不相似性表明土壤肉足虫的分布模式更符合Foissner的“生物地理分布模型”理论。
[1] 尹文英. 中国土壤动物[M]. 北京: 科学出版社, 2000
[2] 沈韫芬. 原生动物学[M]. 北京: 科学出版社, 1999
[3] 沈韫芬, 章宗涉, 龚循矩. 微型生物监测新技术[M]. 北京: 中国建筑工业出版社, 1990
[4] Rønn R, Gavito M, Larsen J, et al. Response of free-living soil protozoa and microorganisms to elevated atmospheric CO2and presence of mycorrhiza[J]. Soil Biology and Biochemistry, 2002, 349(7): 923–932
[5] Forge T A, Hogue E, Neilsen G. Effects of organic mulches on soil microfauna in the root zone of apple: Implications for nutrient fluxes and functional diversity of the soil food web[J]. Applied Soil Ecology, 2003, 22(1): 39–54
[6] Verhoeven R. Response of soil microfauna to organic fertilization in sandy virgin soils of coastal dunes[J]. Biology and Fertility of Soils, 2001, 34(6): 390–396
[7] 宁应之, 沈韫芬. 中国典型地带土壤原生动物区系特征和物种分布[J]. 动物学报, 1998, 44(1): 5–11
[8] 徐润林, 孙逸湘. 大鹏半岛土壤纤毛虫的群落特点[J]. 应用生态学报, 2000, 11(3): 428–430
[9] Li J, Li M G, Yang J, Ai Y, Xu R L. Community characteristics of soil ciliates at Baiyun Mountain, Guangzhou, China[J]. Zoological Studies, 2010, 49(6): 713–723
[10] 李玲娟, 熊勤犁, 潘开文, 等. 土壤原生动物对川滇高山栎恢复时间的响应及生长季动态[J]. 生物多样性, 2015, 23(6): 793–801
[11] 冯伟松, 余育和. 南极菲尔德斯半岛地区土壤原生动物生态学研究[J]. 水生生物学报, 2000, 24(6): 611–615
[12] 刘芳, 李琪, 申聪聪, 等. 长白山不同海拔梯度裸肉足虫群落分布特征[J]. 生物多样性 2014, 22(5): 608–617
[13] Rønn R, Vestergard M, Ekelund F. Interactions between bacteria, protozoa and nematodes in soil[J]. Acta Protozoologica, 2012, 51(3): 223–235
[14] Bamforth S S. Distribution of and insights from soil protozoa of the Olympic coniferous rain forest[J]. Pedobiologia, 2010, 53(6): 361–367
[15] Finlay B J, Esteban G F, Clarke J K. Biodiversity of terrestrial protozoa appears homogeneous across local and glocal sptial scales[J]. Protist, 2001, 152(4): 355–366
[16] Finlay B J. Global dispersal of free-living microbial eukaryote species[J]. Science, 2002, 296(5570): 1061–1063
[17] Foissner W. Ubiquity and cosmopolitanism of protists questioned[J]. SIL News, 2004, 43: 6–7
[18] Foissner W. Biogeography and dispersal of micro- organisms: A review emphasizing protests[J]. Acta Protozool, 2006, 45(2): 111–136
[19] Krashevska V, Bonkowski M, Maraun M, et al. Testate amoebae (Protista) of an elevational gradient in the tropical mountain rain forest of Ecuador[J]. Pedobiologia, 2007, 51(4): 319–331
[20] Mazei Y. Biodiversity patterns in protozoan communities: Linking processes and scales[J]. Protistology, 2008, 5(4): 268–280
[21] Kim Y O, Chae J H, Hong J S, et al. Comparing the distribution of ciliate plankton in inner and outer areas of a harbor divided by an artificial breakwater[J]. Marine Environmental Research, 2007, 64(1): 38–53
[22] 鞠丽华, 杨军, 刘乐冕, 等. 有壳虫原生动物沿湖泊纬度和营养状态梯度的分布格局[C]//全球变化下的海洋与湖沼生态安全”学术交流会论文集.南京, 2014
[23] Liao Q Y, Li J, Zhang J H, et al. An ecological analysis of soil Sarcodina at Dongzhaigang mangrove in Hainan Island, China[J]. European Journal of Soil Biology, 2009, 45(3): 214–219
[24] Li J, Li M G, Yang J, et al. The community structure of soil Sarcodina in Baiyun Mountain, Guangzhou, China[J]. European Journal of Soil Biology, 2010, 46(1): 1–5
[25] 郑金秀, 池仕运, 李聃, 等. 石臼湖原生动物种群分布及其同质化[J]. 生态学杂志, 2015, 34(4): 1052–1059
[26] 张宏伟, 马骥. 鼎湖山药用植物资源调查分析[J]. 广西植物, 2005, 25(6): 539–543
[27] 莫萍. 北回归线上的绿宝石——鼎湖山[J]. 南方国土资源, 2009(2): 37–39
[28] 曹洪麟, 黄忠良, 张林艳, 等. 鼎湖山自然保护区植被类型[J]. 热带亚热带森林生态系统研究,2002, 9: 1–9
[29] 黄文娟, 刘菊秀唐旭利, 等. 鼎湖山5种森林土壤的无机氮和有效磷含量[J]. 应用与环境生物学报, 2009, 15(4): 441–447
[30] 何宜庚. 广东省鼎湖山自然保护区的土壤[J]. 华南师范大学学报(自然科学版), 1983, 1983(1): 87–96
[31] 李耀泉. 鼎湖山常见昆虫调查初报[J]. 热带亚热带森林生态系统研究, 1984(2): 69–81
[32] 廖崇惠. 鼎湖山森林土壤动物研究 I:区系组成及其特征[J]. 热带亚热带森林生态系统研究, 1989(5): 83–96
[33] 林英华, 张夫道, 张俊清, 等. 鼎湖山不同自然植被土壤动物群落结构时空变化[J]. 生态学报, 2005, 25(10): 2616–2622
[34] 陈茂乾, 廖崇惠. 鼎湖山森林土壤动物研究 II:不同生境的群落组成[J]. 热带亚热带森林生态系统研究, 1990, (7): 90–99
[35] 徐国良, 黄忠良, 欧阳学军, 等. 广东鼎湖山自然保护区动物物种多样性[J]. 四川动物, 2002, 21(2): 72–75
[36] 肖光明. 鼎湖山旅游地生命周期的分析与调控[J]. 热带地理, 2003, 23(2): 180–184
[37] 王铸豪, 何道泉, 宋绍敦. 鼎湖山自然保护区之植被[J]. 热带亚热带森林生态系统研究, 1982, (1): 77–141
[38] 宁应之, 沈韫芬. 珞珈山森林土壤原生动物生态学研究及土壤原生动物定量方法探讨[J]. 动物学研究, 1996, 17(3): 225–232
[39] 国家环境保护部. 土壤环境质量标准(GB 15618-1995)[S]. 北京: 中国标准出版社, 1995
[40] Foissner W. Estimating the species richness of soil protozoa using the “flooded petridish method”[C]//Lee J J, Soldo A T. Protocols in Protozoology. Lawrence: Allen Press, 1992: 1–2
[41] Adl S M, Simpson A G B, Farmer M A, et al. The new higher level classification of eukaryotes with emphasis on the taxonomy of protests[J]. Journal of Eukaryotic Microbiology, 2005, 52(5): 399–451
[42] Lee J J, Leedale G F, Bradbury P. An Illustrated Guide to the Protozoa, Vol. II[M]. Lawrence, Kansas: Society of Protozoologists, 2000
[43] Darbyshire J F, Wheatley R E, Greaves M P, et al. A rapid micromethod for estimating bacterial and protozoan populations in soil[J]. Rev. Ecol. Biol. Soil, 1974, 11(5): 465–475
[44] Ekelund F, Rønn R. Notes on protozoa in agricultural soil with emphasis on heterotrophic flagellates and naked amoebae and their ecology[J]. FEMS Microbiol Rev., 1994, 15(4): 321–353
[45] 谭香, 夏小玲, 程晓莉, 等. 丹江口水库浮游植物群落时空动态及其多样性指数[J]. 环境科学, 2011, 32(10): 2875–2882
[46] Jentschke G, Bonkowski M, Godbold D L. Soil protozoa and plant growth: Non-nutritional effects and interaction with mycorrhizas[J]. Biology and Fertility of Soils, 1995, 20(4): 263–269
[47] Domonell A, Brabender M, Nitsche F, et al. Community structure of cultivable protists in different grassland and forest soils of Thuringia[J]. Pedobiologia, 2013, 56(1): 1–7
[48] 孙明德, 吴姬, 曹均, 等. 北京主要板栗园土壤微生物量及原生动物特征[J]. 中国农学通报, 2011, 27(25): 182– 187
[49] 刘智峰. 茶园原生动物群落结构与土壤质量评价[J]. 安徽农业科学, 2011, 39(12): 7014–7015
[50] 贾朋, 李嘉琳, 张丹彤, 等. 广州长岗山土壤原生动物群落结构及季节变化[J]. 广东林业科技, 2013, 29(2): 1–6
[51] 艾山·阿布都热依木, 夏扎丹木, 王志勇. 塔里木河中游胡杨林土壤原生动物群落的生态学研究[J]. 新疆师范大学学报(自然科学版), 2011, 30(1): 1–3
[52] Wanner M, Elmer M, Kazda M, et al. Community assembly of terrestrial testate amoebae: How is the very first beginning characterized?[J]. Microbial Ecology, 2008, 56(1): 43–54
[53] Zaragoza S R, Steinberger Y. Seasonal dynamics of amoebae in the root canopy ofin the Negev Desert, Israel[J]. Pedobiologia, 2004, 48(3): 277–281
[54] Krashevska V, Bonkowski M, Maraun M, et al. Testate amoebae (protista) of an elevational gradient in the tropical mountain rain forest of Ecuador[J]. Pedobiologia, 2007, 51(4): 319–331
[55] Anderson O R. Laboratory and field-based studies of abundances, small-scale patchiness, and diversity of gymnamoebae in soils of varying porosity and organic content: Evidence of microbiocoenoses[J]. Journal of Eukaryotic Microbiology, 2002, 49(1): 17–23
[56] Ferris H, Tuomisto H. Unearthing the role of biological diversity in soil health[J]. Soil Biology and Biochemistry,2015, 85(1): 101–109
[57] Bischoff P J. An analysis of the abundance, diversity and patchiness of terrestrial gymnamoebae in relation to soil depth and precipitation events following a drought in southeastern USA[J]. Acta Protozoologica, 2002, 41(1): 83–189
[58] Wall D H, Bardgett R D, Kelly E F. Biodiversity in the dark[J]. Nature Geoscience, 2010, 3(5): 297–298
[59] 王振中, 张友梅, 邢协加. 土壤环境变化对土壤动物群落影响的研究[J]. 土壤学报, 2002, 39(6): 892–897
[60] 唐玉姝, 魏朝富, 颜廷梅, 等. 土壤质量生物学指标研究进展[J]. 土壤, 2007, 39(2) : 157–163
[61] 王慧, 桂娟, 刘满强, 等. 稻草和三叶草分解对微型土壤动物群落的影响[J]. 土壤学报, 2015, 52(5): 1124–1134
Comparative Study on Community Structure of Sarcodina in Soils Under Different Vegetations in the Dinghu Mountain
WANG Chao1, LI Yafang2, XU Runlin1*
(1 School of Life Sciences, Sun Yat-Sen University, Guangzhou 510275, China; 2 South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, China)
In order to understand the characteristics of soil protozoa communities under different vegetations, soil samples were collected from 7 different vegetations in Dinghu Mountain, the community composition and abundance of soil Sarcondina were studied with the methods of qualitative and quantitative cultivation and the distribution pattern of soil Sarcondina in the small range was investigated based on the ubiquity model and biogeography model. In total 20 genera and 31 species of soil Sarcondina were found in the soil samples, and the Genusandwere found to harbor the most species (both 3 species). Among all species,sp.,,,,sp.,,andwere found in four sites. There were distinct differences in soil Sarcondina community composition under different vegetations, there most species (15 species) were observed under evergreen broad-leaved forest in the montane (Sample F) and the least species (9 species) under shrub and grass near to top of mountain (Sample G). There were various abundance distributions of soil Sarcondina communities under different vegetations, the highest abundance of soil Sarcondina was in Site F (29 200 ind./g) and the lowest was in Site G (3 510 ind./g). The Sarcodina community similarity index was in the level from moderate unsimilarity (0.25 - 0.5) to moderate similarity (0.5 - 0.75). Cluster analysis showed that the highest community similarity was found between the Sample A (evergreen broad leaved forest in valley) and Sample F (evergreen broad-leaved forest in montane), and community similarity between Sample B (evergreen broad-leaved forest in riparian) and Sample G (the shrub and grass near to top of the mountain) was higher, meanwhile the relatively lower community similarity between Sample D (coniferous and broad-leaved mixed forest) and other samples were noticed. Correlation analysis revealed that there was an extremely significant correlation (<0.01) between soil water content and the abundance of the Sarcodina, and there was a significant correlation between soil NO– 3-N and the abundance of the Sarcodina (<0.05). The multiple correlation analysis showed that there were correlations between the abundance of the soil Sarcodina and the combinations of soil physic-chemical factors, particularly with soil pH and water content. CCA analysis showed that different soil physical and chemical factors had different affects on different Sarcodina species. The results displayed the distribution of soil Sarcodina in Dinghu Mountain was consistent with Foissner “biogeography model”.
Soil Sarcodina; Community structure; Zoogeography model; The Dinghu Mountain Nature Reserve
10.13758/j.cnki.tr.2017.03.022
S154.38+5
A
国家自然科学基金项目(31030015)资助。
(xurunlin_1960@yahoo.com)
王超(1987—),男,山东人,硕士研究生,研究方向为动物生态学。E-mail:wangchao@qq.com

