富锌培养对香菇菌丝体生长和抗氧化酶系的影响
冮洁,张爽,刘瑶,解彬,庞士磊
(大连民族大学,生物技术与资源利用教育部重点实验室,辽宁 大连,116600)
富锌培养对香菇菌丝体生长和抗氧化酶系的影响
冮洁,张爽,刘瑶,解彬,庞士磊
(大连民族大学,生物技术与资源利用教育部重点实验室,辽宁 大连,116600)
通过对香菇菌丝体进行液体和固体富锌培养,以确定香菇菌丝体在外源锌的作用下生长和抗氧化酶活性的变化规律。香菇菌丝体具有较强的耐锌和富锌能力,低浓度锌对香菇菌丝体的生长有促进作用,高浓度有抑制作用,适宜的锌质量浓度为600 mg/L。在锌质量浓度400 ~1 000 mg/L,香菇菌丝体超氧化物歧化酶(Superoxide dismutase,SOD)、过氧化物酶(Peroxidase,POD)和过氧化氢酶(Catalase,CAT)随锌浓度增加先升高再降低,最大值分别为:147.47 U/g、6.15×10-3U/g和147.52 U/g;菌丝体丙二醛(Malondialdehyde,MDA)含量随锌浓度增加先呈下降的趋势,然后逐渐上升,在锌质量浓度600 mg/L时达到最低,为4.47×10-5μmol/g。香菇菌丝体抗氧化酶系随培养时间变化规律的研究结果表明,香菇菌丝体在培养的第9天,SOD、POD和CAT的酶活性均达最大值,MDA含量达到最低值,分别为:154.31 U/g、6.21×10-3U/g、147.92 U/g和4.18×10-5μmol/g。香菇菌丝体在适宜浓度富锌培养,不仅对香菇菌丝体的生长有促进作用,同时可提高香菇菌丝体的锌含量,并且提高了香菇菌丝体的抗氧化酶活性。
香菇;菌丝体;富锌;抗氧化酶
WHO调查表明,全球近1/3的人口面临着缺锌引起的健康问题,缺锌已成为影响人类健康的主要因素之一[1]。锌是人体必需微量元素之一,不但参与40多种酶的组成,更是稳定人体所必需的物质(RNA、DNA、核糖体)[2]。锌有“儿童生长素”之称,缺锌可致免疫力低下、佝偻病及贫血,营养不良及反复呼吸道感染,不同程度影响儿童生长发育[3-4],甚至导致出现异食癖[5]。补锌产品第一代是硫酸锌等无机锌,其缺点是难以吸收,且一般游离态金属均具有一定的毒性。第二代是葡萄糖酸锌和柠檬酸锌等有机锌,可以提高锌的吸收率,但因其含有酸根,对人体有一定的副作用。第三代是蛋白锌等生物锌,使锌能被人体更高效、更安全地吸收利用。食用菌具有较强的富锌能力。通过将锌摄入食用菌菌丝细胞内物质代谢转化,将无机锌结合到大分子活性物质(如多糖和蛋白质)上,成为有机锌多糖和锌蛋白,可以避免无机锌的缺点,并更有利于有机锌的免疫功能和食药用菌的抗病功能的发挥[6]。香菇是我国第二大栽培食用菌[7]。其菌丝体和子实体中能富集锌及其他微量元素[8]。香菇菌丝体对锌、硒、铁和锰等微量元素的吸收相互影响[9]。香菇可做为谷物食品的微量元素添加剂[10]。食用菌对微量元素的吸收主要都是通过菌丝体[11-14]。本课题研究了香菇菌丝体在外源锌的作用下生长和抗氧化酶活性的变化规律,为开发新型生物补锌制剂奠定理论基础。
1 材料与方法
1.1 实验材料
香菇(Lentinusedodes, 早丰8号),由辽宁省岫岩满族自治县嘉韵食用菌种植专业社提供;马铃薯,超市购买;葡萄糖、琼脂、MgSO4、KH2PO4、K2HPO4、NaOH、NaH2PO4、Na2HPO4、亚硒酸钠、愈创木酚、30%H2O2、甲硫氨酸、氮蓝四唑、EDTA-Na2、核黄素、PVP、DTT、硫代巴比妥酸等均为分析纯试剂;ZnSO4·7H2O,食品级,购自湖南奥驰生物科技有限公司。
1.2 实验仪器
Z-2000原子吸收光谱仪,日本日立公司;PL203电子精密天平,梅特勒-托利多仪器(上海)有限公司;HYG-3多功能摇床,金坛市杰瑞尔电器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;UV2800型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;GRP-9080恒温培养箱,上海森信实验仪器有限公司;TGL-16C高速台式离心机,江苏省兴化市分析仪器厂;KDB-III COD微波消解仪,青岛科迪博电子科技有限公司;MLS-3750高压灭菌锅,日本三洋;SW-CJ-1C无菌操作台,苏州净化设备有限公司。
1.3 实验方法
1.3.1 香菇菌种制备
斜面培养基(综合PDA培养基):马铃薯200 g、葡萄糖20 g、KH2PO41.5 g,MgSO41.0 g,琼脂粉20 g、水1 000 mL,pH 自然。
液体种子和发酵培养基:不加琼脂的综合PDA培养基。121 ℃,灭菌30 min。
富锌培养基:在PDA培养基和液体发酵培养基中按照实验需要的锌浓度加入硫酸锌,混匀后分装。
菌种活化:将保存菌种用接种针接入斜面培养基中,25 ℃恒温培养10 d。
液体菌种培养:将活化的斜面菌种4块(黄豆粒大小)接种到装有100 mL液体PDA综合培养基的250 mL三角瓶中,置25 ℃,150 r/min恒温振荡培养10 d。
1.3.2 香菇菌丝体液体培养
将液体菌种接入装100 mL发酵培养基的250 mL三角瓶中,接种量为10%, 25 ℃,150 r/min振荡培养10 d。培养结束后将菌丝体过滤,蒸馏水洗涤2遍,60 ℃烘干,称重后测定菌丝体中锌含量。
1.3.3 香菇菌丝体平板培养
在平皿中倒入PDA培养基制成培养平板,将斜面菌种用接菌环取出大小相近的2个菌块(黄豆粒大小),点接在培养平板上。于25 ℃恒温培养。
1.3.4 菌丝体生物量的测定
培养10 d的液体培养基称量发酵液体积(mL),用称量好的滤纸进行抽滤,抽滤过程中菌丝体用蒸馏水反复洗涤,将抽取的菌丝体放入60 ℃烘干至恒重,称重。按公式(1)计算生物量:
(1)
1.3.5 菌丝体锌含量的测定
按照国家标准GB/T5009.14-2003《食品中锌的测定》第一法,采用原子吸收光谱法测定。
(2)
1.3.6 抗氧化酶系酶活的测定
将液体培养基中菌丝体过滤后称取0.5 g,加入1 mL预冷的0.05 mol/L、pH 7.5的磷酸缓冲液,研磨后定容至5 mL,于冷冻离心机5 000 r/min,4 ℃、离心10 min,得上清液,为测定酶活溶液。
超氧化物歧化酶(SOD)采用氮蓝四唑(NBT)光化还原法测定[15]。SOD活性单位定义:以抑制NBT光化还原的50%为1个酶活性单位。SOD 总活性以鲜重酶单位每克表示(U/g)。
过氧化物酶(POD)测定参照文献[16]。过氧化物酶活性单位定义:以每克样品(鲜重)每分钟吸光度变化值增加1时记为1个活性单位。
过氧化氢酶(CAT)测定参照文献[17]。过氧化氢酶(CAT)活性单位定义:以每克样品鲜重每分钟吸光度变化值减少0.01为1个过氧化氢酶活性单位。
1.3.7 丙二醛(MDA)含量的测定
采用硫代巴比妥酸( TBA) 比色法[18]。
1.4 数据分析
每个试验处理3次重复,用Microsoft Excel软件计算平均值和标准偏差。
2 结果及分析
2.1 富锌培养对香菇菌丝体生长的影响
2.1.1 香菇菌丝体固体平板富锌培养的生长情况
通过香菇菌丝体固体平板富锌培养,测定菌落直径,考察香菇菌丝体耐锌能力,结果如表1所示。
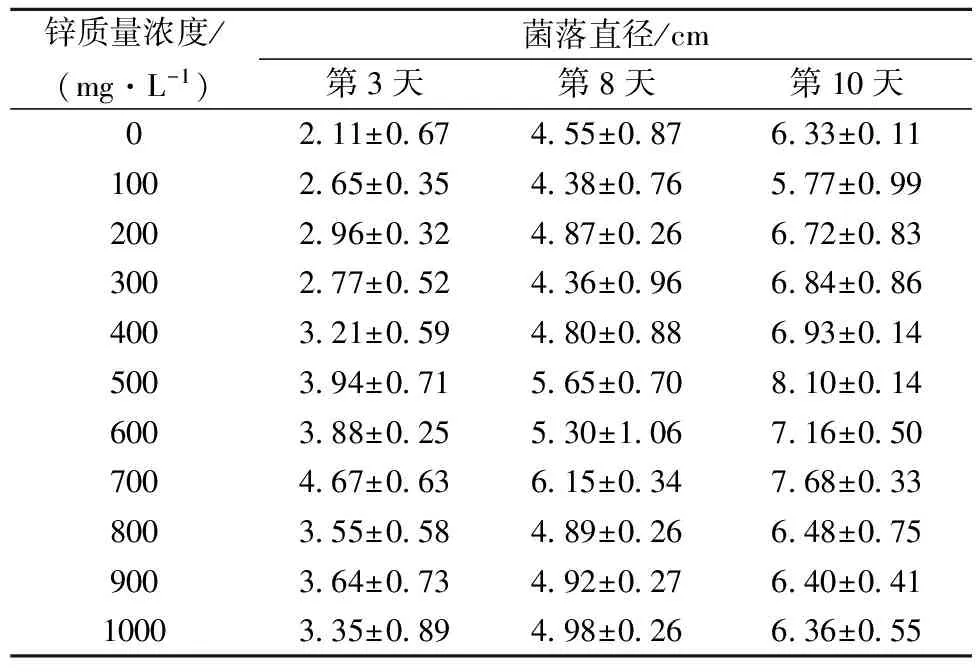
表1 香菇菌丝体固体平板富锌培养结果
根据表1所示,在不同的锌浓度的PDA固体培养基上,香菇菌丝生长情况有着明显的差异。在培养的第3天,在700 mg/L的锌质量浓度下菌丝生长得好,其次是锌质量浓度为500 mg/L、600 mg/L的培养基;在培养至第8天时,同样是700 mg/L的锌质量浓度下的香菇菌落直径最大;在第10天时,500 mg/L的锌质量浓度下的香菇菌落直径最大,其次是600 mg/L和700 mg/L的锌质量浓度。由此可见,在锌质量浓度低于500 mg/L时培养,香菇菌落直径随着锌浓度的增加而上升,而锌浓度为500~1 000 mg/L时,香菇菌丝的生长随锌浓度的增加而下降。在500 mg/L的锌浓度下的香菇菌落直径最大,表明生长的最好。
2.1.2 香菇菌丝体液体富锌培养生长情况
通过香菇菌丝体液体富锌培养,测定菌丝体生物量,考察香菇菌丝体耐锌能力,结果如表2所示。

表2 香菇菌丝体液体富锌培养结果
注:在同一列中,不同字母的标注表示数据具有显著差异(P≤0.05),标注顺序是从平均值最大的开始,依次为a,b,c,…,下同。
由表2可以看出,香菇菌丝体富锌培养,随着锌浓度的增加,生物量基本呈现稳步上升的状态。当锌质量浓度添加至600 mg/L时生物量最高达到2.28 g/100mL,继续增加锌质量浓度,生物量有所下降,但其生物量仍显著高于对照组(P≤0.05)。所以,香菇菌丝体具有很强的耐锌能力。菌丝体的锌含量随着锌质量浓度的增加而升高,锌质量浓度添加到800 mg/L以后,菌丝体中的锌没有明显地上升或者下降,仅有轻微波动,含量基本达到稳定。从富锌率来看,随锌浓度增加,逐渐增大,在800 mg/L浓度时,达到最大,但与600 mg/L和700 mg/L时的富锌率相差不大。所以,选择锌质量浓度600 mg/L为香菇菌丝体富锌液体培养时适宜添加的锌浓度。在食用菌培养过程中添加锌会刺激食用菌菌丝体的生长,增加菌丝体中的锌含量[19-24]。
2.2 香菇菌丝体富锌液体培养抗氧化酶变化规律
2.2.1 富锌培养香菇菌丝体超氧化物歧化酶变化规律
不同锌质量浓度下液体培养香菇菌丝体,其菌丝体中SOD酶活性测定结果如表3所示。

表3 不同锌质量浓度液体培养香菇菌丝体SOD酶活性
从表3可见,富锌液体培养香菇菌丝体,其SOD酶活性明显高于未添加锌源的液体培养菌丝体中SOD酶活性。锌质量浓度在400~700 mg/L,菌丝体SOD酶活性呈逐渐升高的趋势,700 mg/L以上逐渐降低。SOD酶活性在锌质量浓度700 mg/L时达到最高,为147.47 U/g,比未添加锌培养的菌丝体SOD酶活性增大了69.23%。当锌质量浓度达到1 000 mg/L时,菌丝体SOD酶活性有明显的降低,但仍然高于不添加锌源时培养的香菇菌丝体,说明添加锌能刺激香菇菌丝体的SOD酶活性升高。生物体内的过氧化作用,主要是由活性氧及其衍生物引起的脂质过氧化反应。抗氧化酶可以针对这些过氧化反应发挥作用,利用氧化还原作用将过氧化物转换为毒害较低或无害的物质[25]。SOD 可通过歧化反应消除O2-是生物体防护机制的中心酶,SOD 活性的增加代表 O2-的产生速率增加,可能还因为锌是 SOD 的重要组成部分[26]。
在锌质量浓度为600 mg/L液体培养时,香菇菌丝体SOD酶活性随时间变化规律,如图1所示。
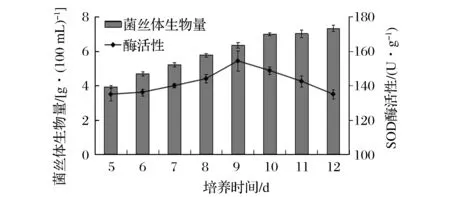
图1 富锌液体培养香菇菌丝体SOD酶活性变化规律Fig.1 SOD activity changes of Lentinus edodes mycelium in zinc accumulation liquid culture
从图1可见,在锌质量浓度为600 mg/L时,对香菇菌丝体进行富锌培养,随培养时间增加,菌丝体生物量逐渐增加,SOD酶活也逐渐增加,在培养的第9天,菌丝体SOD酶活性达到最大值,为154.31 U/g,之后呈逐渐下降趋势。
2.2.2 富锌培养香菇菌丝体过氧化物酶变化规律
不同锌浓度液体培养香菇菌丝体,其过氧化物酶活性测定结果如表4所示。
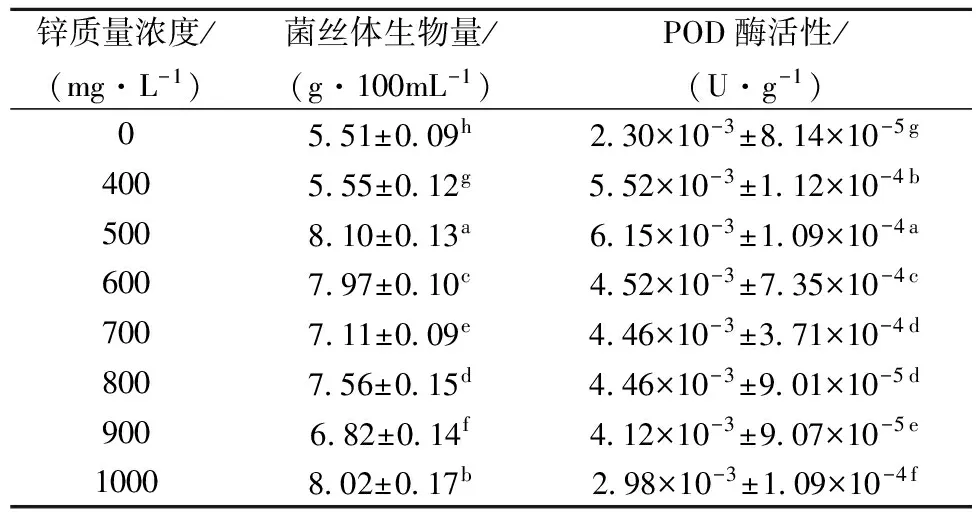
表4 不同锌浓度液体培养香菇菌丝体POD酶活性
在添加不同浓度锌源对香菇菌丝体液体培养时,菌丝体中过氧化物酶活性明显高于未添加锌源的菌丝体过氧化物酶活性。说明添加锌能刺激香菇菌丝体中POD酶活的增加。在锌质量浓度低于500 mg/L时,菌丝体过氧化物酶活性呈明显上升的趋势,高于500 mg/L之后,随锌浓度增加,POD酶活呈缓慢下降。在锌质量浓度500 mg/L时,达到最高值,为6.15×10-3U/g,比未富锌培养增大了167.39%。POD主要功能是减轻过氧化氢对机体的伤害,其活性的应激性变化被广泛作为反映植物受逆境胁迫程度的一个重要指标。锌进入植物组织后,胁迫植物体内产生大量有害的过氧化物,因此随着植物体内 POD酶底物浓度的增加诱使 POD活性增加[27]。对于香菇菌丝体来说,锌同样刺激其POD酶活的增加。
在锌质量浓度600 mg/L液体培养香菇菌丝体,其POD活性随时间变化规律如图2所示。
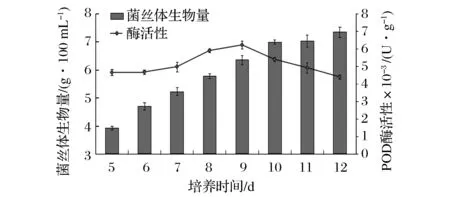
图2 富锌液体培养香菇菌丝体POD酶活变化规律Fig.2 POD activity changes of Lentinus edodes mycelium in zinc accumulation liquid culture
根据图2可知,香菇菌丝体POD酶活随培养时间的增加,逐渐增大,在第9天达到高峰,为6.21×10-3U/g,之后呈下降趋势。
2.2.3 富锌培养香菇菌丝体过氧化氢酶变化规律
不同锌质量浓度下液体培养香菇菌丝体,其过氧化氢酶活性测定结果如表5所示。
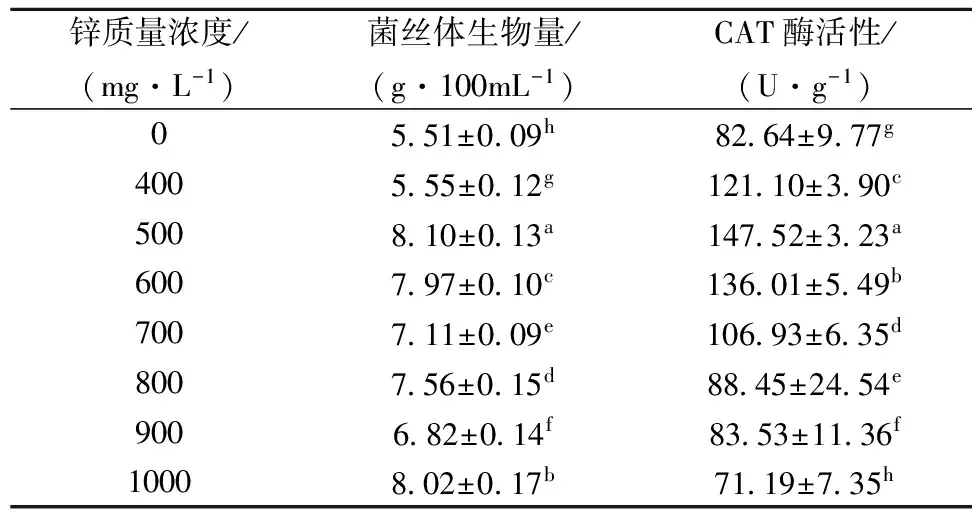
表5 不同锌质量浓度液体培养香菇菌丝体CAT酶活性
不同锌质量浓度液体培养香菇菌丝体,其过氧化氢酶活性明显高于未添加锌源的液体培养菌丝体过氧化氢酶活性。锌质量浓度在400~500 mg/L,菌丝体过氧化氢酶活性呈明显上升的趋势,在500 mg/L之后缓慢下降。在500 mg/L时,过氧化氢酶达到最高值,为147.52 U/g,比未富锌培养增大了78.51%。 CAT也是抗氧化酶系统的重要组成部分,可以催化过氧化氢分解为分子氧和水,有效清除体内活性氧[25]。添加锌培养,同样刺激了香菇菌丝体中CAT酶活的增加。
在锌浓度600 mg/L液体培养香菇菌丝体,其CAT活性随培养时间的变化规律如图3所示。
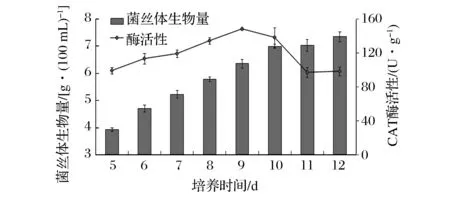
图3 富锌液体培养香菇菌丝体CAT酶活变化规律Fig.3 CAT activity changes of Lentinus edodes mycelium in zinc accumulation liquid culture
从图3可见,香菇菌丝体SOD酶活性随培养时间的增加逐渐增加,在第9天达到最大值,为147.92 U/g,之后呈下降趋势。
2.2.4 富锌培养香菇菌丝体丙二醛含量的变化规律
不同锌质量浓度液体培养香菇菌丝体,其MDA含量测定结果如表6所示。

表6 不同锌质量浓度液体培养香菇菌丝体丙二醛含量
不同锌质量浓度液体培养香菇菌丝体,其丙二醛含量明显低于未添加锌源的液体培养菌丝体丙二醛含量,说明富锌培养可抑制香菇菌丝体中丙二醛的产生。锌浓度在400~600 mg/L菌丝体丙二醛含量呈明显下降的趋势,600~800 mg/L丙二醛含量逐渐上升,在800 mg/L之后缓慢下降。在600 mg/L时,菌丝体中丙二醛含量达到最低值,为4.47×10-5μmol/g,比未添加锌培养的菌丝体丙二醛含量降低了66.89%。
富锌液体培养香菇菌丝体,其MDA含量随培养时间的变化规律如图4所示。
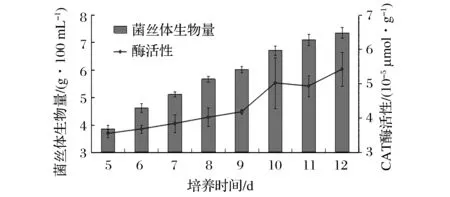
图4 富锌液体培养香菇菌丝体丙二醛含量变化规律Fig.4 MDA content changes of Lentinus edodes mycelium in zinc accumulation liquid culture
从图4中可以看出,从培养的第5天开始,香菇菌丝体中丙二醛含量随培养时间的增加,就逐渐呈上升趋势,说明菌丝体逐渐衰老,丙二醛逐渐产生。MDA是生物体内自由基作用于脂质发生过氧化反应最重要的产物之一,它的产生加剧膜的损伤,会引起蛋白质、核酸等生命大分子的交联聚合,且具有细胞毒性,因此在植物衰老生理和抗性生理研究中MDA含量是一个常用指标,可通过MDA了解膜脂过氧化的程度,以间接测定膜系统受损程度[25]。
3 结论
通过固体平板和液体富锌培养证明香菇菌丝体具有较强的耐锌和富锌能力,低浓度锌对香菇菌丝体的生长,有一定的促进作用,高浓度有抑制作用,适宜锌质量浓度为600 mg/L。通过不同浓度富锌液体培养以及同一浓度不同培养时间对香菇菌丝体抗氧化酶活性和丙二醛含量变化规律研究发现,与未添加锌源的菌丝体对比,适宜浓度的富锌培养可以使香菇菌丝体的SOD、POD和CAT酶活性显著提高,使丙二醛含量下降。香菇菌丝体在培养的第9天时,SOD、POD和CAT的酶活性均达最大值,MDA含量达到最低值,生长的各项指标达到最佳值。
[1] SCHERZ H, KIRCHHOFF E. Trace elements in foods: zinc contents of raw foods-a comparison of data originating from different geographical regions of the world[J]. Journal of Food Composition and Analysis, 2006, 25(23):312-315.
[2] 黄开明.锌硒宝配合醒脾养儿颗粒治疗小儿厌食症患儿的临床疗效评析[J].医学信息, 2015,28(19):212-213.
[3] 胡爱华,徐慧敏,胡国华,等.厌食症患儿外周血食欲调节因子水平变化与小儿厌食颗粒干预的影响[J].中国中药杂志, 2014, 39(23) : 4 685-4 688.
[4] 苏婵,邵莉,胡国华.二宝颗粒联合锌硒宝治疗小儿厌食症临床疗效观察[J].中国中西医结合消化杂志, 2016, 24(8):639-641.
[5] 王亚萍,李江全.小儿厌食症的中西药发病机制研究进展[J].浙江中西医结合杂志, 2013,23(4):335-337.
[6] 刘坤,沈卫,章克昌.姬松茸深层发酵富集锌的研究[J].食品与发酵工业,2005,31(4):83-86.
[7] 张丹,宋春艳,章炉军,等.基于全基因组序列的香菇商业菌种SSR遗传多样性分析及多位点指纹图谱构建的研究[J].食用菌学报, 2014,21(2):1-8.
[8] GEORGE P L,RANATUNGA T D,REDDY S S,et al.A comparative analysis of mineral elements in the mycelia and the fruiting bodies of shiitake mushrooms[J]. American Journal of Food Technology,2014,9(7):360-369.
[9] TURLO J,GUTKOWSKA B,HEROLD F,et al.Relationship between sodium selenite concentration in culture media and heavy metal uptake byLentinulaedodes(BERK.) in mycelial cultures[J].Fresenius Environmental Bulletin,2009,18(7):1 035-1 038.
[10] REGULA J,GRAMZA M. A new cereal food products with dried shiitake mushroom added as a source of selected nutrients[J].Italian Journal of Food Science,2010,22(3):292-297.
[11] 叶明,陈辉,章建国,等.香菇富锌及其培养条件优化[J].食品科学, 2006, 27(12):572-576.
[12] 竺俊鑫,简在友,孟丽,等.硫酸锌浓度对香菇生长发育的影响[J].西北农业学报,2008, 17(4) : 204-207.
[13] 张水成,王德芝.锌离子对香菇生育的影响[J].河南农业科学,2000(8):23-24.
[14] PETKOVSEK S A,POKORNY B.Lead and cadumium in mushrooms from the vicinity of two large emission soures in Slovenia[J].The Science of the Totel Environment,2013,443:942-952.
[15] 于孝保,朱继宏,付德峰,等.4种蔬菜中SOD活性测定研究[J].现代农业科技,2012(11):82;88.
[16] 车红霞,李靖雯,程利明,等.三种乳过氧化物酶检测方法的比较[J].食品工业科技,2015, 36(17):286-289.
[17] 杨兰芳,庞静,彭小兰,等.紫外分光光度法测定植物过氧化氢酶活性[J].现代农业科技,2009(20):364-366.
[18] 方海田,刘慧燕,张光弟.不同贮藏温度下辣椒中丙二醛含量的变化[J].农产品加工(创新版),2010(5):29-31;35.
[19] 王卉,张琪林,左静静,等.白灵菇液体培养菌丝的富锌能力研究[J].中国农学通报,2015(28):85-88.
[20] 董学卫,朱启忠,郭锦,等.大绿菇菌丝体富锌能力的研究[J].食品与机械,2007,23(5):17-19.
[21] 张琪林,王红.大球盖菇液体培养富锌特性研究[J].农业与技术,2007,27(5):58-59.
[22] 黄仁术,李耀亭.液体培养富锌金针菇锌源与锌添加量的研究[J].食品与发酵工业,2007, 33(12):48-51.
[23] 刘坤,沈卫,章克昌.姬松茸深层发酵富集锌的研究[J].食品与发酵工业,2005,31(4):84-86.
[24] 金萍.茶薪菇富锌深层培养条件研究[J].食用菌,2003(5):5-7.
[25] 王明洋,方勇,裴斐,等.硒对杏鲍菇营养品质和抗氧化酶活性的影响[J].食品科学,2016,37(11):208-213.
[26] 杨洪,黄志勇.锌胁迫对小球藻抗氧化酶和类金属硫蛋白的影响[J].生态学报,2012,32(22):7 117-7 123.
[27] 王培,孙倩,魏述,等.锌对小麦抗氧化酶活性的影响[J].安徽农业科学,2010,38(12):6 398 -6 399.
Effects of zinc on the growth and antioxidant enzymes ofLentinusedodesmycelium
GANG Jie,ZHANG Shuang,LIU Yao,XIE Bin,PANG Shi-lei
(Key Laboratory of Biotechnology and Bioresources Utilization,Ministry of Education,Dalian Minzu University,Dalian 116600,China)
The objective of this study was to determine the growing changes and the antioxidant enzyme activities ofLentinusedodesmycelium cultured in liquid and solid zinc-rich medium supplemented with exogenous zinc. The results showed thatLentinusedodesmycelium had strong resistance to zinc and zinc-rich ability, while the low zinc concentration could promote the mycelial growth ofLentinulaedodes, and the high zinc concentration could inhibit the growth, and the optimum concentration of zinc sulfate was 600 mg/L. The activities of superoxide dismutase (SOD), peroxidase (POD) and catalase (CAT) ofLentinulaedodesmycelium increased with the increase of zinc sulfate concentration in the range of 400 mg/L to 1 000 mg/L, and the maximum values were 147.47 U/g, 6.15×10-3U/g , 147.52 U/g, respectively. The content of malondialdehyde (MDA) decreased with the increase of zinc concentration, and then increased gradually, and the minimum content of MDA was 4.47×10-5μmol/g at a zinc concentration of 600 mg/L. SOD, POD and CAT activities ofLentinulaedodesmycelia reached the maximum value and the MDA content reached the lowest value on the 9 th day of culture, which were 154.31 U/g, 6.21×10-3U/g, 147.92 U/g and 4.18×10-5μmol/g, respectively. The optimal zinc concentration in the medium could improveLentinusedodesmycelium growth and the zinc content ofLentinusedodesmycelium, and increase the antioxidant enzyme activities.
Lentinusedodes;mycelium;zinc-accumulation;antioxidant enzymes
博士,教授(本文通讯作者,E-mail:gangjie@ dlnu.edu.cn)。
辽宁省自然科学基金资助项目(2015020676);财政专项-中央高校基本科研业务费资助项目(DC201501020301)
2017-01-23,改回日期:2017-02-15
10.13995/j.cnki.11-1802/ts.201706024

