血管内皮祖细胞对脓毒症小鼠重要器官的保护作用
陈 楠 靳彦涛 徐凯智 高 岩 文 翠 刘庆阳
华北理工大学 河北唐山 063000;①唐山工人医院麻醉科;②煤炭总医院
血管内皮祖细胞对脓毒症小鼠重要器官的保护作用
陈 楠 靳彦涛①徐凯智①高 岩 文 翠 刘庆阳②
华北理工大学 河北唐山 063000;①唐山工人医院麻醉科;②煤炭总医院
①目的 探讨血管内皮祖细胞(EPC)对脓毒症小鼠重要器官的保护作用。②方法 首先取6~8周龄的C57BL背景绿色转基因小鼠(20只)的骨髓细胞,用密度梯度离心法获取骨髓单个核细胞,通过体外培养骨髓单个核细胞获取EPC。然后用盲肠结扎穿孔法制作小鼠脓毒症模型,并随机分为假手术组(Sham组,n=18)、模型组(CLP组,n=28)和EPC回输组(CLP+EPC组,n=28)。通过尾静脉回输EPC,观察小鼠的一般状态,通过酶联免疫吸附法测定血管内皮受损情况,并用荧光显微镜观察EPC在血管壁、肺脏、肝脏以及肾脏的聚集情况。③结果 CLP组小鼠的一般情况较差,精神萎靡,活动迟缓,竖毛等,而CLP+EPC组小鼠的情况要轻。与Sham组小鼠相比,CLP组小鼠的血友病凝血因子(vWF)(49.31±0.73)、 血管内皮生长因子(VEGF)(46.13±1.07)和血管紧张素-Ⅱ(Ang-Ⅱ) (13.38±0.71)明显升高(P<0.05); 与CLP组小鼠相比,CLP+EPC组小鼠的vWF(39.95±2.04)、VEGF(33.35±1.47)和Ang-Ⅱ(10.80±0.67)明显降低(P<0.05)。荧光显微镜观察到EPC在血管壁、肺脏、肝脏和肾脏大量聚集。 ④结论 EPC回输可以迅速聚集在血管损伤部位,对脓毒症小鼠的器官功能受损起到一定的保护作用。
血管内皮祖细胞 脓毒症 小鼠 器官
脓毒症是指由感染引起的全身炎症反应综合征(Systemic inflammatory response syndrome,SIRS),是严重创伤、烧伤、休克、大手术后常见的并发症,进一步发展可导致脓毒性休克和多器官功能障碍综合征(Mutiple organ dysfunction syndrome,MODS),是临床危重病症中最常见的死亡原因。血管内皮细胞(VEC)广泛分布于全身各处,近年来研究认为,VEC是参与炎症应答的主要靶细胞之一[1,2],同时内皮细胞不仅是炎症反应中被动的靶细胞,也是一种效应细胞, 在微循环障碍、脓毒性休克及多器官功能损伤中起着重要作用[3]。VEC功能障碍作为脓毒症的病理生理基础,决定脓毒症的发展走向[4]。血管内皮祖细胞(Endothelial progenitor cells,EPC)是近年来发现的在血管新生和修复中起重要作用的一类前体细胞,可以不断循环增殖并分化为内皮细胞从而修复损伤的血管内皮[5]。本研究采用的是荧光小鼠的EPC,通过盲肠结扎穿孔法(Cecal ligation-peferation,CLP)建立脓毒症小鼠模型,来探究EPC对脓毒症小鼠的保护作用。
1 材料与方法
1.1 CLP小鼠模型的制备与EPC的回输 EPC的获取,将健康雄性6~8周龄的C57BL背景绿色转基因小鼠20只,体质量(20±2)克,清洁级,购自北京华阜康生物科技股份有限公司,动物许可证号:SCXK(京)2014-0004,颈椎脱臼处死, 75%酒精浸泡消毒15分钟。无菌条件下取出双侧胫骨干和股骨干,用5mL无菌注射器以磷酸盐缓冲液(PBS)10mL冲洗骨髓腔,冲洗干净后弃去股骨干,将冲出的骨髓吹打混匀。2000r/min,离心20分钟,密度梯度离心法获取骨髓单个核细胞。在光学显微镜下进行细胞计数。以107个接种在纤维连接蛋白包被的EGM-2培养基的培养瓶中,置37℃、5%CO2培养箱孵育。培养7天后获取EPC。将74只体质量(20±2)克、清洁级C57BL/6J小鼠随机分为假手术组(Sham组,n=18)、CLP模型组(CLP组,n=28)和CLP模型+EPC回输组(CLP+EPC组,n=28)。每组各有8只小鼠用于检测血管内皮相关因子,不做死亡率观察。
Sham组,将C57BL/6雄性小鼠仰卧位置于手术台,沿腹正中线修剪毛发,以75%酒精消毒腹部,纵行切开皮肤2cm,分层入腹,沿小肠分离寻找盲肠,将盲肠牵拉至体外,然后再将盲肠回纳腹腔,依腹壁层次,分两层缝合腹壁切口。再次经腹腔注入生理盐水1mL补充水分丢失。
CLP组,将C57BL/6雄性小鼠麻醉后仰卧位置于手术台,沿腹正中线修剪毛发,以75%酒精消毒腹部,纵行切开皮肤2cm,分层入腹,沿小肠分离寻找盲肠,将盲肠至体外,丝线结扎末端2/3盲肠,在结扎处近心端用16号针头穿刺末端盲肠4次,挤压可见肠内容物外漏,形成盲肠漏,然后再将盲肠回纳腹腔,依腹壁层次,分两层缝合腹壁切口。再次经腹腔注入生理盐水1mL补充水分丢失。
CLP+EPC组,CLP模型建立1小时后,尾静脉注射EPC1×107。
1.2 小鼠一般状态的观察 观察各组小鼠进食、精神和活动状态及生存情况,并记录。
1.3 酶联免疫吸附法测定vWF、VEGF和血管紧张素-Ⅱ(Ang-Ⅱ)的含量 各组小鼠在制作脓毒症模型24小时后进行摘眼球取血处死,取血之后对小鼠进行颈椎脱臼处死。在取血之前将试管内加入2mL肝素抗凝,摇晃试管混匀,然后4000r/min,离心10分钟,留取上清液,在-80℃冰箱冻存。按照ELISA试剂盒说明书操作检测vWF、VEGF和Ang-Ⅱ的含量。
1.4 荧光显微镜检测EPC的聚集 取肺脏、肾脏、肝脏及腹主动脉组织进行研磨,200目筛网滤过,用PBS液冲洗,然后1500r/min,离心5分钟,弃去上清,加入PBS液混匀,然后取150μL加到48孔板中,用荧光显微镜进行观察并照相。
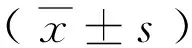
2 结果
2.1 小鼠一般状态的观察 CLP组小鼠的一般情况较差,出现精神萎靡、活动迟缓、竖毛等,而CLP+EPC组的小鼠一般情况要好。Sham组小鼠的状态没有明显变化。CLP组小鼠经盲肠结扎穿孔术后10小时开始出现死亡,当观察到72小时存活率仅为30%左右,见表1;而CLP+EPC组小鼠的生存率比CLP组有明显提高,72小时的生存率达到60%左右,见图1,明显提高了脓毒症小鼠的生存率。
2.2 各组小鼠血管内皮相关因子的比较 脓毒症模型建立后24小时CLP组小鼠血浆中内皮相关因子,包括血友病凝血因子(vWF)、血管内皮生长因子(VEGF)和Ang-Ⅱ的含量明显高于Sham组的小鼠(P<0.05);而CLP+EPC组血浆中内皮相关因子的含量均低于CLP组(P<0.05),见表2。
2.3 荧光显微镜追踪EPC的分布 为了证实EPC参与脓毒症的保护作用,本研究通过荧光显微镜观察EPC的定位情况,可以看到在腹主动脉、肝脏、肾脏和肺脏中均有EPC,起到对脓毒症血管内皮起的修复作用,见图2。

表1 各组小鼠在不同时间的存活数(只)

注:与Sham组比较,*P<0.05;与CLP组比较,#P<0.05
图1 各组小鼠不同时间的存活率

表2 各组小鼠血管内皮相关因子的比较
注:与Sham组比较,*P<0.05;与CLP组比较,#P<0.05

注:A:腹主动脉 B:肝脏 C:肾脏 D:肺脏
3 讨论
脓毒症是临床危重病症中最常见的死亡原因[6]。有研究表明,严重脓毒症28天的死亡率可能是50%或者更大[7]。生理条件下的内皮细胞能够调节凝血和抗凝的平衡,维持血管张力和通透性,脓毒症时剧烈炎症反应使得内皮细胞受损,促凝/抗凝失衡[8,9],内皮细胞受损反过来又能释放炎症因子不断招募炎症细胞,导致炎症瀑布效应,加重机体损伤[10,11]。这就提醒研究者如果在脓毒症早期能够及时修复受损的VEC,维持微循环的稳定,减轻炎症反应强度,从而达到降低脓毒症的死亡率。EPC是一种参与胚胎时期血管生成的原始干细胞,并且在出生后参与血管内皮的修复和功能的维持[12],它既能黏附、增殖并分化为VEC,修复损伤血管,又能以血管新生方式形成新的血管结构。已有研究证实移植EPC可有效修复机体的受损血管,同时减轻炎症反应,从而减少重要脏器的损伤[13]。本研究用的是同基因背景下绿色转基因小鼠的EPC,自带荧光特性能够被荧光显微镜成像,有利于EPC的追踪定位。
本研究采用的脓毒症模型是盲肠结扎穿孔模型,通过观察各组小鼠的一般情况和死亡率,发现CLP+EPC组的小鼠状态要比CLP组好,说明EPC对脓毒症起保护作用。目前,用于评判VEC激活或功能受损的生物标记物包含细胞间黏附因子-1(ICAM-1),血管细胞黏附因子-1(VCAM-1),Ang-Ⅱ,VEGF,vWF等因子,其含量的高低与VEC损伤程度呈正相关[14],本研究采用酶联免疫吸附法测定血浆中内皮相关因子包括vWF,VEGF和Ang-Ⅱ的含量,结果显示CLP组的血管内皮受损情况要比CLP+EPC组严重,进一步说明EPC能够保护脓毒症VEC的功能。EPC回输后在炎症因子和趋化介质的作用下到达血管受损部位,增殖并分化为VEC,通过荧光显微镜能够追踪EPC到达腹主动脉、肝脏、肾脏和肺脏部位,说明在脓毒症条件下,EPC能够到达受损部位,参与血管修复,在重症医学中具有重要的临床意义。
本研究对小鼠实施盲肠结扎穿孔法制作脓毒症模型,通过尾静脉回输EPC,发现EPC能够迅速聚集到受损部位,参与血管的修复,减轻脏器的损伤,并降低脓毒症的死亡率,从而为脓毒症患者和临床危重病EPC的回输提供了一个新思路。
[1] Levi M,Poll T.Endothelial injury in sepsis[J].Intensive Care Med,2013,39,1839-1842
[2] Opal SM,Von der Poll T.Endothelial barrier dysfunction in septic shock[J].J Intern Med,2015,277(3):277-293
[3] Lawton SK,Wilhelmsen K,Hellman J.Vascular endothelial cell Toll-like receptor pathways in sepsis[J].Innate Immunity,2015,21(8):827
[4] Skibsted S,Jones A,Puskarich MA,et al.Biomarkers of endothelial cell activation in early sepsis[J].Shock,2013,39(5):427-432
[5] Lee PS,Poh KK.Endothelial progenitor cells in cardiovascular diseases[J].World J Stem Cells,2014,6(3):355-366
[6] Glassford NJ,Eastwood GM,Bellomo.Physiological changes after fluid bolus therapy in sepsis:a systematic review of contemporary data[J].Crit Care,2014,18:696
[7] Rodriguze F,Barrera L,Rosa GD,et al.The epidemiology of sepsis in Colombia:A prospective multicenter cohort study in ten university hospitals[J].Crit Care Med,2011,39(7):1675-1682
[8] Ince C,Mayeux PR,Nguyen T,et al.The endothelium in sepsis[J].Shock,2016,45(3):259-270
[9] Souza AC,Yuen PS,Star RA.Microparticles:markers and mediators of sepsis-induced microvascular dysfunction,immunosuppression,and AKI[J].Kidney Int,2015,87(6):1100-1108
[10] Khakpour S,Wilhelmsen K,Hellman J.Vascular endothelial cell Toll-like receptor pathways in sepsis[J].Innate Immun,2015,21(8):827-846
[11] Wu M,Gu JT,Yi B,et al.microRNA-23b regulates the expression of inflammatory factors in vascular endothelial cells during sepsis[J].Exp Thera Med,2015,9:1125-1132
[12] Fan HK,Goodwin AJ,Chang E,et al.Endothelial Progenitor Cells and a Stromal Cell-derived Factor-1α Analogue Synergistically Improve Survival in Sepsis[J].Am J Respir Crit Care Med,2014,189(12):1509-1519
[13] Xu X,Yang J,Li N,et al.Role of endothelial progenitor cell transplantation in rats with sepsis[J].Transplant Proc,2015,47(10):2991-3001
[14] 章志丹,马晓春.脓毒症血管内皮细胞损伤与微循环功能障碍[J].中国危重病急救医学,2011,23(2):125-128
(2017-02-15 收稿)(库雪飞 编辑)
·读者 作者 编者·
医学名词术语使用规范
名词、术语应统一,不要一义多词或一词多义。妇产科学、耳鼻咽喉科学、血液病学、呼吸病学、内分泌学、眼科学和外科学的名词已由医学名词审定委员会审定公布,应严格执行,其他尚未审定者,目前以下列两个主题词索引为准:(1)《医学主题词注释字顺表(1992年版)中文索引》(中国医学科学院医学信息研究所,1992);(2)《中医药主题词表》(中国中医研究院图书情报研究所,1987)。在这二个主题词表中找不到者,则以人民卫生出版社出版的《英汉医学词汇》、化学工业出版社出版的《药名词汇》和科学出版社出版的各学科名词审定本为准。如“发烧”应改为“发热”,“红血球”应改为“红细胞”,“血红素”应改为“血红蛋白”,“剖腹产术”应改为“剖宫产术”等。国内尚无统一译名的,参考以上词典慎重拟定,并在译名后加括号注外文,在医学名词审定委员会正式公布的,应严格遵照执行。
The protective effect of vascular endothelial progenitor cells on important organs in septic mice
CHEN Nan,JIN Yantao,XU Kaizhi,et al
(North China University of Science and Technology,Tangshan 063000,China)
Objective To explore protective effect of the vascular endothelial progenitor cells on vital organs in septic mice.Methods Firstly,the vascular endothelial progenitor cells were obtained by culturing mononuclear cells in vitro,which were obtained by density gradient centrifugation from 6 to 8 weeks old C57BL transgenic mice(n=20).Then,sepsis model in mice were made by cecal ligation and puncture(CLP),and mice were dividied into sham operation group(Sham group,n=18),the model group(CLP group,n=28) and the endothelial progenitor cell reinfusion group(CLP+EPC group,n=28).The vascular endothelial progenitor cells were returned through mice tail vain,observed the general state of mice in three groups,and the damage of vascular endothelial was detected by ELISA,then the aggregation situation of the endothelial progenitor cells in vascular wall,lung,liver and kidney were observed by using fluorescence microscopy.Results The general state of mice in CLP group was poor,listlessness,slow and piloerection,but the mice with vascular progenitor cells was better than the CLP group.Compared with the mice in Sham group,the vWF(49.31±0.73),VEGF(46.13±1.07) and Ang-Ⅱ(13.38±0.71)were increased significantly(P<0.05)in CLP group,compared with the CLP group mice,the vWF(39.95±2.04),VEGF(33.35±1.47) and Ang-Ⅱ(10.80±0.67) were significantly decreased (P<0.05) in CLP+EPC group.The vascular endothelial progenitor cells were observed in the vascular wall,lung,liver and kidney by using fluorescence microscopy.Conclusion The vascular endothelial progenitor cells can be rapidly assembled at the site of vascular injury, and play a protective role in the organ dysfunction of sepsis mice.
Endothelial progenitor cells.Sepsis.Mice.Vital organs
国家自然科学基金(编号:81272140);中国博士后面上项目(编号:201150M1530); 中国博 士后第五批特别资助项目(编号:2012T50863)。
陈 楠(1991-),女,硕士研究生,医师。研究方向:脓毒症的基础与临床研究。
徐凯智,刘庆阳。
R 614.1
A
2095-2694(2017)04-253-05

