棉铃虫甾醇载体蛋白2原核表达及纯化
杜新凯,任 娟,胡 珺,王常高,林建国,蔡 俊,杜 馨
(湖北工业大学 发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,工业微生物湖北省重点实验室,湖北 武汉 430068)
棉铃虫甾醇载体蛋白2原核表达及纯化
杜新凯,任 娟,胡 珺,王常高,林建国,蔡 俊,杜 馨*
(湖北工业大学 发酵工程教育部重点实验室,工业发酵湖北省协同创新中心,工业微生物湖北省重点实验室,湖北 武汉 430068)
甾醇载体蛋白2(SCP-2)在昆虫体内甾醇吸收及运输过程中有着重要的生理功能。试验构建重组表达质粒pET-22b/HaSCP2,转化至E.coliBL21 (DE3)进行诱导表达,并对IPTG浓度、诱导时间及温度进行优化,经Ni柱分离纯化后分析其与胆固醇结合活性。SDS-PAGE分析表明,重组蛋白相对分子质量约为16 ku,且在25 ℃,IPTG终浓度0.2 mmol·L-1下诱导10 h为最佳诱导表达条件。经荧光探针8-苯胺-1-萘磺酸(1,8-ANS)竞争分析,胆固醇与HaSCP-2结合半数有效浓度(EC50)为29.03 μmol·L-1。该研究为深入研究棉铃虫SCP-2的功能以及后续HaSCP-2抑制剂的筛选研究奠定了基础。
棉铃虫;甾醇载体蛋白2;原核表达;原核纯化;原核优化
甾醇载体蛋白(sterol carrier protein-2,SCP-2)又称非特异性脂转运蛋白(non-specific lipidtransfer proteins,nsLTPs),是一类碱性可溶的低分子量蛋白质,广泛存在于动物、植物、细菌、真菌中[1]。已知的含SCP-2结构域家族包括:SCP-2、SCP-x、类SCP-2(SCP-2-like)、17-β-羟基固醇脱氢酶Ⅳ (17-β-hydroxysteroid dehydrogenase-4)、短链脱氢酶(short-chain dehydrogenase) 和血红细胞膜整合蛋白(stomatin)。SCP-2主要参与胞内胆固醇、脂肪酸和脂肪酸辅酶A的吸收、转运、氧化、酯化,以及磷脂代谢和信号传递等[2-3]。与哺乳动物不同,昆虫自身不能合成类固醇,必须从食物中获取谷甾醇、菜油甾醇、豆甾醇和麦角甾醇等植物甾醇,再转化为自身必须的胆固醇[4-5]。因此,昆虫SCP-2在甾醇代谢过程中扮演重要的角色。
目前,已在果蝇(Drosophilamelanogaster)、埃及伊蚊(Aedesaegypti)、棉贪夜蛾(Spodopteralittoralis)、家蚕(Bombyxmori)、斜纹夜蛾(Spodopteralitura)、烟草天蛾(Manducasexta)和棉铃虫(Helicoverpaarmigera)[6-12]等多种昆虫中发现了SCP-x/2基因。SCP-2蛋白在体内独立表达,其大小约13~16 ku。SCP-2功能研究发现,在培养的埃及伊蚊、斜纹夜蛾细胞中超表达SCP-2,促进了胆固醇的吸收和积累。此外,埃及伊蚊、斜纹夜蛾、棉铃虫幼虫RNA干扰与定点突变明显降低胆固醇的水平[13-16]。目前,关于SCP-2在体内胆固醇详细的转运机制仍不清楚。
棉铃虫是一类极具破坏性的世界农业害虫,对棉花,玉米,番茄和小麦等至少60种宿主植物造成危害[17]。据统计,棉铃虫已对多种杀虫剂如拟除虫菊酯类、烟碱类、阿维菌素、多杀菌素、有机磷、氨基甲酸酯以及Bt毒素等产生抗性[18]。近年来关于昆虫SCP-2抑制剂研究发现,埃及伊蚊SCP-2抑制剂(AeSCPIs)抑制蚊子和烟草天蛾幼虫对胆固醇的吸收,同时具有明显的致死效果[11,19-20]。此外,对棉铃虫的研究发现,AeSCPIs影响幼虫发育,对低龄幼虫具有致命性,同时推迟幼虫化蛹和化蛾时间,降低卵孵化率[12]。昆虫SCP-2作为新的害虫防治的靶点,对新型杀虫剂的开发具有重要意义。本文通过克隆棉铃虫SCP-2基因,进行构建表达载体,原核表达及其蛋白活性分析为进一步HaSCP-2的生物学功能和后续HaSCP-2抑制剂的筛选研究奠定了基础。
1 材料与方法
1.1 试验用昆虫、菌株及质粒
试验用棉铃虫购自湖北生物农药工程研究中心,实验室培养。大肠埃希菌E.coliBL21(DE3) 及质粒载体pET-22b由本实验室保存。
1.2 主要试剂及仪器
质粒DNA提取试剂盒,第一链cDNA合成试剂盒购自天根生化科技有限公司;T4 DNA连接酶、限制性内切酶(NdeⅠ和XhoⅠ)、DNA Marker及PCR试剂购自宝生物工程(大连)有限公司;Taq聚合酶、蛋白Marker购自Thermo scientific公司;氨苄青霉素(Amp)、IPTG购自Amresco公司;8-苯胺-1-萘磺酸(1, 8-ANS)购自阿拉丁生化科技有限公司;胆固醇购自国药集团化学试剂有限公司;其他试剂均为国产分析纯。引物合成、测序由南京金斯瑞生物科技有限公司完成。
VeritiTMPCR仪购自美国ABI公司;ZHWY恒温摇床购自上海智诚分析仪器制造有限公司;JY92-11超声波细胞粉碎机购自宁波新芝生物科技股份有限公司;DYCZ-24DN蛋白质电泳仪购自北京六一仪器厂;NGC蛋白层析仪购自美国BIO-RAD公司;Synergy2酶标仪购自美国BioTek公司;GBOX凝胶成像仪购自英国Syngene公司。
1.3HaSCP-2基因原核表达载体的构建及鉴定
棉铃虫中肠总RNA提取及第一链cDNA合成参照文献[12]。根据HaSCP-x基因序列(GenBank JN582013)设计HaSCP-2扩增引物HaSCP-2F:ATCATATGATGTACCGCAAAGGATTC和HaSCP-2R:GTCTCGAGCCTATTTACAGTTTGGAACGA,添加NdeI和XhoI酶切位点。以cDNA为模板进行PCR扩增,反应体系:cDNA 1 μL,10×PCR buffer 2.5 μL,dNTP 0.5 μL,HaSCP-2F 0.5 μL,HaSCP-2R 0.5 μL,Taq连接酶 0.5 μL,加无菌水至25 μL。反应条件为94 ℃预变性2 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸40 s,35个循环;72℃延伸2 min。通过PCR扩增得到HaSCP-2基因序列,经酶切后插入同样酶切的pET-22b载体上。转化至大肠埃希菌E.coliBL21(DE3)中,在含氨苄青霉素(100 μg·mL-1)的LB平板上37 ℃过夜培养12 h。筛选阳性克隆单菌株,根据质粒DNA提取试剂盒说明书提取重组质粒并进行PCR扩增鉴定及测序鉴定。
1.4 HaSCP-2蛋白的诱导表达及条件优化
取阳性单克隆菌株接种于含终浓度100 μg·mL-1氨苄青霉素的LB液体培养基中,37 ℃、180 r·min-1过夜培养10 h。再以1%接种量接种到含新鲜氨苄青霉素的LB液体培养基中培养,至D600值为0.6~0.8时,加入IPTG至终浓度0.3 mmol·L-1于30 ℃、220 r·min-1诱导表达10 h。培养菌液经5 000 r·min-1离心5 min,PBS(pH 7.3)重悬后,加入Loading buffer,加热煮沸5 min,通过15% SDS-PAGE电泳分析菌体重组蛋白表达情况。
1.4.1 诱导剂IPTG浓度的优化
按上述方法活化含重组质粒菌株,以1∶50比例接种到新鲜培养基中,至D600值为0.6~0.8时分别加入终浓度为0、0.2、0.4、0.6、0.8、1.0和1.2 mmol·L-1的IPTG,30 ℃、220 r·min-1诱导表达10 h。收集菌液,经离心、PBS(pH 7.3)重悬后,通过12% SDS-PAGE电泳分析菌体重组蛋白表达情况。
1.4.2 诱导温度的优化
重组质粒菌株培养同上,在最适IPTG浓度条件下,分别在20、25、30和37 ℃条件下220 r·min-1诱导10 h。收集菌液,经离心、PBS(pH 7.3)重悬后,通过12% SDS-PAGE电泳分析菌体重组蛋白表达情况。
1.4.3 诱导时间的优化
重组质粒菌株培养同上,在最适IPTG浓度和最适温度情况下,220 r·min-1分别诱导2、4、6、8、10和12 h。收集菌液,经离心、PBS(pH 7.3)重悬后,通过15% SDS-PAGE电泳分析菌体重组蛋白表达情况。
1.5 HaSCP-2蛋白的纯化
取阳性重组菌活化后,以1∶100比例扩大培养,按诱导表达优化后条件进行诱导表达。收集菌液,5 000 r·min-1离心5 min,PBS(pH 7.3)重悬后,再离心并用平衡缓冲液(25 mmol·L-1咪唑,20 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,pH 8.0)重悬,于冰浴中超声破碎裂解,功率180 W,超声6 s,间隔4 s。10 000 r·min-1,4 ℃,离心15 min,取上清液。将上清液经0.45 μm滤膜过滤后于镍离子层析柱进行亲和纯化,用洗脱缓冲液(300 mmol·L-1咪唑,20 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,pH 8.0)梯度洗脱目的蛋白。纯化后的蛋白在冰水浴下透析约10 h,再经超滤管浓缩。通过15%的SDS-PAGE电泳分析HaSCP-2重组蛋白的纯度,采用Bradford法[21]测定纯化的蛋白浓度。
1.6 HaSCP-2蛋白与胆固醇结合活性
使用8-苯胺-1-萘磺酸(1,8-ANS)荧光探针检测其与HaSCP-2蛋白结合能力。在200 μL反应体系中,加入纯化后的重组HaSCP-2蛋白终浓度为30 mmol· L-1,不同终浓度的1,8-ANS分别为0,5,10,15,20,25,30,35,40,45,50和55 μmol·L-1。孵育3 min后,酶标仪检测,激发光360 nm,发射光460 nm,狭缝均为20 nm。记录HaSCP-2蛋白和不同浓度1,8-ANS反应后的荧光值,分析结合能力,计算公式:Y=Bmax×X/(Kd+X)。
胆固醇与HaSCP-2蛋白结合亲和力通过竞争取代分析测定。在96孔荧光酶标板中,10 μmol·L-1重组HaSCP-2蛋白与20 μmol·L-11,8-ANS混合反应2 min,在加入不同浓度胆固醇溶液(终浓度5、10、20、50和100 μmol·L-1),反应3 min后记录荧光值。通过单位点竞争结合,非线性回归分析计算半数效应浓度(EC50),计算公式为:Y=Best fit value MIN + (Best fit value MAX-Best fit value MIN)/(1+10(X-lgEC50)) 。
2 结果与分析
2.1HaSCP-2基因原核表达载体的构建及鉴定
从棉铃虫中肠总RNA反转录得到cDNA序列,以HaSCP-2F和HaSCP-2R为引物扩增得到HaSCP-2基因序列,经NdeI和XhoI酶切插入同样酶切的pET-22b载体上,转化到E.coliBL21(DE3)感受态细胞中,挑选阳性克隆菌提取重组质粒,PCR鉴定(图1)和基因测序验证,测序结果与NCBI上HaSCP-2序列一致,表明成功构建重组质粒。

M, DL2000 DNA Marker;1, pET-22b/HaSCP2重组质粒PCR产物M,DL2000 DNA Marker;1,pET-22b/HaSCP2 plasmids PCR product图1 重组pET-22b/HaSCP2质粒PCR鉴定Fig.1 Identification of pET-22b/HaSCP-2 plasmids PCR amplification
2.2 HaSCP-2蛋白的诱导表达及条件优化
取含重组质粒pET-22b/HaSCP-2的BL21(DE3)菌株进行培养,经IPTG诱导表达,SDS-PAGE电泳分析结果表明,在16 ku左右出现一条蛋白带,与目标蛋白分子量相符;未诱导重组菌则无该蛋白表达。由此可见,该蛋白条带为重组HaSCP-2蛋白。
通过对诱导剂IPTG浓度,诱导温度和诱导时间进行优化,SDS-PAGE电泳结果显示在30 ℃、不同IPTG浓度下诱导10 h,目标蛋白的表达量并没有太大变化(图2)。高浓度的IPTG没有明显增加蛋白含量,考虑到高浓度IPTG对细胞的抑制影响,选择最佳IPTG浓度为0.2 mmol·L-1;分别在20、25、30和37 ℃,终浓度0.2 mmol·L-1IPTG下诱导10 h(图3),蛋白表达量在25 ℃时最大,随着温度的升高,蛋白表达量明显下降,因此选择最佳诱导温度25 ℃;在25 ℃,终浓度0.2 mmol·L-1IPTG下分别诱导2、4、6、8、10和12 h(图4),在0~10 h蛋白表达量随着时间的增加而增加,10 h后表达量稳定,因此选择最佳诱导时间为10 h。
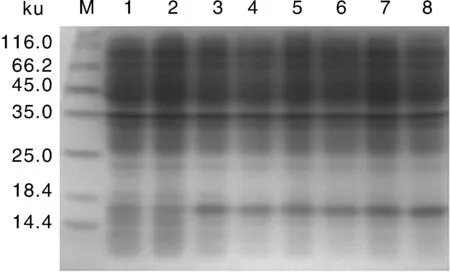
M, 蛋白质分子量标准;1~2, 未诱导组;3~8, 不同浓度IPTG浓度(0.2、0.4、0.6、0.8、1.0和1.2 mmol·L-1)处理组M, Marker; 1-2, Non-induced group; 3-8, Treatments of different concentrations of IPTG (0.2, 0.4, 0.6, 0.8, 1.0, 1.2 mmol·L-1)图2 诱导剂IPTG对重组HaSCP-2蛋白表达的影响Fig.2 Effects of IPTG concentrations on the expression of recombinant HaSCP-2 protein
2.3 HaSCP-2蛋白的纯化
在最佳诱导条件下对重组菌大量诱导表达,经亲和镍柱结合后,在150 mmol·L-1咪唑浓度下开始洗脱蛋白,再透析脱盐。纯化产物经SDS-PAGE分析,在16 ku处得到较纯的重组HaSCP-2蛋白,含量在90%以上。纯化的蛋白经Bradford法测得的浓度为1.003 mg·mL-1(图5)。

M, 蛋白质分子量标准;1~4, 不同诱导温度(20、25、30和37 ℃)实验组;5, 未诱导组M, Marker; 1-4, Treatments of different temperature (20, 25, 30, 37 ℃); 5, Non-induced group图3 诱导温度对重组HaSCP-2蛋白表达的影响Fig.3 Effects of induced temperature on the expression of recombinant HaSCP-2 protein

M, 蛋白质分子量标准;1, 未诱导组;2~6, 实验组不同诱导时间依次为2、4、6、8、10和12 hM, Marker; 1, Non-induced group; 2-6, Treatments of different induced time (2, 4, 6, 8, 10, 12 h)图4 诱导时间对重组HaSCP-2蛋白表达的影响Fig.4 Effects of induced time on the expression of recombinant HaSCP-2 protein
2.4 HaSCP-2蛋白与胆固醇结合活性
荧光探针1,8-ANS与HaSCP-2蛋白结合曲线如图6所示,随着1,8-ANS浓度的升高,荧光强度逐渐升高,在50 μmol·L-1浓度后荧光值趋于饱和,表明蛋白和1,8-ANS有效结合。通过单位点结合、非线性回归分析得到HaSCP-2蛋白与1,8-ANS的结合常数为1.973 μmol·L-1(R2= 0.98)。
HaSCP-2蛋白与1,8-ANS结合后,通过不同浓度胆固醇竞争取代1,8-ANS。如图7,随着胆固醇浓度的升高,体系相对荧光强度(relative fluorescence units,RFU)降低,表明荧光探针1,8-ANS被胆固醇从蛋白结合位点竞争取代,通过计算得到胆固醇结合半数有效剂量EC50值为29.03 μmol·L-1。

M, 蛋白质分子量标准;1, 未诱导菌液;2, 诱导后菌液;3, 经镍柱纯化重组HaSCP-2蛋白;4, 透析后重组HaSCP-2蛋白M, Marker; 1, Non-induced bacteria liquid; 2, Induced bacteria liquid; 3, Recombinant HaSCP-2 protein purified through Ni2+-affinity column; 4, Recombinant HaSCP-2 protein after dialysis图5 重组HaSCP-2蛋白的SDS-PAGE分析Fig.5 SDS-PAGE analysis of recombinant HaSCP-2 protein

图6 HaSCP-2蛋白与1,8-ANS结合曲线Fig.6 Binding curve of HaSCP-2 protein and 1,8-ANS

图7 1,8-ANS与胆固醇竞争结合HaSCP-2分析Fig.7 Competitive binding assay of 1,8-ANS in HaSCP-2 with cholesterol
3 讨论
昆虫SCP-2蛋白在中肠细胞中表达量最高,能更好的吸收胆固醇,对昆虫正常生长、发育和繁殖起着重要的作用[11-12,22]。本研究从棉铃虫中肠提取RNA,克隆HaSCP-2基因,选用大肠埃希菌做为克隆和表达。大肠埃希菌易繁殖培养,已被广泛应用于表达宿主菌。pET-22b系统所带His标签小,不影响目的蛋白结构和功能,且蛋白表达量大,易纯化,故以此进行克隆表达。PCR条带单一,且序列一致,说明该载体可用于重组HaSCP-2表达。重组蛋白原核表达受诱导剂、诱导温度和时间的影响,对诱导条件优化可提高重组蛋白的产量。在不同IPTG浓度下,重组蛋白产量并没有显著变化,高浓度的IPTG可能抑制重组蛋白的表达,因此低浓度的IPTG浓度更适合用于诱导表达。随着温度的升高,蛋白产量反而下降,这表明30~37 ℃下菌体更容易生长。在最适IPTG浓度和诱导温度下,蛋白量不断积累,10 h后蛋白量变化不大。因此,重组蛋白最佳诱导表达条件为25 ℃,IPTG终浓度0.2 mmol·L-1下诱导10 h。
SCP-2与配体结合亲和力通过竞争取代分析,常用的荧光探针有NBD放射标记胆固醇(NBD-cholesterol)[14]和8-苯胺-1-萘磺酸(1,8-ANS)[15]。1,8-ANS相比NBD胆固醇更加廉价,且适合大规模药物筛选。1,8-ANS在水溶液中几乎无荧光,但是与蛋白疏水性表面结合后发出荧光,因此可用来作为探针用于竞争取代分析。重组HaSCP-2与1,8-ANS结合后发出荧光,可判断1,8-ANS结合到蛋白疏水腔中,天然底物胆固醇竞争取代1,8-ANS后荧光强度下降,表明蛋白具有生物学活性,且半数有效剂量EC50值为29.03 μmol·L-1。综上所述,本试验可为后续HaSCP-2抑制剂的研发及SCP-2特异性新型农药的研发奠定基础。
[1] GALLEGOS A M, ATSHAVES B P, STOREY S M, et al. Gene structure, intracellular localization, and functional roles of sterol carrier protein-2[J].ProgressinLipidResearch, 2001, 40(6): 498-563.
[2] STOLOWICH N, PETRESCU A, HUANG H, et al. Sterol carrier protein-2: structure reveals function[J].CellularandMolecularLifeSciences, 2002, 59(2): 193-212.
[3] SCHROEDER F, ATSHAVES B P, MCINTOSH A L, et al. Sterol carrier protein-2: New roles in regulating lipid rafts and signaling[J].BiochimicaetBiophysicaActa(BBA) -MolecularandCellBiologyofLipids, 2007, 1771(6): 700-718.
[4] CLARK A, BLOCH K. The absence of sterol synthesis in insects[J].JournalofBiologicalChemistry, 1959, 234(10): 2578-2582.
[5] IKEKAWA N, MORISAKI M, FUJIMOTO Y. Sterol metabolism in insects: dealkylation of phytosterol to cholesterol[J].AccountsofChemicalResearch, 1993, 26(4): 139-146.
[6] KITAMURA T, KOBAYASHI S, OKADA M. Regional expression of the transcript encoding sterol carrier protein x-related thiolase and its regulation by homeotic genes in the midgut of Drosophila embryos[J].Development,Growth&Differentiation, 1996, 38(4): 373-381.
[7] KREBS K C, LAN Q. Isolation and expression of a sterol carrier protein-2 gene from the yellow fever mosquito,Aedesaegypti[J].InsectMolecularBiology, 2003, 12(1): 51-60.
[8] TAKEUCHI H, CHEN J, JENKINS J, et al. Characterization of a sterol carrier protein 2/3-oxoacyl-CoA thiolase from the cotton leafworm (Spodoptera littoralis): a lepidopteran mechanism closer to that in mammals than that in dipterans[J].BiochemicalJournal, 2004, 382: 93-100.
[9] GONG J, HOU Y, ZHA X F, et al. Molecular cloning and characterization of Bombyx mori sterol carrier protein x/sterol carrier protein 2 (SCPx/SCP2) gene[J].DNASequence, 2006, 17(5): 326-333.
[10] GUO X R, ZHENG S C, LIU L, et al. The sterol carrier protein 2/3-oxoacyl-CoA thiolase (SCPx) is involved in cholesterol uptake in the midgut of Spodoptera litura: gene cloning, expression, localization and functional analyses[J].BMCMolecularBiology, 2009, 10(1): 102.
[11] KIM M S, LAN Q. Sterol carrier protein-x gene and effects of sterol carrier protein-2 inhibitors on lipid uptake inManducasexta[J].BMCPhysiology, 2010, 10(1): 1-15.
[12] DU X, MA H, ZHANG X, et al. Characterization of the sterol carrier protein-x/sterol carrier protein-2 gene in the cotton bollworm,Helicoverpaarmigera[J].JournalofInsectPhysiology, 2012, 58(11): 1413-1423.
[13] LAN Q, WESSELY V. Expression of a sterol carrier protein-x gene in the yellow fever mosquito,Aedesaegypti[J].InsectMolecularBiology, 2004, 13(5): 519-529.
[14] RADEK J T, DYER D H, LAN Q. Effects of mutations in Aedes aegypti sterol carrier protein-2 on the biological function of the protein[J].Biochemistry, 2010, 49(35): 7532-7541.
[15] Zhang L, Li D, Xu R, et al. Structural and functional analyses of a sterol carrier protein inSpodopteralitura[J].PLoSOne, 2014, 9(1): e81542.
[16] Ma H, Ma Y, Liu X, et al. NMR structure and function of Helicoverpa armigera sterol carrier protein-2, an important insecticidal target from the cotton bollworm[J].ScientificReports, 2015, 5(1): 18186.
[17] Czepak C, Albernaz K C, Vivan L M, et al. First reported occurrence ofHelicoverpaarmigera(Hübner)(Lepidoptera: Noctuidae) in Brazil[J].PesquisaAgropecuriaTropical, 2013, 43(1): 110-113.
[18] Arthropod Pesticide Resistance Database (APRD)[EB/OL].[2016-12-20]. http://www.pesticideresistance.org/.
[19] KIM M S, WESSELY V, LAN Q. Identification of mosquito sterol carrier protein-2 inhibitors[J].JournalofLipidResearch, 2005, 46(4): 650-657.
[20] LARSON R T, WESSELY V, JIANG Z, et al. Larvicidal activity of sterol carrier protein-2 inhibitor in four species of mosquitoes[J].JournalofMedicalEntomology, 2008, 45(3): 439-444.
[21] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].AnalyticalBiochemistry, 1976, 72(1-2): 248-254.
[22] LAN Q, MASSEY R J. Subcellular localization of the mosquito sterol carrier protein-2 and sterol carrier protein-x[J].JournalofLipidResearch, 2004, 45(8): 1468-1474.
(责任编辑 张 韵)
Prokaryotic expression and purification of sterol carrier protein-2 fromHelicoverpaarmigera
DU Xinkai, REN Juan, HU Jun, WANG Changgao, LIN Jianguo, CAI Jun, DU Xin*
(KeyLaboratoryofFermentationEngineering(MinistryofEducation),HubeiProvincialCooperativeInnovationCenterofIndustrialFermentation,HubeiKeyLaboratoryofIndustrialMicrobiology,HubeiUniversityofTechnology,Wuhan430068,China)
Sterol carrier protein 2 (SCP-2) plays important physiological roles in sterols absorption and transport in insects. In this study, the recombinant expression plasmid pET-22b/HaSCP2 was constructed and transformed intoE.coliBL21 (DE3) for inducible expression. Induction conditions of the IPTG concentrations, the induction time and temperature were optimized. The recombinant HaSCP-2 was purified using Ni2+-affinity column, and the protein functions of HaSCP-2 was tested by competitive displacement assay. SDS-PAGE analysis suggested that the molecular weight of the recombinant protein was about 16 ku, and the optimal expression conditions were at the temperature of 25 ℃ and at the final concentration of 0.2 mmol·L-1IPTG for 10 h. Fluorescent probe 8-aniline-1-naphthalenesulfonic acid (1,8-ANS) was used for competitive analysis, and 1,8-ANS was replaced by cholesterol bound to HaSCP-2 with a half effective concentration (EC50) of 29.03 μmol·L-1. This study provides good opportunity for further study on the function of HaSCP-2 and the screening of HaSCP-2 specific inhibitors.
Helicoverpaarmigera; sterol carrier protein-2; prokaryotic expression; prokaryotic purification; prokaryotic optimization
http://www.zjnyxb.cn
10.3969/j.issn.1004-1524.2017.07.15
2017-02-22
国家自然科学基金项目(31401807);湖北工业大学高层次人才科研启动项目(BSQD13002);湖北工业大学大学生创新创业项目(201510500064)
杜新凯(1991—),男,河南灵宝人,硕士研究生,研究方向为发酵过程优化。E-mail: duxinkai78@163.com
*通信作者,杜馨,E-mail: 99023801@qq.com
S435
A
1004-1524(2017)07-1166-06
浙江农业学报ActaAgriculturaeZhejiangensis, 2017,29(7): 1166-1171
杜新凯,任娟,胡珺,等. 棉铃虫甾醇载体蛋白2原核表达及纯化[J].浙江农业学报,2017,29(7): 1166-1171.

