不同氮形态对连作平邑甜茶幼苗生长及土壤尖孢镰孢菌数量的影响
王玫,段亚楠,孙申义,相立,王功帅,陈学森,沈向,尹承苗*,毛志泉*
(1山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安271018;2山东省招远市果业总站,山东招远265400)
不同氮形态对连作平邑甜茶幼苗生长及土壤尖孢镰孢菌数量的影响
王玫1,段亚楠1,孙申义2,相立1,王功帅1,陈学森1,沈向1,尹承苗1*,毛志泉1*
(1山东农业大学园艺科学与工程学院/作物生物学国家重点实验室,山东泰安271018;2山东省招远市果业总站,山东招远265400)
【目的】研究盆栽条件下不同形态氮对苹果砧木—平邑甜茶幼苗生长以及对连作土壤微生物的影响,为连作建园时科学施肥、减轻苹果连作障碍提供依据。【方法】试验于2015年露地进行,以平邑甜茶幼苗为试材,以连作土为对照1(CK1)和溴甲烷熏蒸为对照2(CK2),设置施入铵态氮(T1)、硝态氮(T2)和酰胺态氮(T3) 3个不同形态氮处理(N180mg/L),于2015年8月测定平邑甜茶生物量、光合参数和土壤微生物等相关指标。【结果】铵态氮(T1)和酰胺态氮(T3)处理均能明显提高连作条件下‘平邑甜茶’苹果幼苗的生物量,其中T1处理的株高、地径、鲜重、干重与CK1相比分别提高了35.3%、24.4%、42.0%、57.7%。添加3种形态氮素均可不同程度地提高平邑甜茶幼苗叶片的净光合速率(Pn)、气孔导度(Gs)和根系呼吸速率,其中T1处理的Pn、Gs和根系呼吸速率分别比CK1提高了27.6%、35.6%、43.3%,却并未达到CK2的效果。实时荧光定量PCR结果表明,CK2尖孢镰孢菌的基因拷贝数降低最为明显,比CK1降低了52.6%,T1也有效地降低了尖孢镰孢菌的基因拷贝数,而T2和T3处理尖孢镰孢菌的基因拷贝数与CK1没有显著性差异。T-RFLP结果表明,T1和T3处理的真菌群落结构与CK1有明显差异,T1处理与CK2的真菌群落结构较为相似,T2处理的真菌群落结构与CK1较为相似。【结论】铵态氮处理可更好地提高连作平邑甜茶幼苗的生物量、净光合速率以及根系呼吸速率,降低土壤尖孢镰孢菌的基因拷贝数,明显改变连作土壤的真菌群落结构,可作为减轻苹果连作障碍的措施。
平邑甜茶;苹果连作障碍;氮形态;光合参数;土壤尖孢镰孢菌
苹果作为我国栽培面积最大的果树之一,每年都面临着大规模的老果园改造,老果园更新时面临的连作障碍现象非常普遍,连作障碍通常表现为植株矮小、光合作用减弱、产量和品质下降、病虫害加重等问题,造成巨大的经济损失[1–2]。连作障碍已成为中国苹果优势产区一个普遍存在且亟需解决的生产问题[3–4]。众多研究表明,造成连作障碍的主要致病真菌属有柱孢属、镰孢属、丝核属、疫霉属和腐霉属等[5–6]。Van Schoor等研究发现,在南非所有连作苹果园中土壤有害真菌镰孢属、柱孢属及腐霉属是引起连作障碍的主要原因[7–8],Tewoldemedhin等从连作苹果园腐烂的根中分离到了大量的尖孢镰孢菌[9]。
目前用于防治连作障碍的方法很多,如抗性品种选育、轮作与间作、土壤熏蒸及生物防治等[10–12]。这些措施中以轮作和土壤熏蒸效果最佳,但轮作耗时太长,熏蒸对环境和人体不利[13],生物防治存在不同有益微生物(拮抗菌)在土壤中定殖能力差、效果不稳定等不足。其他措施效果不稳定或不显著,目前均难以在生产中大面积推广应用。
氮素是苹果栽培过程中施用较多的营养元素,是果树生长发育、产量和品质形成的物质基础,对植株抗性、生长代谢、植株病害及产量的形成有重大影响,因此研究不同形态氮素对果树的影响具有重要意义[14]。大量研究表明,不同氮素形态与植物微生物病害(连作障碍的重要原因之一)有关,氮素营养可以通过影响植株所在土壤环境进而调控植物的生长发育过程[15–16],如铵态氮能够抑制草莓黑根腐病,硝态氮能够抑制番茄和豌豆的根腐病等[17]。有研究表明液氨作为熏蒸剂能够杀死土壤中有害真菌,可用于连作障碍的防治[18]。不同形态的氮素营养不仅可以调节植株的生长代谢,如光合作用、矿物质吸收等,而且会影响土壤动物、微生物生长及其代谢物分泌等,从而改变植株根系的土壤环境、影响植株生长[19]。Snoeijers等[20]研究发现,氮素本身是一些真菌侵染植物根部细胞时的信号分子,植物体内的氮代谢会影响某些基因的表达或超表达。因此,通过氮素营养改变果树根系生长的土壤环境从而调控果树生长发育是可行的,但不同形态氮如何影响连作条件下苹果植株的生长、连作土壤微生物结构,以及对连作障碍发生程度的影响有何不同等鲜有报道。本研究以平邑甜茶幼苗为试材,探讨不同形态氮对其生长及连作土壤微生物的影响,以期为减轻苹果连作障碍提供新的措施。
1 材料与方法
1.1 试验材料
试验于2015年在山东农业大学南校区国家苹果工程中心试验基地进行。供试材料为平邑甜茶(Malus hupeheusis Rehd.)实生苗。将平邑甜茶种子于4℃层积30d左右,种子露白后,于2015年4月播种于装有育苗基质的培养钵中育苗。待幼苗长至6片真叶时选取长势一致、无病虫害植株,于5月1日移栽至装有6.5kg不同处理土壤的泥瓦盆中(上直径25cm、下直径为17cm、高18cm),每盆定植2棵幼苗,统一肥水管理。
供试土壤取自山东省泰安市满庄镇25年生红富士苹果园,砧木为八棱海棠(Malus micromalus Makino.),土壤类型为棕壤,土壤pH为6.08,速效钾含量为90.6mg/kg,有效磷含量为9.3mg/kg,硝态氮含量为5.5mg/kg,铵态氮含量为3.8mg/kg,有机质含量为5.3g/kg。
试验共设置5个处理,分别为:连作土壤(CK1),溴甲烷熏蒸的连作土壤(CK2),连作土壤施用铵态氮(NH4HCO3)5g/pot(T1),硝态氮[Ca(NO3)2·4H2O]7.5g/pot(T2),酰胺态氮(尿素) 2g/pot(T3),所用氮肥均为分析纯试剂,施氮量相当于纯N180mg/L,每处理20盆。栽植前将连作土与不同形态氮肥充分混匀。
1.2 测定指标
叶片光合参数:于8月14日上午10时左右选取3株长势一致植株的健康功能叶(自上向下第3~5片展开叶),采用CIRAS-3便携式光合仪(PP System,英国)测定净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(E)等。
幼苗生物量:于8月15日选择长势一致的植株并完整地从盆中取出,各处理均取3株,取出后将根系清洗干净后,用常规方法测定苗木株高、地径和干鲜重。
根系呼吸速率:于8月15日取幼苗根系上的新鲜白根,采用Oxytherm氧电极(Hansatech公司,英国)测定根系呼吸速率,参照毛志泉等[21]的方法。
实时荧光定量(qPCR):取0.5g过筛的新鲜土壤,按E.Z.N.A.®土壤DNA提取试剂盒提取DNA,采用CFX96TMThermal Cycler(Bio-Rad)对土壤中尖孢镰孢菌的基因拷贝数进行实时荧光定量分析,参照李家家等[22]的方法。
末端限制性片段长度多态性(terminal restriction fragment length polymorphism,T-RFLP)技术分析:提取土壤总DNA后,用真菌ITS区通用片段引物(ITS1-F和ITS4)进行扩增,用限制性内切酶Hha I对PCR产物酶切,将酶切产物送至生工生物工程(上海)股份公司进行测序,采用SPSS19.0软件对测序结果进行真菌群落聚类分析和主成分分析,参照尹承苗等[23]的方法。
1.3 数据处理
试验数据采用Microsoft Excel2003和SPSS19.0软件进行计算、作图和差异显著性分析。

表1 不同形态氮对平邑甜茶幼苗生物量的影响Table 1 Effects of different forms of nitrogen on plant biomass and growth of Malus hupehensis Rehd. seedlings
2 结果与分析
2.1 不同形态氮对平邑甜茶幼苗生物量的影响
由表1看出,铵态氮和酰胺态氮均能明显提高连作条件下平邑甜茶幼苗的生物量,其中铵态氮处理的株高、地径、鲜重、干重都有所增加,与连作土对照(CK1)相比分别提高了35.3%、24.4%、42.0%、57.7%;酰胺态氮处理与CK1相比分别提高了33.1%、26.5%、46.0%、58.0%。而硝态氮处理的株高虽与CK1相比达显著性差异,但地径、鲜重、干重3项指标与CK1没有显著性差异,铵态氮处理与酰胺态氮处理没有显著性差异;添加不同形态氮素后相对于CK1其生物量均有所提高,但未达到溴甲烷熏蒸(CK2)处理的效果。
2.2 不同形态氮对平邑甜茶幼苗叶片光合参数的影响
由图1可以看出,溴甲烷熏蒸(CK2)能够明显地提高平邑甜茶幼苗的净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(E),添加不同形态氮素后均可提高平邑甜茶幼苗叶片Pn和Gs,铵态氮、硝态氮和酰胺态氮处理的Pn分别比连作土对照(CK1)提高了27.6%、17.9%、21.1%,Gs分别提高了35.6%、23.8%、33.0%;不同形态氮素处理的蒸腾速率(E)均比CK1高,但不同处理之间未达显著性差异;不同形态氮处理胞间CO2浓度(Ci)与CK1和CK2相比未达显著性差异。
2.3 不同形态氮对平邑甜茶幼苗根系呼吸速率的影响
图2显示,铵态氮、硝态氮、酰胺态氮处理均能提高平邑甜茶幼苗的根系呼吸速率,与连作土对照(CK1)相比均达到显著性差异,分别比CK1提高了43.3%、28.1%、34.2%,其中铵态氮处理效果最明显;溴甲烷熏蒸(CK2)能够有效地提高平邑甜茶幼苗根系呼吸速率,添加3种氮素后平邑甜茶幼苗的根系呼吸速率均与其达到显著性差异。
2.4 不同形态氮对连作土壤真菌的实时荧光定量分析
通过实时荧光定量PCR分析了土壤中尖孢镰孢菌的基因拷贝数。从图3可以看出,连作土对照(CK1)的尖孢镰孢菌拷贝数最高,溴甲烷灭菌(CK2)的拷贝数最低,CK2与CK1相比降低了52.6%;铵态氮处理有效地降低了尖孢镰孢菌的基因拷贝数,降低了41.3%,与CK2相比未达显著性差异,说明铵态氮的加入能够有效地抑制尖孢镰孢菌的生长,减少尖孢镰孢菌的数量;硝态氮处理后尖孢镰孢菌的拷贝数有小幅升高,酰胺态氮处理的拷贝数有所降低,但两者与CK1没有显著性差异。

图1 不同形态氮对平邑甜茶幼苗叶片净光合速率、胞间 CO2浓度、气孔导度和蒸腾速率的影响Fig. 1 Effects of different nitrogen forms on the net photosynthetic rate, intercellular carbon dioxide concentration, stomatal conductance and transpiration rate in leaves of Malus hpehensis Rehd. seedlings
2.5 不同形态氮对连作土壤真菌的 T-RFLP 分析
由主成分分析(图4)和聚类分析(图5)可以看出,添加不同形态的氮素对苹果连作土真菌群落结构的影响不同。结果显示,第一主成分方差贡献率为82.9%,第二主成分方差贡献率为12.9%,两者贡献之和为95.8%,可以代表整个土壤系统状况(图4)。铵态氮和酰胺态氮处理后的真菌群落结构与连作土对照(CK1)有明显差异,其中铵态氮处理与溴甲烷灭菌(CK2)的真菌群落结构相近(图5),相似度达0.975~0.989(表2),而酰胺态氮处理则形成一个独立的真菌群落(图5),说明铵态氮处理与溴甲烷灭菌(CK2)对真菌群落结构的作用机理有一定的相似性;硝态氮处理的真菌群落结构与连作土对照(CK1)较相似(图5),相似度为0.897~0.920(表2),可能是硝态氮的加入为土壤中的真菌提供营养,增加了真菌的数量。

图2 不同处理对平邑甜茶幼苗根系呼吸速率的影响Fig. 2 Effects of different treatments on the root respiration rate of Malus hupehensis Rehd. seedlings
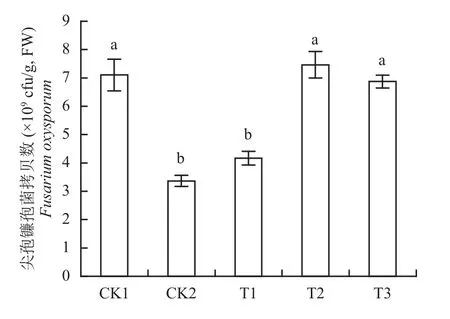
图3 不同处理对尖孢镰孢菌的实时荧光定量分析Fig. 3 Real-time quantitative analysis of Fusarium oxysporum under different treatments

图4 不同处理间 T-RFLP 图谱的主成分分析Fig. 4 Principle component analysis for T-RFLP patterns of different treatments

图5 不同处理间 T-RFLP 图谱的聚类分析Fig. 5 Cluster analysis of T-RFLP patterns of different treatments
3 讨论
铵态氮(NH4+)和硝态氮(NO3–)是植物根系吸收利用的主要氮素形态,根系吸收NO3–后,经氮同化将NO3–还原为NH4+加以利用,而尿素可直接被植物根系吸收,一般认为苹果是喜硝植物,无论是春施还是夏施其植株氮吸收量均是NO3–-N多于NH4+-N[24],这与本研究的结果相反。本试验中,在连作土壤中施入适量的铵态氮和酰胺态氮后,可显著增加平邑甜茶的生物量并提高根系呼吸速率,增强平邑甜茶幼苗抗性,但两者在生物量指标上并未达显著性差异,而施入硝态氮后生物量指标并未与连作土对照形成显著性差异。说明在连作条件下,氮素营养通过影响土壤环境来调控植物生长的作用大于植物直接从土壤中吸收氮素营养作用。
植物通过光合作用利用光能进行物质同化形成干物质,是植物生长发育的重要生理过程,而逆境胁迫会引起膜质过氧化,破坏类囊体内膜结构,降低叶绿素含量,导致光合速率下降[25]。陈贵等[26]研究发现,逆境条件下,NH4+-N营养供给对作物光合效率的抑制效应小于供给NO3–-N,本研究也有类似发现。在本研究中,连作(逆境)条件下,铵态氮处理的平邑甜茶幼苗净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(E)均比连作土对照(CK1)高,但处理之间的胞间CO2浓度没有达到显著性差异。有研究表明,在自然光和弱光两种光照条件下,无论是否进行胁迫,铵态氮营养下的植株单位面积净光合速率均高于硝态氮[27]。幼苗光合速率的增加有利于植物生长发育,促进植株叶片叶绿素合成,提高植物同化速率,说明铵态氮能够缓解连作(逆境)条件对平邑甜茶幼苗光合作用的抑制。

表2 不同处理间相似系数Table 2 The similarity coefficient of different treatments
植物根系是地下部代谢的中心,植物根系通过呼吸作用为植物生长发育提供能量,同时又通过消耗叶片光合作用产生的同化物质来带动整个植株的代谢,根系呼吸速率的强弱是植物根系功能和抵御逆境胁迫的重要指标之一[28]。大多数研究表明,氮作为植物生长发育的必需元素,有维持根系呼吸的作用,根系组织的氮浓度越高,根系呼吸速率越强[29–30]。本研究中,不同形态氮素的添加均可不同程度地提高平邑甜茶幼苗的根系呼吸速率,其中铵态氮处理的效果最为明显,酰胺态氮次之。根系呼吸速率的增加,有助于促进根系对营养物质的吸收,刺激根系生长,增加植株生长量,提高平邑甜茶幼苗抗逆性来缓解连作障碍对植株的胁迫;同时铵态氮的施入在促进根系生长的同时,也会影响植株根系分泌物的种类或数量,从而影响根际微生物的生长环境,使微生物群落结构得到改善,进而减轻苹果连作障碍,关于植物根系分泌物与土壤微生物的互作机理还需进行深入研究。
长期连作会降低有益微生物数量,增加有害真菌数量,导致土壤微生物群落结构的改变[31–32],而有害真菌数量的增加是造成连作障碍的主要原因[33–34]。Marschner等[35]采用PCR-DGGE技术研究了不同施肥方式对土壤微生物群落结构的影响,结果表明,长期施肥显著改变了土壤微生物的群落结构。本研究采用实时荧光定量PCR和末端限制性片段长度多态性技术(T-RFLP)研究了不同形态氮对连作土壤尖孢镰孢菌及微生物群落结构的影响,运用聚类分析和主成分分析比较了添加不同形态氮后连作土壤中的真菌群落结构的差异。结果表明,加入铵态氮后能够明显改变土壤真菌群落结构,尖孢镰孢菌基因拷贝数明显降低,张茂星等在研究香蕉枯萎病时也有类似结果[36],这可能是植物在吸收NH4+的同时会使土壤酸化,而有害真菌(尖孢镰孢菌)在pH6~7生长最快[37],有害真菌的减少使土壤趋于细菌化,改变土壤真菌群落结构。也有研究表明,在铵态氮作为氮源时尖孢镰孢菌不能穿透根系细胞壁进入根系组织[38],即也有可能是土壤中铵态氮的加入能够直接影响微生物,抑制其菌丝生长,这方面还需进一步研究证实。加入硝态氮的土壤真菌群落结构则与连作土对照相近,相似度为0.897~0.920,可能是因为硝态氮的加入使有害真菌获得养分,促使有害真菌的大量增殖,使土壤微生物结构类型趋于真菌化。加入酰胺态氮后,土壤真菌群落结构发生了很大的变化,形成单独的群落,可能是因为植物根际氮水平的提高,促进了植株根系的生长,根系分泌物质如酚酸、有机酸、生物碱等增多,进而导致根际土壤环境的改变(如土壤pH)[39],土壤真菌微生物群落结构也随之改变,也可能是氮肥的加入直接诱导了土壤中某些微生物的生长繁殖,其机理需进一步研究验证。植物与土壤养分具有相辅相成的作用,连作土壤中氮素的加入可以影响植物根系的生长发育和分泌特性,改变植物根际有害真菌数量以及微生物种群结构与功能[40],或氮形态通过直接影响根系某些基因的表达,从而影响根系代谢水平以及整个植株的生长发育,亦或影响到土壤中微生物体内某些基因表达导致植物根际有害真菌数量以及微生物种群结构与功能的改变[20],氮形态如何与微生物互作的具体机理还需深入研究。
4 结论
添加适量的铵态氮能够提高平邑甜茶幼苗生物量,调节根际环境,影响病原菌生长,并可改变土壤微生物群落结构,因此在连作土壤中添加适宜含量的铵态氮可作为苹果连作障碍的防治措施,但其并未达到溴甲烷熏蒸的防治效果,不可直接作为溴甲烷替代品,今后还需结合其他防治措施进行更深入研究。
[1]Liu ET,Wang GS,Li YY,et al.Replanting affects the tree growth and fruit quality of gala apple[J].Journal of Integrative Agriculture, 2014,13(8):1699–1706.
[2]Mazzola M,Manici LM.Apple replant disease:role of microbial ecology in cause and control[J].Annual Review of Phytopathology, 2012,50:45–65.
[3]Tewoldemedhin TY,Mazzola M,Mostert L,et al.Cylindrocarpon speces associated with apple tree roots in South Africa and their quantification using real-time PCR[J].European Journal of Plant Paithology,2011,129(4):637–651.
[4]孙海兵,毛志泉,朱树华.环渤海湾地区连作苹果园土壤中酚酸类物质变化[J].生态学报,2011,31(1):90–97. Sun HB,Mao ZQ,Zhu SH.Changes of phenolic acids in the soil of replanted apple orchards surrounding Bohai Gulf[J].Acta Ecologica Sinica,2011,31(1):90–97.
[5]Dullahide SR,Stirling GR,Nikulin A,et al.The role of nematodes, fungi,bacteria,and abiotic factors in the etiology of apple replant problems in the Granite Belt of Queensland[J].Australian Journal of Experimental Agriculture,1994,34(8):1177–1182.
[6]Mazzola M.Elucidation of the microbial complex having acausal role in the development of apple replant disease in Washington[J]. Phytopathology,1998,88(9):930–938.
[7]Van Schoor L,Denman S,Cook NC.Characterisation of apple replant disease under South African conditions and biological management strategies[J].Scientia Horticulturae,2009,19(2): 153–162.
[8]相立,徐少卓,王功帅,等.微酸性电解水对苹果连作土壤环境的影响[J].园艺学报,2016,43(7):1236–1244. Xiang L,Xu SZ,Wang GS,et al.Effects of slightly acid electrolyzed oxidizing water on apple replanted soil environment[J]. Acta Horticulturae Sinica,2016,43(7):1236–1244.
[9]Tewoldemedhin YT,Mazzola M,Botha WJ,et al.Characterization of fungi(Fusarium arrd Rhizoctonia)and oomycetes(Phytophthora and Pythium)associated with apple orchards in South Africa[J]. European Journal of Plant Pathology,2011,130(2):215–229.
[10]Cao Y,Zhang Z,Ling N,et al.Bacillus subtilis SQR9can control Fusarium wilt in cucumber by colonizing plant roots[J].Biology and Fertility of Soils,2011,47(5):495–506.
[11]Zhao S,Du CM,Tian CY.Suppression of Fusarium oxysporum and induced resistance of plants involved in the biocontrol of Cucumber Fusarium Wilt by Streptomyces bikiniensis HD-087[J].World Journal of Microbiology and Biotechnology,2012,28(9):2919–2927.
[12]Qiu M,Zhang R,Xue C,et al.Application of bio-organic fertilizer can control Fusarium wilt of cucumber plants by regulating microbial community of rhizosphere soil[J].Biology and Fertility of Soils, 2012,48(7):807–816.
[13]曹坳程,张文吉,刘建华.溴甲烷土壤消毒替代技术研究进展[J].植物保护,2007,33(1):15–20. Cao AC,Zhang WJ,Liu JH.Progress in the alternatives to methy1 bromide in soil disinfestation[J].Plant Protection,2007,33(1): 15–20.
[14]巨晓棠,谷保静.我国农田氮肥施用现状、问题及趋势[J].植物营养与肥料学报,2014,20(4):783–795. Ju XT,Gu BJ.Status-quo,problem and trend of nitrogen fertilization in China[J].Journal of Plant Nutrition and Fertilizer, 2014,20(4):783–795.
[15]Huber DM,Watson RD.Nitrogen form and plant disease[J].Annual Review of Phytopathology,1974,12(1):139–165.
[16]Taylor RG,Jackson TL,Powelson RL,et al.Chloride,nitrogen form,lime,and planting date effects on take-all root rot of winter wheat[J].Plant Disease,1983,67(10):1116–1120.
[17]王敏.土传黄瓜枯萎病致病生理机制及其与氮素营养关系研究[D].南京:南京农业大学博士论文,2013. Wang M.Study on physiological mechanisms of soil-borne disease of cucumber Fusarium wilt and the relationships with nitrogen nutrition [D].Nanjing:PhD Dissertation of Nanjing Agricultural University, 2013.
[18]刘庆城,许玉兰.液氨施肥防治作物土传病害的研究[J].中国农业科学,1986,19(1):29–32. Liu QC,Xu YL.Study on ammonia fertilizer control of soil-borne diseases of crops[J].Scientia Agricultura Sinica,1986,19(1):29–32.
[19]Janvier C,Villenenve F,Alabouvette C,et al.Soil health through soildisease suppression which strategy from descriptors to indication[J]. Soil Biology and Biochemistry,2007,39(1):1–23.
[20]Snoeijers SS,Pérez-García A,Joosten MH AJ,et al.The effect of nitrogen on disease development and gene expression in bacterial and fungal plant pathogens[J].European Journal of Plant Pathology, 2000,106(6):493–506.
[21]毛志泉,王丽琴,沈向,等.有机物料对平邑甜茶实生苗根系呼吸强度的影响[J].植物营养与肥料学报,2004,10(2):171–175. Mao ZQ,Wang LQ,Shen X,et al.Effect of organic materials on respiration intensity of annual Malus.hupehensis Rehd.root system[J].Plant Nutrition and Fertilizer Science,2004,10(2): 171–175.
[22]李家家,相立,潘凤兵,等.平邑甜茶幼苗与葱混作对苹果连作土壤环境的影响[J].园艺学报,2016,43(10):1853–1862. Li JJ,Xiang L,Pan FB,et al.Effects of Malus hupehensis seedlings and Allium fistulosum mixed cropping on replanted soil environment[J].Acta Horticulturae Sinica,2016,43(10):1853–1862.
[23]尹承苗,王功帅,李园园,等.连作苹果园土壤真菌的T-RFLP分析[J].生态学报,2014,34(4):837–846. Yin CM,Wang GS,Li YY,et al.Assessment of fungal diversity in apple replanted orchard soils by T-RFLP analysis[J].Acta Ecologica Sinica,2014,34(4):837–846.
[24]顾曼如,束怀瑞,张若杼,等.苹果氮素营养研究初报-植株中氮素营养的变化特性[J].园艺学报,1981,(4):21–28. Gu MR,Shu HR,Zhang RZ,et al.A study on the nitrogen nutrition of apple tree-The variation of nitrogen nutrition within the plant in a year’s cycle[J].Acta Horticulturae Sinica,1981(4):21–28.
[25]尹承苗,张先富,胡艳丽,等.不同浓度有机物料发酵流体对连作苹果幼树叶片光合荧光参数和根系抗氧化酶活性的影响[J].中国农业科学,2014,47(9):1847–1857. Yin CM,Zhang XF,Hu YL,et al.Effect of different concentrations of organic matter fermentation fluid on the young apple tree leaf photosynthesis fluorescent parameters and root antioxidant activity under replant conditions[J].Scientia Agricultura Sinica,2014,47(9): 1847–1857.
[26]陈贵,周毅,郭世伟,等.水分胁迫条件下不同形态氮素营养对水稻叶片光合效率的调控机理研究[J].中国农业科学,2007,40(10): 2162–2168. Chen G,Zhou Y,Guo SW,et al.The regulatory mechanism of different nitrogen form on photosynthetic efficiency of rice plants under water stress[J].Scientia Agricultura Sinica,2007,40(10): 2162–2168.
[27]Guo SW,Zhou Y,Gao YX,et al.New insights into the nitrogen form effect on photosynthesis and photorespiration[J].Pedosphere, 2007,17(5):601–610.
[28]李志霞,秦嗣军,吕德国,等.植物根系呼吸代谢及影响根系呼吸的环境因子研究进展[J].植物生理学报,2011,47(10):957–966. Li ZX,Qin SJ,LüD G,et al.Research progress in root respiratory metabolism of plant and the environmental influencing factors[J]. Plant Physiology Journal,2011,47(10):957–966.
[29]Burton AJ,Pregitzer KS,Ruess RW.Root respiration in North American forest:effects of nitrogen concentration and temperature across biomes[J].Oecologia,2002,131(4):559–568.
[30]Desrochers A,Landhäusser SM,Lieffers VJ.Coarse and fine root respiration in aspen(Papulus tremuloides)[J].Tree Physiology,2002, 22(10):725–732.
[31]Yim B,Smalla K,Winkelmann T.Evaluation of apple replant problems based on different soil disinfection treatments—links to soil microbial community structure[J].Plant and Soil,2013,366(1–2): 617–631.
[32]Zhang Y,Fan T,Jia W,et al.Identification and characterization of a Bacillus subtilis strain TS06as bio-control agent of strawberry replant disease(Fusarium and Verticilium wilts)[J].African Journal of Biotechnology,2012,11(3):570–580.
[33]徐文凤.环渤海湾地区重茬苹果园土壤真菌群落多样性及生防真菌的筛选[D].泰安:山东农业大学硕士论文,2011. Xu WF.Diversity analysis of soil fungi from Bohai Bay apple replanted orchard and the screening of the antagonistic fungi[D]. Tai'an:MS Thesis of Shandong Agricultural University,2011.
[34]Ju R,Zhao Y,Li J,et al.Identification and evaluation of apotential biocontrol agent,Bacillus subtilis,against Fusarium sp.in apple seedlings[J].Annals of Microbiology,2014,64(1):377–383.
[35]Marschner P,Kandeler E,Marschner B.Structure and function of the soil microbial community in along-term fertilizer experiment[J].Soil Biology and Biochemistry,2003,35(3):453–461.
[36]张茂星,张明超,陈鹏,等.硝/铵营养对香蕉生长及其枯萎病发生的影响[J].植物营养与肥料学报,2013,19(5):1241–1247. Zhang MX,Zhang MC,Chen P,et al.Influence of nitrate/ammonium ratio on the plant growth of banana and related wilt disease development[J].Journal of Plant Nutrition and Fertilizer, 2013,19(5):1241–1247.
[37]林妃,高剑,曾会才,等.海南省香蕉枯萎病病原菌的分离鉴定及1号4号小种的生物学特性[J].基因组学与应用生物学,2010, 29(2):314–321. Lin F,Gao J,Zeng HC,et al.Isolation and identification of banana vasicular wilt in Hainan Province and determination of biological characteristics of strains Focr1and Focr4[J].Genomics and Applied Biology,2010,29(2):314–321.
[38]张茂星,陈鹏,张明超,等.硝/铵营养对香蕉枯萎病尖孢镰刀菌生长的影响[J].植物营养与肥料学报,2013,19(1):232–238. Zhang MX,Chen P,Zhang MC,et al.Influence of nitrate/ammonium on Fusarium oxysporum f.sp.cubense of banana wilt disease[J].Plant Nutrition and Fertilizer Science,2013,19(1): 232–238.
[39]罗燕,樊卫国.不同施磷水平下4种柑橘砧木的根际土壤有机酸、微生物及酶活性[J].中国农业科学,2014,47(5):955–967. Luo Y,Fan WG.Organic acid content,microbial quantity and enzyme activity in rhizosphere soil of four citrus rootstocks under different phosphorus levels[J].Scientia Agricultura Sinica,2014, 47(5):955–967.
[40]王富林,周乐,李洪娜,等.不同氮磷配比对富士苹果幼树生长及15N-尿素吸收、分配与利用的影响[J].植物营养与肥料学报,2013, 19(5):1102–1108. Wang FL,Zhou L,Li HN,et al.Effect of N,P ratios on the growth and absorption,distribution and utilization of15N-urea of Fuji apple saplings[J].Journal of Plant Nutrition and Fertilizer,2013,19(5): 1102–1108.
Effects of different nitrogen forms on the growth of replanted apple rootstock (Malus hupehensis Rehd.) seedlings and Fusarium oxysporum population in soil
WANG Mei1,DUAN Ya-nan1,SUN Shen-yi2,XIANG Li1,WANG Gong-shuai1,CHEN Xue-sen1,SHEN Xiang1,YIN Cheng-miao1*,MAO Zhi-quan1*
(1 College of Horticulture Science and Engineering, Shandong Agricultural University /State Key Laboratory of Crop Biology, Tai’an Shandong 271018, China; 2 Zhaoyuan Fruit Station, Zhaoyuan Shandong 265400, China)
【Objectives】To provide atheoretical basis for reasonably applying fertilizers and alleviating the growth obstacles of replanted apple,a pot experiment was conducted to study effects of different nitrogen forms on growth of apple rootstock(Malus hupehensis Rehd.)seedlings and the replanted soil microorganisms.【Methods】The experiment was carried out in2015.M. hupehensis Rehd.Seedling was used in this study,and the biomass,photosynthetic parameters and soil microorganisms were determined in August2015.Three N fertilizer treatments were designed as follows:ammonium nitrogen(T1),nitrate nitrogen(T2)and amide nitrogen (T3)(N180mg/L),and took the apple replanted orchard soil(CK1)and methyl bromide fumigation(CK2)as thecontrol.M. hupehensis Rehd.seedlings were planted in pots with different treatments.【Results】Compared with the replanted soil control(CK1),the biomass amounts of M. hupehensis Rehd.seedlings were significantly improved with the ammonium nitrogen(T1)and amide nitrogen(T3).The plant height,ground diameter,fresh weight and dry weight of the ammonium nitrogen(T1)were increased by35.3%,24.4%,42.0%,57.7%.Different nitrogen forms could increase the net photosynthesis stomatal conductance and root respiration rate.The net photosynthetic rate,stomatal conductance in leaves of the seedlings and root respiration rate of ammonium nitrogen of T1were increased by27.6%,35.6%and43.3%compared with CK1,respectively,but they did not reach the highest effect of the methyl bromide fumigation(CK2).Real-time quantitative PCR results showed that the ammonium nitrogen(T1)effectively reduced the gene copy number of Fusarium oxysporum,which was decreased by41.3%compared with the replanted soil control(CK1).The copy numbers of the nitrate nitrogen (T2)and amide nitrogen(T3)had no significant differences with the soil control(CK1).T-RFLP results showed that soil fungal community structure was changed by the ammonium nitrogen(T1)and amide nitrogen(T3) greatly,the fungal community structure in the ammonium nitrogen(T1)was similar to that in the methyl bromide fumigation(CK2),and the structure of the nitrate nitrogen(T2)was similar to that in the soil control(CK1),while an independent fungal community was formed in the amide nitrogen(T3).【Conclusions】Ammonium nitrogen greatly improved the biomass of M. hupehensis Rehd.seedlings,net photosynthetic rate and root respiration rate, reduced the gene copy number of Fusarium oxysporum,and changed the community structure of soil fungi. Therefore,the appropriate dosages of ammonium nitrogen could be used as ameasure to reduce the apple replanted disease.
Malus hupehensis Rehd.;apple replant disease;nitrogen form;photosynthetic parameter; soil Fusarium oxysporum
2016–12–01接受日期:2017–02–27
现代农业产业技术体系建设专项资金项目(CARS-28);山东省自然科学基金资助项目(ZR2014CL024);国家自然科学基金项目(31501720,31672104);国家重点研发计划项目(2016YFD0201114);山东省水果创新团队项目(SDAIT-06-07)资助。
王玫(1992—),女,山西省山阴县人,硕士研究生,主要从事果园土壤环境调控方面的研究。E-mail:694735910@qq.com *通信作者E-mail:yinchengmiao@163.com;Tel:0538-8241984,E-mail:mzhiquan@sdau.edu.cn

