内生真菌β-D-葡萄糖醛酸苷酶固定化及其性质研究
闫宜江,肖依文,汪涯,吴文婷,常军,何巧璇,朱笃,2
1 (江西科技师范大学 生命科学学院,江西省生物加工过程重点实验室,江西 南昌, 330013) 2 (江西师范大学 生命科学学院, 江西省亚热带植物资源保护与利用重点实验室,江西 南昌, 330022) 3 (中国成达工程有限公司,四川 成都, 610041)
研究报告
内生真菌β-D-葡萄糖醛酸苷酶固定化及其性质研究
闫宜江1,肖依文1,汪涯1,吴文婷1,常军1,何巧璇3,朱笃1,2
1 (江西科技师范大学 生命科学学院,江西省生物加工过程重点实验室,江西 南昌, 330013) 2 (江西师范大学 生命科学学院, 江西省亚热带植物资源保护与利用重点实验室,江西 南昌, 330022) 3 (中国成达工程有限公司,四川 成都, 610041)
以海藻酸钠为载体、戊二醛为交联剂,对内生真菌ChaetomiumglobosumS108的高选择性β-D-葡萄糖醛酸苷酶的固定化及部分特性进行了研究。结果表明:β-D-葡萄糖醛酸苷酶的最佳固定化条件为海藻酸钠1.5%、戊二醛1.5%、添加酶量3 500 U、CaCl2浓度2%,交联时间30 min。β-D-葡萄糖醛酸苷酶固定化后,其最适温度提高5 ℃,最佳pH值由6.0~6.8拓展为5.2~7.6,热稳定性和pH 稳定性明显改善;米氏常数(Km)明显增大,而最大反应初速度(Vmax)明显减小。固定化酶重复操作15 次,其相对酶活仍保持71%。
海藻酸钠; β-D-葡萄糖醛酸苷酶; 甘草酸; 固定化; 内生真菌
甘草酸(glycyrrhizin,GL)是传统中药材甘草(GlycyrrhizauralensisFisch)的主要药效成分[1-2],具有抑菌、消炎、抗病毒、抑制肿瘤等活性[3]。由于GL的甜度是蔗糖的80~100倍,也被广泛应用于食品甜味添加剂[4]。单葡萄糖醛酸甘草次酸(glycyrrhetic acid mono-β-D-glucuronide,GAMG)是甘草酸末端水解1个葡萄糖醛酸后的产物(图1)。
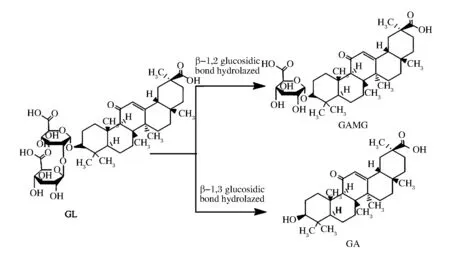
图1 甘草酸及其衍生物转化Fig.1 Transformation of glycyrrhizin into its derivatives
与GL相比,GAMG更易进入人体血液循环,具有更好的生物活性和更低的副作用[5]。此外,GAMG较之GL甜度更高,为蔗糖的1 000倍[6],因此具有更为广阔的应用前景。现有研究表明,采用化学法水解合成GAMG较为困难,这是由于转化过程中GL所含的2分子葡萄糖醛酸极易无选择性地水解生成甘草次酸(Glycyrrhetinic acid,GA)[7-9]。酶由于其反应条件温和且选择性高,可专一性地催化转化GL生成GAMG而成为一条最为有效的途径[5,9]。基于此,筛选高效率、高选择性的β-D-葡萄糖醛酸苷酶成为高效合成GAMG的关键。
植物内生菌是存活于植物体内而不引起宿主植物发生病害的一类微生物[10]。植物内生真菌生物多样性丰富,成为一种亟待开发的微生物资源宝库。内生真菌在适应植物内生特殊生境过程中,通过合成淀粉酶、蛋白酶、脂肪酶、漆酶、纤维素酶、果胶酶等水解酶,以保证其侵入植物组织并维持其生存。由于植物内生真菌含有丰富的酶系,使其成为亟待开发的生物催化剂资源宝库[10]。因此,我们推测植物内生真菌可作为高效和高选择性酶的筛选对象。为了验证此设想,以可专一性转化GL为GAMG的β-D-葡萄糖醛酸苷酶为筛选对象,利用前期建立的东乡野生稻内生真菌资源库,开展了具专一性转化能力的内生真菌筛选。研究发现,我们的筛选结果与设想完全一致,从东乡野生稻内生真菌中筛选到产β-D-葡萄糖醛酸苷酶真菌的概率远大于土壤。东乡野生稻内生真菌ChaetomiumglobosumS108 是其中筛选到的1株具高效转化能力的真菌,从该菌中分离到的β-D-葡萄糖醛酸苷酶粗酶,能高选择性地水解GL生成GAMG,且没有副产物生成[11]。
迄今,人们已开展了产β-D-葡萄糖醛酸苷酶微生物的筛选,分别从人体肠道和土壤中筛选到Eubacteriumsp.[12]、CryptococcusmagnusMg-27[13]、Aspergillusterreus[14]和PenicilliumpurpurogenumLi-3[15]等微生物,可转化GL生成GAMG。有关β-D-葡萄糖醛酸苷酶的固定化研究也有少量报道,如李春[16-18]等先后采用甲壳素、膨润土和海藻酸钠作为载体,李林[19]以仿生氧化硅凝胶为载体,开展了β-D-葡萄糖醛酸苷酶的固定化研究,β-D-葡萄糖醛酸苷酶经固定后稳定性获得显著提高。为了简化酶在反应体系中的分离工艺,提高酶的可重复性,提高酶的热稳定性和pH稳定性,本文开展了C.globosumS108的β-D-葡萄糖醛酸苷酶固定化研究,并对其酶学性质和动力学参数进行比较分析。
1 材料与方法
1.1材料与试剂
内生真菌C.globosumS108由本实验室从东乡野生稻中分离获得,保藏于江西省亚热带植物资源保护与利用重点实验室。GL(≥99%)、GA(≥99%)、D-葡萄糖醛酸均购自阿拉丁试剂公司。GAMG(≥98%)由本实验室自行分离制备,并进行了光谱学鉴定。海藻酸钠、戊二醛、氯化钙、甲醇、醋酸及其他实验室常用试剂均为国产分析纯。
1.2仪器与设备
超高效液相色谱仪UPLC,美国Waters公司;RCT Basic磁力搅拌器,德国IKA公司;恒温振荡水浴锅,苏州威尔公司;Sorvall Evolution RC离心机,德国Thermo Fisher公司;AKTA purifier UPC10蛋白纯化仪,美国GE公司;Lamda365紫外分光光度计,日本爱朗公司。
1.3实验方法
1.3.1 粗酶液的制备
用接种环挑取1环斜面菌种,在无菌条件下接入PDB培养基中,28 ℃、120 r/min条件下培养5 d后,加入过滤灭菌后的GL进行产酶诱导,4 d后离心去除菌体并收集发酵液。在发酵液中逐级加入25%、55%、75%(NH4)2SO4进行分级沉淀,取75%(NH4)2SO4处理后的液体,15 000 r/min离心,收集沉淀。沉淀用0.02 mol/L的pH 6.0的醋酸-醋酸铵缓冲液溶解后经过G-25葡聚糖柱脱盐,脱盐蛋白再以0.02 mol/L的 pH 8.0的Tris-HCl缓冲液过DEAE-纤维素 DE-52阴离子交换层析,除去部分杂蛋白将蛋白溶液进行初步纯化,超滤离心进行浓缩,获得较纯的β-D-葡萄糖醛酸苷酶粗酶,用0.02 mol/L的pH 6.0的醋酸-醋酸铵缓冲液溶解,4 ℃保存备用。
1.3.2 固定化酶凝胶颗粒的制备
预先配制4%的海藻酸钠溶液,冷却至室温,稀释至不同浓度备用。选择1 mL不同浓度的海藻酸钠溶液,与200 μL酶液混合均匀后,加入体积分数2%的戊二醛,搅拌均匀,室温下静置30 min。再用1 mL注射器(12号针头)吸取0.5 mL均匀的滴入到含有2% CaCl2溶液的烧杯中。摇晃10 min充分凝结,取出凝胶珠,用0.02 mol/L的pH 6.0的醋酸-醋酸铵缓冲液冲洗3次后,4℃保存备用。
1.3.3 GL及GAMG的UPLC测定
GL和GAMG分析采用UPLC方法测定,色谱条件为:C18色谱柱(5 μm, 4.6 mm×150 mm),流动相为V(甲醇)∶V(酸水)(0.5%醋酸)=8∶2,进样量10 μL,流速1 mL/min,254 nm检测吸收峰。
1.3.4 酶活力检测
采用UPLC检测产物生成量来定义酶活力。取100 μL酶液或相应固定化酶与900 μL的2 mg/mL甘草酸反应30 min后,沸水浴5 min灭活,采用超高效液相色谱检测产物变化来检测β-D-葡萄糖醛酸苷酶的活性。
1个酶活单位(U)定义:在测定条件下,每分钟生成1 mmol的GAMG的量[20]。
(1)
(2)
相对酶活:在检测影响酶活条件时,将未经处理或者酶活最高的酶活作为100%,其他酶活与其的比值即为相对酶活。
2 结果与讨论
2.1固定化条件的优化
2.1.1 海藻酸钠浓度对酶活的影响
为了减少酶活损失,尽可能多地固定β-D-葡萄糖醛酸苷酶,就需要加大海藻酸钠的浓度。但海藻酸钠浓度过高又会阻碍底物扩散,影响酶与底物间的有效接触,最终影响酶活和转化效率,因此必需考察合适的海藻酸钠浓度[21]。由图2可知,随着海藻酸钠浓度的增大,蛋白回收率变化不明显,但酶活回收率明显呈现先增大后减小趋势。当海藻酸钠浓度为1.5%时,固定化β-D-葡萄糖醛酸苷酶活力最高,且凝胶珠易成型,颗粒圆润,弹性和机械强度适中。

图2 海藻酸钠对固定化β-D-葡萄糖醛酸苷酶的蛋白和酶活回收率影响Fig.2 Effect of sodium alginate on protein recoveryt and enzymatic activity recovery of immobilized enzyme
2.1.2 戊二醛体积分数及交联时间对固定化酶活性的影响
戊二醛作为交联剂,通过共价结合能够使酶分子之间、酶与载体之间交联结合,增加酶的固定量,增强凝胶颗粒的稳定性,但这也会在一定程度上破坏酶的结构[22]。不同体积分数的戊二醛交联结果表明,适量地添加戊二醛有利于提高固定化酶的酶活,当戊二醛的体积分数为1.5%时,固定化酶的酶活最高,但戊二醛体积分数进一步提高,酶活开始下降(图3A)。戊二醛和酶的交联时间对酶活亦有明显影响,过度交联会破坏酶的结构,使酶失活[22]。
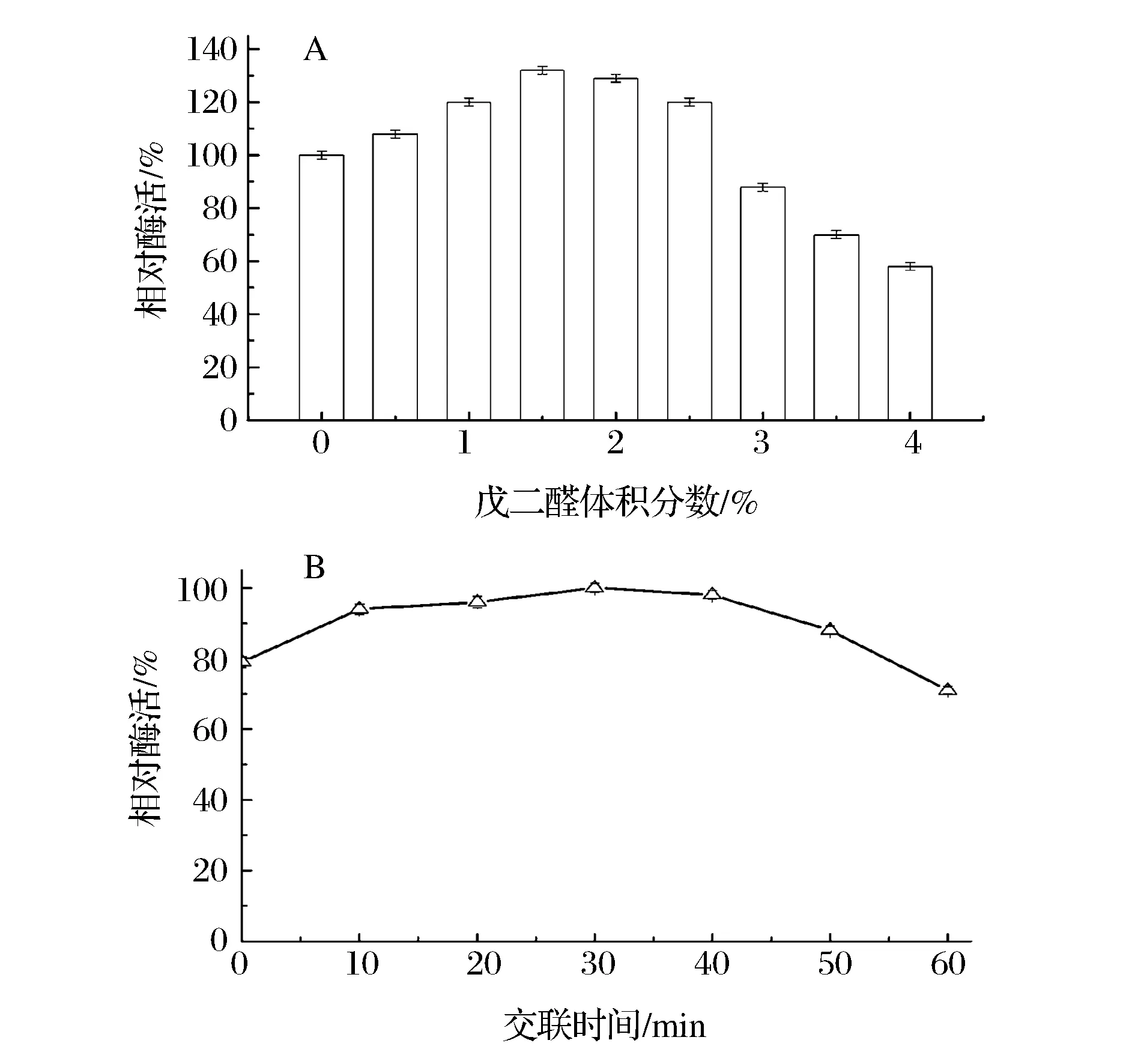
图3 戊二醛体积分数(A)及交联时间(B)对β-D-葡萄糖醛酸苷酶的活力影响Fig.3 Effect of the glutaraldehyde volume fraction (A) and crosslinking time (B) on the activity of immobilized enzyme
由图3B可知,随着交联时间的延长,固定化酶的酶活呈现先增加后降低的趋势,交联时间为30 min时酶活达到最大,通过SPSS软件显著性检测结果显示,交联时间为30 min时酶活与交联时间10 min和20 min相比,存在显著性差异。
2.1.3 CaCl2浓度对固定化酶活性的影响
CaCl2与海藻酸钠在液滴外面形成紧密膜,从而加速海藻酸钠凝胶凝固,使颗粒具有一定机械强度,并且使海藻酸钠在凝胶内部形成多孔结构。在CaCl2浓度较低时,凝胶交联度不够,酶易流失,且固定化珠子的机械强度较低。但CaCl2浓度过高时,固定化珠子形成的空间网状结构过于紧密,凝胶颗粒弹性减弱,从而影响底物分子的扩散及与酶的有效接触,降低酶的活力[22]。当CaCl2浓度在1.5%时,固定化酶的酶活最高,而且机械强度和弹性适中(图4)。

图4 CaCl2浓度对固定化β-D-葡萄糖醛酸苷酶的活力影响Fig.4 Effect of the concentration of CaCl2 on the activity of immobilized enzyme
2.1.4 酶添加量对固定化酶活的影响
固定化酶的活力取决于加入游离酶的量。一般而言,适量提高游离酶的量有利于提升固定化酶的活力,但过量地添加游离酶相应会使酶的固定化效率降低,造成不必要的资源浪费。由图5可知,当加入的β-D-葡萄糖醛酸苷酶小于 3 500 U时,随着游离酶添加量的增加,固定化酶的酶活力逐渐增大,但当酶量达到3 500 U以后,固定化酶的活力增加幅度明显减缓。为了避免造成酶的浪费,可以选择每1 mL海藻酸钠固定酶量在3 500 U以下。

图5 添加酶量对固定化酶活的影响Fig.5 Effect of the enzyme load on the activity of immobilized enzyme
2.2游离酶与固定化酶的酶学性质
2.2.1 游离酶与固定化酶催化反应进程
对游离酶和固定化酶催化GL合成GAMG的反应历程进行比较。结果表明:游离酶在180 min时反应达到平衡,而固定化酶需要270 min反应才基本达到平衡。游离酶在反应的前60 min内,其反应速率基本保持恒定;而固定化酶在反应的前40 min内,其反应速率基本恒定。所以,后续研究游离酶和固定化酶最大反应速率时,我们分别选取反应时间为50 min和30 min(图6)。通过固定化酶与游离酶反应速率的比较,初步可以看出游离酶要快于固定化酶,这表明酶的固定化对其活力造成一定影响。
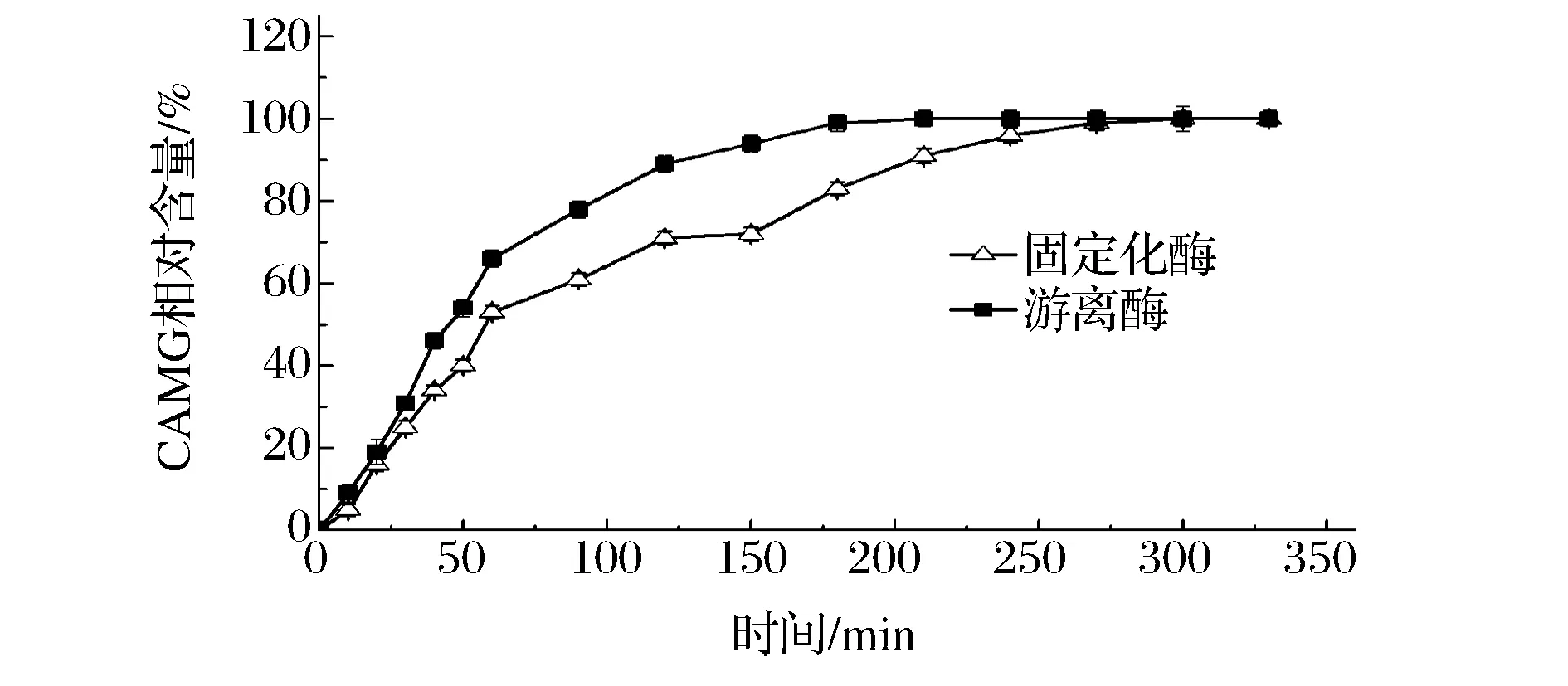
图6 酶催化生成GAMG的反应进程Fig.6 Catalytic reaction process of β-D-Glucuronidase
2.2.2 酶的最适反应温度及热稳定性
将酶促反应的温度分别设定为30~80 ℃,在pH 6.0条件下测定其酶活,以确定游离酶和固定化酶的最适反应温度。由图7A可知,随着温度的升高,无论是游离酶还是固定化酶,其酶活均出现先上升后下降的趋势,酶活下降的原因在于酶蛋白受热变性的影响超过升温加快反应速率的影响。游离酶的最适温度为45~50 ℃,而固定化酶最适温度为45~55oC,固定化酶较之游离酶的最适温度提高了5 ℃。
取适量的固定化酶和游离酶,分别在4~80 ℃温度下保存5 h,然后在45 ℃、pH 6.0条件下测定其酶活,考察游离酶和固定化酶的热稳定性。由图7B可知,固定化能有效提升β-D-葡萄糖醛酸苷酶的热稳定性。游离酶在4~80 ℃范围内,随着温度的升高,其活性不断下降,特别当温度超过50 ℃时酶活迅速下降;而固定化酶在4~45 ℃范围内,其活力较为稳定。这表明β-D-葡萄糖醛酸苷酶经固定化后,其热稳定性有了一定程度地提升。

图7 β-D-葡萄糖醛酸苷酶的最适温度(A)及热稳定性(B)Fig.7 Optimal temperature(A) and thermostability(B) of β-D-Glucuronidase
2.2.3 酶的最适pH及pH稳定性
在45 ℃的条件下,分别测定不同pH时游离酶和固定化酶的酶活,以确定其最适pH。由图8A可知,游离酶的最适pH为6.0~6.8,而固定化酶适合的pH明显变宽,在pH 5.2~7.6时相对活力基本保持在100%。

图8 β-D-葡萄糖醛酸苷酶的最适pH(A)及pH稳定性(B)Fig.8 Optimal temperature(A) and pH stability(B) of β-D-Glucuronidase
将游离酶和固定化酶分别在pH 2~9的缓冲液中保存5 h后,在45 ℃、pH 6.0的最适条件下检测酶活,以研究其pH稳定性。由图8B可知,游离酶在pH 4.0~6.8范围内较为稳定,而固定化酶的pH稳定性明显变宽,在pH 2.0~7.6范围内较为稳定,且在pH 4.0~6.8范围内酶活保持在90%以上。这表明,酶经固定化后,其pH稳定性明显增强。
2.2.4 游离酶和固定化酶动力学
测定不同底物浓度下的反应初速率,分别以1/[s]为横坐标,1/[v]为纵坐标作图,得反应初速率与底物浓度的Lineweaver-Burk双倒数拟合曲线。由图9可知,β-D-葡萄糖醛酸苷酶固定化前后Km分别为0.134 mmol/L和0.312 mmol/L,Vmax由2.92 mmol/(min·L)变为1.37 mmol/(min·L)。较之于游离酶,固定化酶的Km值变大了,这表明固定化酶与底物的亲和力相较游离酶要小,酶与底物结合的难度增加了,其原因可能是酶固定化后空间阻碍变大,增加了底物与酶的扩散阻力,使得底物与酶的亲和力减弱[21]。

图9 β-D-葡萄糖醛酸苷的Line Weaver-Burk图Fig.9 Line Weaver-Burk plot for β-D-Glucuronidase
2.3固定化酶的操作稳定性
酶固定化的目的在于提高酶的稳定性,提高酶的重复利用性,节约生产成本,因此固定化酶重复性是重要的考察指标。取一定量的固定化酶颗粒,在同等条件下进行15次循环催化反应,并且确定第一次反应的相对酶活为100%。由图10可知,在前3次循环中,固定化酶的催化反应活力基本不变,进行15次循环后酶的活力仍然能够保持71%,而且固定化凝胶颗粒没有破损,保持完整。这表明,通过本研究优化工艺制备的固定化酶有较好的操作稳定性,可为用于工业大规模生产应用。

图10 β-D-葡萄糖醛酸苷酶的操作稳定性Fig.10 Operation stability of β-D-Glucuronidase
3 结论
本文以海藻酸钠为载体,以戊二醛为交联剂,开展内生真菌C.globosumS108的高选择性β-D-葡萄糖醛酸苷酶固定化研究。酶的最佳固定化条件为海藻酸钠1.5%、戊二醛1.5%、添加酶量为3 500 U、CaCl2浓度2%,交联30 min。虽然酶固定化后其Km变大、Vmax降低,但酶的最适反应温度由45~50 ℃变为40~55 ℃,提高了5 ℃;温度稳定性和pH稳定性均明显改善。固定化酶经15次循环后其活力可维持71%,有较好的操作稳定性,具备应用于大规模生产的潜力。
[1] 金雯彦,于锋.异甘草酸镁防治药物性肝损伤的药理及临床研究进展[J]. 药学进展,2013, 37(4): 162-165.
[2] LU Li, ZHAO Yang, YU He-sui, et al. Preparation of glycyrrhetinic acid monoglucuronide by selective hydrolysis of glycyrrhizic acid via biotransformation[J]. Chinese Herbal Medicines, 2012, 4(4): 324-328.
[3] 张志凌,黄炜,罗惠玲,等. 甘草酸对人乳腺癌细胞增殖抑制和诱导凋亡作用的研究[J].实用癌症杂志, 2004,19(1):16-18.
[4] 豆康宁, 王飞, 石晓, 等. 甘草酸二钠在汤圆中的应用研究[J].粮食加工, 2015, 3(40): 60-62.
[5] KIM D H, LEE S W, HAN M J.Biotrausformation of glycyrrhetinic acid-3-O-β-D-glucuronide byStreptococcusLJ-2,a human intestinal bacterium[J]. Biological and Pharmaceutical Bulletin, 1999, 22(3): 320-322.
[6] BALTINA L A. Chemical modification of glycyrrhizic acid asa route to new bioactive compounds for medicine[J].Current Medicinal Chemistry, 2003, 10(2): 155-171.
[7] 鱼红闪, 吴少杰, 金风燮, 等. 酶法改变甘草苷糖醛酸基提高其甜度的研究(I)-能水解甘草苷糖醛酸蘑酶的提纯与酶性质研究[J]. 食品与发酵工业,1999, 25(4): 10-12.
[8] 吴少杰, 金风燮, 杨志娟. 甘草皂苷生物转化的研究[J]. 中草药,2003, 34(6): 516-518.
[9] ZOU Shu-ping, LIU Gui-yan, KALEEM I, et al. Purification and characterization of a highly selective glycyrrhizin-hydrolyzing β-glucuronidase from Penicillium purpurogenum Li-3 [J]. Process Biochemistry, 2013, 48(2): 358-363.
[10] SURYANARAYANAN T S, Thirunavukkarasu N, Govindarajulu M B, et al. Fungal endophytes: an untapped source of biocatalysts[J]. Fungal Diversity, 2012, 54: 19-30.
[11] 吴文婷. 植物内生真菌转化甘草酸生成单葡萄糖醛酸基甘草次酸[D],南昌:江西科技师范大学,2016.
[12] AKAO T, KOBASHI K. Glycyrrhizin β-D-glucuronidase ofEubacteriumsp. from human intestinal flora[J]. Chemical and Pharmaceutical Bulletin, 1987, 35(2): 705-710.
[13] KURAMOTO T, ITO Y, ODA M, et al. Microbial production of glycyrrhetic acid 3-O-mono-β-D-glucuronide from glycyrrhizin byCryptococcusmagnusMg-27[J]. Bioscience, Biotechnology, and Biochemistry, 1994, 58(3): 455-458.
[14] AMIN H A, EL-MENOUFY H A, EL-MEHALAWY A A, et al. Microbial Production of glycyrrhetic acid 3-O-mono-β-D-glucuronide from glycyrrhizin byAspergillusterreus[J]. Mal J Microbiol, 2010, 6: 209-216.
[15] WANG Chao, GUO Xiao-xiao, WANG Xiao-yan, et al. Isolation and characterization of three fungi with the potential of transforming glycyrrhizin [J]. World Journal of Microbiology and Biotechnology, 2013, 29: 781-788.
[16] 张斌, 李春, 曹红,等.海藻酸钠固定化β-葡萄糖醛酸苷酶的研究[J].中国食品添加剂,2011,(1):110-115.
[17] 孙倩, 李开雄, 李春, 等. 甲壳素固定化β-葡萄糖醛酸苷酶的研究[J]. 食品工业科技, 2011,32 (9): 267-269.
[18] 党艳艳, 冯世江, 栗全营, 等. 基于膨润土的层柱黏土固定β-葡萄糖醛酸苷酶的研究[J]. 生物加工过程, 2009, 7(2): 44-47.
[19] 李林.仿生氧化硅凝胶固定化β-D-葡萄糖醛酸苷酶的研究[D].天津:天津大学,2008.
[20] 王小艳. β-D-葡萄糖醛酸苷酶催化多样性及定向合成GAMG的酶基因克隆与表达[D].石河子:石河子大学,2007.
[21] 肖安风, 游洪燕, 倪辉, 等. 聚乙烯醇和海藻酸钠固定化柚苷酶的制备及其性质[J]. 中国食品学报, 2015, 15(3): 15-23
[22] 雷生姣,余海立,黄超, 等.交联壳聚糖载体固定化柚苷酶工艺[J].食品科学,2013, 34(23): 233-238.
Immobilizationandpropertiesofahigh-selectivityβ-D-glucuronidasefromendophyticfungusChaetomiumglobosumS108
YAN Yi-jiang1, XIAO Yi-wen1, WANG Ya1, WU Wen-ting1, CHANG Jun1, HE Qiao-xuan3, ZHU Du1,2*
1(Key Lab of Bioprocess Engineering of Jiangxi Province, College of Life Sciences, Jiangxi Science and Technology Normal University, Nanchang 330013, China) 2(Key Lab of Protection and Utilization of Subtropic Plant Resource of Jiangxi Provinces, College of Life Sciences, Jiangxi Normal University, Nanchang 330022, China) 3(China Chengda Engineering Co., Ltd., Chengdu 610041, China)
A high-selectivity β-D-glucuronidase from Endophytic FungusChaetomiumglobosumS108 was immobilized into matrix with sodium alginate as embedding material and glutaraldehyde as crosslinking agent. The optimal immobilized conditions were achieved with 1.5% sodium alginate, 1.5% glutaraldehyde, 2% CaCl2and 3 500 U of enzyme load of per milliliter matrix for 30 min. In addition, some immobilized enzymology properties were studied. Compared with free enzyme, the optimum temperature and pH of immobilized enzyme were higher than those of free form, and temperature stability and pH stability of immobilized enzyme were enhanced obviously. After immobilization of β-D-glucuronidase, the Michaelis constant (Km) was increased, and the maximum reaction velocity (Vmax) was decreased respectively. Immobilized β-D-glucuronicdase enzyme activity still retained 71% of its initial activity after consecutive 15 cycles.
sodium alginate; β-D-glucuronicdase; glycyrrhizin; immobilization; Endophytic Fungu
10.13995/j.cnki.11-1802/ts.013962
硕士研究生(朱笃教授为通讯作者,E-mail:zhudu12@163.com)。
国家自然科学基金项目(31260137); “赣鄱英才555工程”领军人才计划项目; 江西科技师范大学自然科学科研计划项目(2016XJZD001)资助
2017-02-03,
2017-04-05
——α-葡萄糖醛酸酶的研究进展*

