云南省药品经营企业GSP飞行检查缺陷项目统计分析
李娜+周玲


摘要:目的:分析2016年云南省药品经营企业新版《药品经营质量管理规范》(GSP)飞行检查缺陷项目情况,提出推进云南省经营企业实施新版GSP的对策和建议。方法:对云南省2016年飞行检查的74家药品经营企业缺陷项目进行汇总,分析缺陷情况,并总结、分类、归纳主要问题。结果与结论:应加强监管,企业自律,充分发挥行业协会作用,确保新版GSP得到正确的贯彻实施。
关键词:药品经营企业;GSP飞行检查;缺陷情况
Analysis of unannounced inspection in Pharmaceutical trading enterprises in Yunnan province
Li Na1 ZHOU Ling2
(1. Center for food and drug inspection of YNFDA, Kunming Yunnan 650500)
Abstract:OBJECTIVE Analyze the defect situation during the 2016 unannounced
Inspection in Pharmaceutical trading enterprises in Yunnan province, In order to provide some reference for Pharmaceutical trading enterprises to implement GSP( 2010 revision.) METHORDS Collect the defect situation of 74 Pharmaceutical trading
enterprises according to 2016 GSP unannounced Inspection in Yunnan Province, Analyze the defect items,then summarize、classify and sum up the main problems. Results and CONCLUTION The drug regulatory authority should focus on supervising, the enterprises need to strengthen their self-discipline, fully develop the role of the industry association, make sure the new revision GSP can be implement correctly.
Key words:Pharmaceutical trading enterprises;GSP unannounced Inspection;the defect situation
隨着国家局从2016年以飞行检查为主要方式的集中专项整治行动的开展,“飞检”成为近来药品流通行业的热词,从政府到坊间,从行业到企业,无不为力度空前的飞行检查而注入思考。云南省食品药品监督管理局也于2016年首次开展了本辖区内的计划性飞行检查,笔者分析了云南省2016年飞行检查工作中发现的缺陷项目,找出了企业在实施新版GSP过程中存在的问题,以及检查员存在的问题,为今后的新版GSP认证检查提供了参考依据,并提出了相应的对策和建议。
一、检查基本情况
(一)检查企业数及检查范围。
云南省于2016年开展药品批发企业GSP飞行检查,中心派出74个检查组,检查员216人次,组织完成74家企业的现检查,其中新申报企业3家,经营疫苗的12家,针对认证缺陷整改核查的10家,其他类型49家。检查情况如下表所示:
图1 2016年GSP飞行检查范围分布图
Fig1. The distribution of 2016 GSP unannounced inspection range
(二)检查结果。
对本年度飞检的74家企业中,其中现场通过27家,限期整改40家,未通过2家,企业注销及更名3家。
图2 2016年GSP飞检结果统计图
Fig2. The percentage graph of 2016 GSP unannounced inspection results
二、本年度现场检查情况及缺陷分析
(一)现场检查发现缺陷的总体情况。
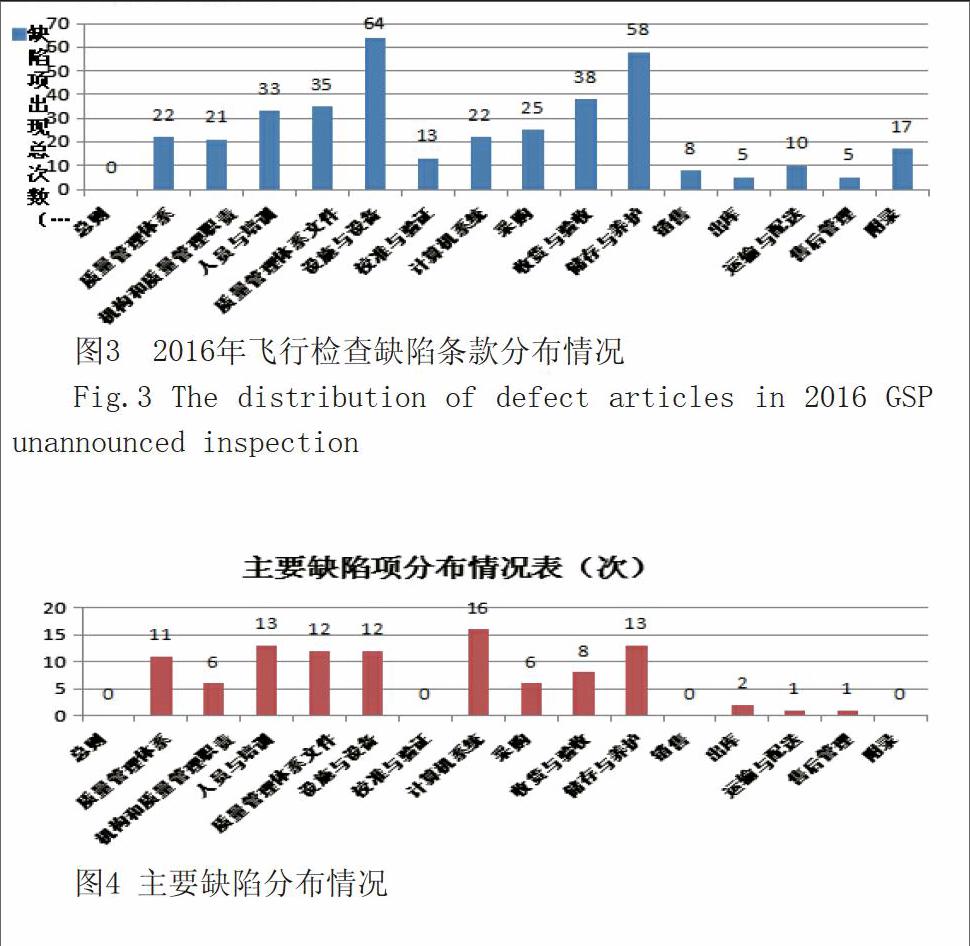
经对74份检查报告进行分析,共发现391条缺陷项,其中严重缺陷0项,主要缺陷98项,一般缺陷293项。依据药品GSP正文及附录内容对缺陷项进行分类,设施与设备面发现缺项数目最多,达64项;其次是储存与养护方面,缺陷58项;收货与验收方面缺陷38项;具体分布情况如下图:
图3 2016年飞行检查缺陷条款分布情况
Fig.3 The distribution of defect articles in 2016 GSP unannounced inspection
发现缺项条款数量最多的GSP章节依次为:设施与设备、储存与养护、收货与验收、质量管理体系文件、人员与培训。共计228项,占58.31%,应作为2017年企业日常监管及关注的重点。
其中主要缺陷项98项,占缺陷总数的25%。主要缺陷数量最多的SP章节依次为;包括计算机系统16项,储存于养护及人员与培训各13项,质量管理体系体系文件及设施与设备各12项。
图4 主要缺陷分布情况
Fig.4 The distribution of main defect itemsendprint
(二)高频次缺陷条款分布情况。
对现场检查发现的391条缺陷项汇总分析发现,频次最高的缺陷条款依次是:04603项(库房内墙、顶光洁,地面平整,门窗结构严密),出现13次;01101项,出现11次;02702项,出现11次;04702项出现10次;07802项,出现10次;01702,出现9次;06102项,出现9次;*02501项,出现 8次。
图5 2016年GSP飞检高频次缺陷分布情况
Fig.5 The distribution of high frequency defect items
通过开展飞行检查发现企业主要存在以下问题:
1.缺陷分布方面。
缺陷主要集中在设施与设备、储存与养护、收货与验收、质量管理体系文件、人员与培训等方面;其中高频缺陷项依次集中在设施与设备、人员与培训、质量管理体系、收货与验收、采购等方面。具体情况为:
(1)设施与设备。
设施与设备方面发现缺陷项数目的64项,占缺陷总数的16.4%,缺陷主要集中在设施设备维护方面的问题。
(2)储存与养护。
储存与养护方面发现缺陷项数目的58项,占缺陷总数的14.8%,缺陷主要集中在药品储存不规范、状态标识不清晰、药品堆码不规范等方面的问题。
(3)收货与验收方面。
收货与验收方面发现缺陷项数目的38项,占缺陷总数的9.7%,缺陷主要冷链运输记录为签字等方面的问题。
(4)质量管理体系文件方面。
质量管理体系文件方面发现缺陷项数目的35项,占缺陷总数的9%,缺陷主要有部分记录不全、记录修改不规范等方面的问题。
(5)人员与培训。
人员与培训方面发现缺陷项数目的33项,占缺陷总数的8.4%,缺陷主要有培训档案建立不全、培训记录不全等方面的问题。
2.缺陷程度方面。
本年度的飞行检查中共发现有严重缺陷0项,主要缺陷98項,
存在的主要问题如下:该企业质量管理体系关键要素发生重大变化,但未组织开展相应的内审、企业药品销售记录不真实、书面记录凭证记录不真实、质量管理部门未能指导并监督药品储存、养护等环节的质量管理工作、计算机经营和管理相关数据未按规定进行备份和保管、中药饮片与外用药未进行分开存放、药品收货区、验收区、发货区、出库复核区未安装温湿度自动监测、记录设备、质量管理部门未对购货单位采购人员的合法资格进行审核等。
3.企业整改资料报送方面。
从今年飞检整改情况来看,企业责任意识不强,放松了GSP认证后药品质量管理。部分药品经营企业通过GSP认证后,就认为企业已达到标准,放松了药品经营质量管理。大多数企业不能一次整改到位,需要中心多次督促整改落实。监管部门需在日常监管工作中重点追踪企业整改落实情况,强化企业持续改进、认真落实的意识。
4.检查发现缺陷率来看。
经对本省74家企业进行飞行检查,共发现391条缺陷项,其中严重缺陷0项,主要缺陷98项,一般缺陷293项,平均每次出现缺陷5.3条缺陷。单次检查发现一般缺陷最多者18条,最少者1条。
结果表明,在检查中检查员发现问题的能力较低,平均缺陷率比较低,这与检查员的业务能力有关。我省的检查员基本都是来自监管部门和直属单位,认证检查工作只是其本质工作以外的一项工作任务。具备检查员资格的监管人员必须在完成本职工作的基础上,经所在单位同意后,才能接受检查机构的委派,承担认证检查工作,他们对GSP和药品流通过程药品的质量管理的熟悉程度不及企业内部人员,导致在认证过程中生搬硬套条文去满足认证需要。此外,大多数检查员对现场检查过程中发现的问题习惯于口头反馈,上报告的条款少。
三、对策建议
近一年多来,上到国家局开展的以飞行检查为主要方式的集中整治专项行动,下到各省市密集开展的辖区内的GSP飞行检查,都是为飞行检查步入常态化做铺垫。由以上突出的共性缺陷分析可见,企业的质量管理制度与实际操作分离,很多企业未能结合自身经营的品种特点、管理模式,人员结构,自身存在的风险点来客观的编写操作规程,导致制定的规程操作性不强,风险防控意识不够,应从以下三方面进行改进和加强。
1.充分发挥监管机构的作用,2015年9月1日起,《药品医疗器械飞行检查办法》(以下简称办法)[1]正式实施,2016年5月国家总局发布《关于整治药品流通领域违法经营行为的公告》和同年8月国家总局下发《食品药品监管总局办公厅关于印发药品流通企业现场检查要点的通知》。从某种程度上,关于飞行检查的顶层设计基本已经成形,但飞行检查的总体要求是“结合当地情况”,要求基层食药监管部门制定明确的执行文件。积极开展GSP培训工作,充分发挥各级食品药品监督管理局的作用,开展针对企业和管理人员的技术交流活动,加强GSP检查员队伍建设,认真履行检查员管理制度,实施动态化管理[2]。
2.企业需加强对GMP的内审,提升执行力度。企业应该把GSP管理贯穿日常流程中,企业应及积极梳理和调整,包括质量体系文件优化,检查质量管理制度、操作规程、岗位职责与GSP条款是否相符;重新梳理公司组织构架,审核公司重要岗位资质:加强仓储管理,严格定期检查温湿度记录,药品的摆放位置,设备的更新保养是否及时;定期抽查药品的进销存和票账款[2]。
3.社会共治是未来是未来食药监管新方向,充分发挥行业团体的作用,由行业协会组织各企业进行学习交流,将企业的个性化需求提取出来,在政策落地时组织行业专家为企业实际工作中遇到的问题提供指导,帮助企业找到适合新政策的路径,并积极探索更多服务形式,进一步发挥行业监督智能。
四、小结
“最严的标准,最严的监管、最严的处罚、最严的问责”已经成为飞行检查最基本的尺度,对于企业而言既是一种压力也是一种动力,只有合规经营把好质量关,才能把企业做大做强:同时,在政府职能转变的大背景下,提升医药行业的整体质量控制水平不仅需要企业自律及监管,更呼吁社会组织积极参与企业服务实现社会共治[3]。
参考文献:
[1]药品医疗器械飞行检查办法(Z). 国家食品药品监督管理总局令第14号。
[2]韩莹,许丹.2013年山东省新修订药品GMP认证检查情况分析[J].药学研究,2014,33(2):121-124。
[3]张蓝飞 飞检常态化助推GSP管理升级.医药经济报,2015年9月21日(002版)。endprint

