猪链球菌2型的分离鉴定及猪场带菌情况调查
张广斌,李 舫,袁东芳,沈美艳
(山东畜牧兽医职业学院,山东潍坊 261061)
猪链球菌2型的分离鉴定及猪场带菌情况调查
张广斌,李 舫,袁东芳,沈美艳
(山东畜牧兽医职业学院,山东潍坊 261061)
2016年10月山东省潍坊市某猪场的产房仔猪出现疑似猪链球菌感染病例。为准确诊断和进一步防控猪链球菌病,对病例进行了细菌分离培养、革兰氏染色、生化试验、16S RNA基因鉴定和动物接种试验等,最终鉴定为猪链球菌2型感染;对该场的产房、保育猪舍、育肥猪舍、母猪舍进行鼻腔拭子采集,以特异性引物通过PCR检测16S RNA基因和猪链球菌2型荚膜多糖基因(cps2),结果分离到了猪链球菌。检测发现,该场除产房仔猪携带猪链球菌2型外,其他猪舍均没有猪链球菌2型被检出。
猪链球菌2型;细菌鉴定;带菌情况调查
猪链球菌(Streptococcus suis,S.suis)是一种革兰氏阳性、溶血性兼性厌氧球菌,根据形态学、生化特征和菌体表面荚膜多糖(Capsular polysaccharide,CPS)抗原特性等的不同,将其分为35个血清型(1~34和1/2)。但Hill等[1]从基因水平证实其中的32及34型为鼠口腔链球菌(Streptococcus orisratti),因此现在一般认为有33个血清型,其中 1、2、1/2、7、9、14 型具有致病性,以 2 型(SS2)毒力最强,分布范围最广[2-4]。2016年10月山东省潍坊市一猪场产房仔猪出现疑似链球菌感染的散发病例。在进行诊断治疗的同时,对该场的所有猪舍进行了猪链球菌带菌状况检测,并为其提供了进一步的防控措施。
1 病猪和猪场情况
猪场产房仔猪132头,20日龄,有2头出现症状。其中,1头精神略不振;另1头不食,呼吸急促,咳嗽,眼结膜潮红,流泪,鼻孔有较多量鼻液流出,腹下皮肤呈紫红色,有出血点。剖检病重猪见皮下组织出血,鼻黏膜充血、出血,气管充血,肺充血肿胀;全身各处淋巴结不同程度肿大、充血和出血;心包有淡黄色积液,心内膜有细小出血点;脾脏暗红色肿大;肾肿大,切面有小的出血点。
该猪场整体卫生状况良好,猪群整体无不适表现。产房温度较高,有刺激性气味,但保育舍、育肥舍和母猪舍空气良好,地面较为洁净。
2 主要试剂
PCR试剂(10×PCR Buffer、dNTPs、Taq酶)、DL2000 DNA Marker,购自宝生物工程(大连)有限公司;THB培养基、鲜血琼脂平板、多粘菌素B、萘啶酮酸,均购自青岛海博生物技术有限公司;药敏纸片、细菌微量生化反应管、革兰氏染色液,购自杭州滨和微生物试剂有限公司。
3 样品采集
3.1 病猪样品采集
无菌采集病猪的血液以及气管和肺组织,置于无菌容器中。
3.2 健康猪鼻腔拭子采集
对该猪场产房、保育舍、育肥舍、母猪舍的猪进行鼻腔分泌物采集。用无菌棉棒蘸取THB肉汤,在猪的鼻腔粘膜表面轻轻擦拭;收集鼻腔分泌物,用无菌剪刀剪取棉花头,置于装有THB肉汤培养基(含15 µg/mL多粘菌素B,30 µg/mL萘啶酮酸)的试管中。
4 试验方法
4.1 细菌的分离、初步鉴定及敏感药物筛选
4.1.1 细菌分离培养和形态鉴定。无菌取病死猪的肺组织,分区划线接种于鲜血琼脂平板上,37 ℃培养24 h,观察细菌生长特性。挑取单个菌落,对其进行革兰氏染色镜检,观察细菌形态。
4.1.2 细菌生化试验。挑取单个分离菌,将其接种于细菌微量发酵管中,37 ℃培养18~24 h,观察并记录生化反应结果。
4.1.3 16S RNA基因鉴定。参照文献[5]报道的方法合成1对用于扩增猪链球菌16S rRNA基因序列的特异性引物(表1)。引物由宝生物工程(大连)有限公司合成。以基因组DNA为模板进行PCR反应,PCR反应体系(25 µL))包括:DNA模板1.0 µL,上、下游引物各1.0 µL,Taq酶0.5 µL,dNTP 2.0 µL,10×PCR Buffer 2.5 µL,去离子水18.0 µL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1.5 min,扩增35个循环;72 ℃延伸7 min,4 ℃终止反应。对PCR产物进行1.0%琼脂糖凝胶电泳检测,将PCR产物回收测序。
4.1.4 动物接种试验。将分离菌的纯培养物接种于THB肉汤培养基中,37 ℃培养18~24 h,然后计算活菌数。选取15只健康小白鼠,分为3组:第1组,每只腹腔注射菌液0.2 mL(1.8×108CFU/ mL);第2组,每只注射等量THB肉汤;第3组,为正常对照。小鼠攻毒后连续观察7 d,记录其临床症状及死亡情况。
4.2 猪场带菌情况调查
4.2.1 增菌培养。将含有棉拭子的THB肉汤(含15 µg/mL多粘菌素B,30 µg/mL萘啶酮酸)置于37 ℃振荡培养箱中培养6~8 h,使菌液变浑浊。
4.2.2 DNA提取。取1 mL细菌悬液,10 000 r/min离心2 min,弃上清,用TE洗涤1次,200 µL TE重悬菌体,煮沸10 min后,10 000 r/min 离心2 min,吸取上清液,将其作为PCR检测的模板。利用猪链球菌种16S rRNA基因的特异性引物进行PCR检测。
4.2.3 猪链球菌2型cps2基因检测。参照文献[5-6]报道的方法合成猪链球菌2型cps2特异性引物(表1),引物由宝生物工程(大连)有限公司合成。以基因组DNA为模板进行PCR反应。PCR反应体系(50 µL)包括:DNA模板2.0 µL,上、下游引物各2.0 µL,Ex Taq酶1.0 µL,dNTP 4.0 µL,10×PCR Buffer 5.0 µL,去离子水34.0 µL。PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1.5 min,扩增35个循环;72 ℃延伸7 min,4 ℃终止反应。对PCR产物进行1.0%琼脂糖凝胶电泳检测。

表1 猪链球菌的检测引物
4.2.4 猪链球菌cps2基因检测。将16S rRNA基因检测阳性的样品进行cps2基因检测,PCR反应体系和方法同4.2.3,对PCR产物进行1.0%琼脂糖凝胶电泳检测。
5 试验结果
5.1 病例中的细菌分离鉴定
从患病猪血液、肺脏中分离到具有β-溶血环的革兰氏阳性链球菌。该分离菌能够分解葡萄糖、乳糖、麦芽糖、蔗糖和甘露醇,不分解山梨醇、木糖和肌醇,甲基红试验阳性,不产生硫化氢,符合链球菌生化特征。用猪链球菌16S rRNA基因的特异性引物进行PCR扩增,对PCR产物测序后,利用NCBI的BLAST工具,将分离菌基因序列与数据库中的序列进行了同源性比对分析,结果显示该菌与猪链球菌序列(GenBank序列号CP007497.1)同源性为99%。因此,结合革兰氏染色镜检结果,确定分离菌株为猪链球菌(图1、图2)。
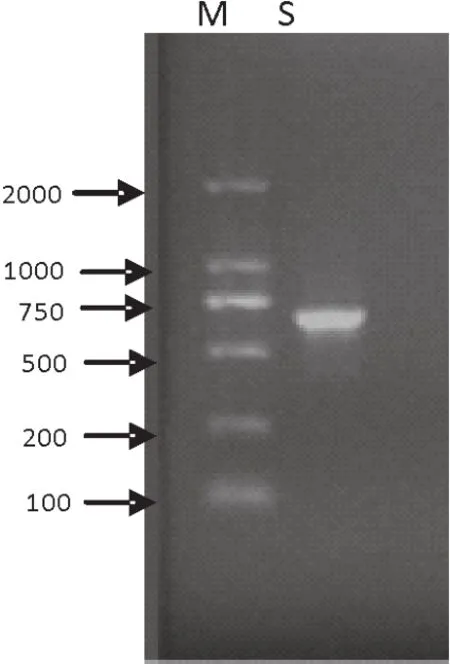
图1 产房猪链球菌2型检测结果
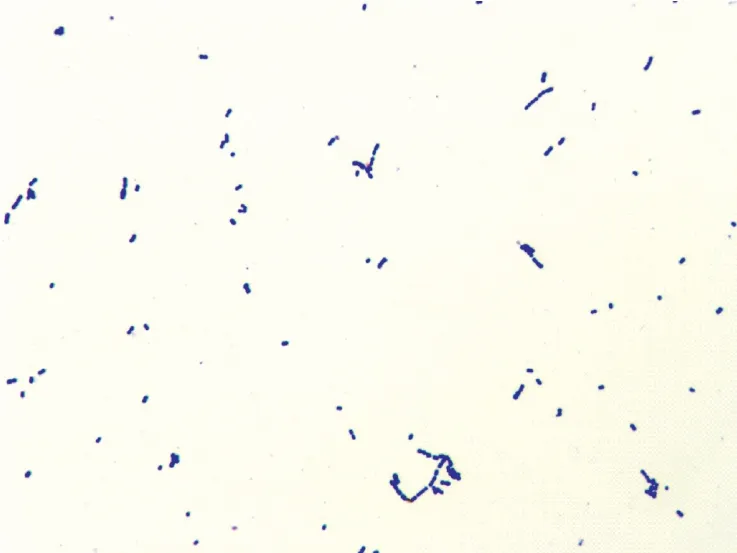
图2 产房猪链球菌2型纯化菌株革兰氏染色结果
5.2 动物试验
菌液接种组小鼠于接种后6 h出现精神萎靡,体温升高,36 h后全部死亡。剖检见全身出血,取心血凝块涂片后革兰氏染色镜检,视野中可见大量呈蓝紫色短链状球菌。THB接种组和无接种组小鼠正常。
5.3 猪场中猪链球菌带菌情况调查
该猪场产房内16S rRNA基因和cps2基因检出率分别为60%和 5%,保育舍、育肥舍和母猪舍的猪链球菌16S rRNA基因检出率较低,未检出cps2(表2)。

表2 不同猪舍16S rRNA和cps2基因检测结果
6 讨论
该猪场为猪链球菌2型感染散发。由于对发病猪进行了及时隔离和治疗,未再次出现病例。因此,及时正确的诊断、隔离和敏感药物的使用对猪链球菌防控非常重要。患病猪作为传染源,如在早期进行隔离,并做好猪舍内消毒管理,就可以很好地阻止本病在猪群中的传播。
所有品系的猪均可感染猪链球菌。2~6周龄仔猪感染后,会引起典型的临床症状或突然死亡,而成年猪和母猪感染后,往往没有明显的临床症状。在对该猪场所有猪舍进行猪链球菌的检测中发现,该场各猪舍卫生状况良好,猪舍地面干燥,除产房外,猪舍内无明显刺激气味。由于该场曾发生过有猪链球菌感染,除对产房仔猪未进行猪链球菌疫苗外,对其他舍的猪群均进行了免疫。该养殖场对易感性高的幼龄仔猪未进行免疫,而且为了保温导致通风不良,这是导致此次猪链球菌感染的重要原因。因此,科学的饲养管理、良好的生物安全措施和有效的免疫接种对猪链球菌病的控制行之有效。而养殖过程舍内空气质量与保温这对矛盾需要谨慎处理。
在对该猪场进行猪链球菌带菌情况调查中,育肥舍、保育舍和母猪舍均未检出猪链球菌2型,说明该菌的传播能力很弱。同时检测到有16S rRNA基因检测阳性样品,说明该场存在其他血清型的猪链球菌。在猪链球菌各血清型中,2型的毒力最强,1、1/2、7、9、14 型也具有一定的致病性,因此猪场中其他血清型链球菌的存在,同样是一种威胁。建议猪场进行多价疫苗接种,对免疫效果进行检测,进一步加强卫生消毒,完善生物安全措施,这将对整个猪场链球菌病的防控更加有效。
[1] HILL J E,GOTTSCHALK M,BROUSSEAU R,et al. Biochemical analysis,cpn 60 and 16S rDNA sequence data indicate that Streptococcus suis serotypes 32 and 34,isolated from pigs,are Streptococcus orisratti[J]. Veterinary Microbiology,2005,107(1/2):63-69.
[2] GOTTSCHALK M,SEGURA M. The pathogenesis of the meningitis caused by Streptococcus suis:Unresolved questions[J]. Vet Microbiol,2000,76:259-272.
[3] LI G,LU G J,QI Z M,et al. Morin Attenuates Streptococcus suis Pathogenicity in Mice by NeutralizingSuilysin Activity. Frontier in Microbiology[J]. Frontiers in microbiology,2017,20(8):1-11.
[4] GOTTSCHALK M,SEGURA M,XU J. Streptococcus suis infections in humans:the Chinese experience and the situation in North America[J]. Anim. Health Res. Rev,2007,8(1):29-45.
[5] ZHU H D,ZHOU J M,NI Y X,et al. Contribution of Eukaryotic-Type Serine/Threonine Kinase to Stress Response and Virulence of Streptococcus suis[J]. Plos One,2014,9(3):1-12.
[6] NGO T H,TRAN T B C,HO D T N,et al. The antimicrobial resistance patterns and associated determinants in Streptococcus suis isolated from humans in southern Vietnam,1997-2008[J]. Infectious diseases,2011,11(6):1471-2334.
(责任编辑:朱迪国)
Isolation and Identifcation of Streptococcus suis type 2 and Investigation of Bacteria Carrying Status in a Swine Farm
Zhang Guangbin,Li Fang,Yuan Dongfang,Shen Meiyan
(Shandong Vocational Animal Science and Veterinary College,Weifang,Shandong 261061)
A suspected case of Streptococcus suis infection was detected in piglets in delivery room of a farm in Weifang city of Shandong province in October 2016. For accurate diagnosis and further prevention and control of Streptococcus suis disease,the bacterium in the case was isolated and identified by culturing,Gram's staining,biochemical testing,gene identification and animal experiment. The results showed that the case was an infection of the Streptococcus suis 2(SS2). Then,the nasal swabs were collected from the delivery room,weaning swine house,fattening house and the mother feeding stalls. Genes of 16S RNA and cps2 were detected by PCR. The results indicated that only circulated SS2 in the delivery room,but not in the other houses.
Streptococcus suis type 2;identification of bacterium;investigation of germ-carrying condition
S855.1+1
A
1005-944X(2017)09-0092-04
10.3969/j.issn.1005-944X.2017.09.025
公益性行业(农业)科研专项(201303041)
沈美艳