膜生物反应器降解对氨基苯磺酸的性能及微生物群落特征
闫凯丽, 郑君健, 王志伟, 吴志超
同济大学环境科学与工程学院, 上海 200092
膜生物反应器降解对氨基苯磺酸的性能及微生物群落特征
闫凯丽, 郑君健, 王志伟*, 吴志超
同济大学环境科学与工程学院, 上海 200092
为研究MBR(膜生物反应器)降解SA(对氨基苯磺酸)的性能,构建一套连续流MBR,针对ρ(SA)为25 mg/L的模拟废水进行处理,并通过高通量测序对MBR运行过程中微生物群落特征变化进行生物学层面的分析. 结果表明:经过31 d的启动驯化后,SA基本可以完全降解,CODCr、NH4+-N、TN和TP的去除率分别为87.63%±5.95%、91.94%±8.80%、32.38%±11.6%和85.69%±13.82%. 对驯化及稳定运行阶段的污泥进行微生物菌群分析结果表明,在“门”水平上主要的微生物菌群为拟杆菌门、变形菌门和绿弯菌门,其中拟杆菌门是处理含SA废水的优势菌群. 在“科”水平上,噬几丁质菌科、腐螺旋菌科、红环菌科、丛毛单胞菌科和拜叶林克氏菌科为主要的微生物菌群,随着反应器的长期驯化和运行,噬几丁质菌科逐渐成为反应器中优势菌群. 研究显示,MBR对SA、CODCr、NH4+-N和TP都有很好的去除效果,拟杆菌门和噬几丁质菌科分别为处理SA的优势“门”和“科”.
对氨基苯磺酸; 膜生物反应器; 微生物群落
磺化芳香族胺类化合物作为化工中间体,被大量用于染料、植物保护剂、清洁剂和磺胺类药物等的生产和使用[1]. SA(sulfanilic acid,对氨基苯磺酸)是一种典型的磺化芳香族胺类化合物,其结构含有氨基(—NH2)和磺酸基(—SO3H)两性官能团,具有高极性和高水溶性的特点,化学结构稳定,属难生物降解的化学物质[2- 3],含SA的废水会对生态环境造成严重的影响[4],危害人类健康[5]. 因此,SA污染的废水在其排放到环境中之前需要进行一定的处理.
国内外关于SA生物处理的研究主要是利用从受污染的污泥或土壤中筛选分离出来的纯菌或特定种类混合菌对SA降解. 如Feigel等[6- 7]首次报道了Hydrogenophagapalleronii(strain 1)和Agrobacteriumradiobacter(strain 2)混合菌群可相互协同,共同代谢SA;Gan等[8]发现从纺织废水处理厂分离出的Hydrogenophagasp. PBC和Ralstoniasp. PBA可以耐受c(SA)为100 mmol/L的污水,并在好氧条件下以其作为碳源、氮源和硫源生长. 利用纯菌或特定种类的混合菌种处理SA,对理解SA在微生物作用下的降解机理有重要的作用,而在实际废水处理中仍然具有一定的局限性. 活性污泥作为混合微生物体广泛应用于废水处理,具有实际应用前景,如CHEN等[9]驯化出能高效降解SA的活性污泥,并探究了SA降解和氧气的消耗之间的动力学关系.
MBR(膜生物反应器)是膜分离技术与活性污泥技术相结合的污水处理新工艺,以膜处理单元(超滤膜或微滤膜)取代二沉池,实现了HRT(水力停留时间)与SRT(污泥泥龄)的彻底分离,较传统污水处理工艺,系统可以在较长的SRT下运行,对于生长缓慢的难降解有机物分解菌的生长非常有利,有利于在系统中形成优势菌种;同时,生物反应器中的活性污泥浓度增加,也有利于提高难降解有机物的降解效率[10]. 但是有关利用MBR处理含SA废水方面的研究在国内外相对较少. 因此,该研究拟构建一套连续流MBR,驯化能高效降解SA的活性污泥,探究MBR的运行特征和污染物的去除效果,同时,通过高通量测序对微生物群落特征变化进行了生物学层面的分析.
1 材料与方法
1.1试验装置
采用平板式MBR处理含SA的模拟废水. 污水进入反应器后,通过进水箱溢流和单向阀保持液位稳定. 反应器有效容积为3.3 L,池内放置2片超滤膜组件(单片尺寸为23 cm×10 cm,单片有效尺寸为21 cm×8 cm),2片档板(单片尺寸为23 cm×10 cm)分立于膜组件两侧,膜组件与挡板间距为1 cm. 曝气管安置于超滤膜底部,试验过程中曝气强度利用气体流量计控制为72 m3/(m2·h)(按照膜区投影面积计). MBR出水采用蠕动泵(兰格,中国保定)间歇抽吸,抽停比为10 min∶2 min出水通量维持在20 L/(m2·h). TMP(跨膜压差)由压力表记录,当TMP>30.0 kPa时,采用0.5%的次氯酸钠浸泡2 h,进行膜清洗,用清洗后的膜继续进行试验. 该研究采用的自制超滤膜[11]基本性质如表1所示,其中临界通量为(25±1) ℃下通过增加通量梯度法[12]测定.
1.2进水水质

表1 超滤膜基本性质一览
进水为模拟废水,进水组成:ρ(CH3COONa)为473 mg/L,ρ(NH4Cl)为153 mg/L,ρ(K2HPO4·3H2O)为52 mg/L,ρ(CaCl2)为11.5 mg/L,ρ(MgCl2·6H2O)为20.3 mg/L,ρ(NaHCO3)为120 mg/L,ρ(NaCl)为800 mg/L,ρ(FeCl2·4H2O)为7.16 mg/L,ρ(SA)为25 mg/L,φ(微量元素)为10 μL/L.
接种污泥取自上海某污水处理厂二沉池回流污泥. 该试验持续80 d,HRT为2 h,通过定期排泥控制SRT为40 d.
1.3分析方法
试验涉及的分析项目ρ(CODCr)、ρ(TN)、ρ(NH4+-N)、ρ(NO3--N)、ρ(TP)和污泥ρ(MLSS)、ρ(MLVSS) 均采用国标方法[13]测定. SMP(溶解性微生物产物)和EPS(胞外聚合物)采用超声法[14]提取;其中的ρ(多糖)采用蒽酮法测定;ρ(蛋白质)和ρ(腐殖酸)采用改进Lowry法[15]测定;SOUR(好氧呼吸速率)通过溶解氧电极法[16]测定;ρ(SA)通过液相色谱法[6]测定.
当MBR开始运行(第1天)以及运行7、14、24、40、55和68 d时,取反应器的活性污泥进行微生物群落分析,具体分析方法如下:
活性污泥样品首先利用E.Z.N.A.®泥土样本DNA提取试剂盒(Omega Bio-Tek 公司,美国) 抽提DNA,完成DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA. PCR扩增中,使用的引物为338F(ACTCCTACGGGAGGCAGCA)和806R (GGACT ACHVGGGTWTCTAAT). 基于第二代高通量测序平台Illumina Miseq,采用二次PCR建库测序. 采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,据SILVA123库中的参考序列对OTU在各个水平统计每个样品的群落组成.
2 结果与讨论
2.1反应器的运行特征
MBR运行过程中,ρ(MLSS)为(13.46±1.65)g/L,ρ(MLVSS)为(11.24±1.44)g/L. 利用微生物的SOUR表征驯化过程中微生物的活性变化,由图1可见,污泥活性在试验初期较低,随着试验的进行逐渐升高,然后略有降低并趋于稳定,说明反应器内的微生物逐渐适应SA的存在,活性不断上升到一定水平后,可能由于微生物竞争的关系活性有一定程度的下降,然后保持稳定. 由于污泥较高的浓度和活性,试验过程中,反应器内ρ(DO)较低,为(0.48±0.37)mg/L. 恒流过滤下,可以通过TMP表征膜污染,TMP变化如图2所示. 整个试验过程(80 d)中,反应器内的超滤膜运行了近3个周期,平均运行周期约为30 d. 污泥SMP中的ρ(蛋白质)、ρ(腐植酸)和ρ(多糖)分别为(13.77±6.98)(10.23±8.06)(18.12±10.33)mg/L,EPS中w(蛋白质)、w(腐植酸)和w(多糖)(均以每g VSS计)分别为(55.08±11.00)(7.35±6.99)(13.23±5.03) mg/g(n=13),浓度波动较小,膜污染情况相对稳定,说明该条件下MBR可以实现长期稳定运行.

图1 MBR中活性污泥的SOURFig.1 The SOUR of activated sludge in MBR

图2 MBR运行过程中TMPFig.2 The TMP evolution in MBR
2.2污染物去除效果
由图3可见,进水ρ(SA)为(26.23±0.73)mg/L,运行10 d左右出水ρ(SA)开始逐渐降低,31 d后SA基本可以被完全降解并保持稳定,这可能是由于随着运行时间的延长,反应器内微生物种类发生了变化,适应SA特性的菌种逐渐增加,SA的去除效率也随之提高. 与传统活性污泥法[9]相比,MBR的驯化时间更短,在降解SA方面有独特的优势. 进水ρ(CODCr) 为(375.39±14.82)mg/L时,去除率可达到87.63%±5.95%. 该反应器对NH4+-N有良好去除效果,进水ρ(NH4+-N)为(38.34±2.24)mg/L时,91.94%±8.80%的NH4+-N转化为NO2--N与NO3--N. MBR在较低ρ(DO)的情况下还可以达到较高的NH4+-N去除率,主要归因于MBR通过膜分离实现污水处理的固液分离,减少了长世代周期的硝化细菌的流失;同时该研究中采用了较长的SRT, 也保证了硝化细菌的生存环境[17]. 同时,由于MBR中保持较低的ρ(DO),MBR中可以实现同步硝化反硝化,而部分聚磷菌能以硝酸盐作为电子受体在进行反硝化的同时完成过量吸磷,因此该MBR系统中存在磷元素的去除,在进水ρ(TN)和ρ(TP)分别为(37.16±2.97)(3.87±0.61)mg/L时,其去除率达到32.38%±11.6%、85.69%±13.82%.
2.3微生物多样性及相似度分析
为研究反应器在驯化及稳定运行阶段微生物菌群的变化情况,在运行的各个阶段取出生物反应区污泥进行微生物分析. 取样时间分别为1 d(试验开始时)、7 d(SA开始降解时)、14 d(约20%SA降解时)、24 d(约40%SA降解时)、40 d(SA完全降解时)、55 d(稳定阶段)和68 d(稳定阶段),样品编号分别为D1、D7、D14、D24、D40、D55、D68. 图4为各个阶段的细菌群落在97%相似性下的稀释性曲线,曲线趋于平坦,说明测序数量趋于饱和,表明现有的测序数据量对于获得新物种已经足够. 从图4中可以看出,当测序数量大于 28 524 时,基本没有新的物种再出现,表明测序数量已经足够. 同时由表2可见,7个样品的细菌基因库Goods coverage值(样品文库的覆盖率)均大于99.5%,说明MBR中绝大部分微生物已被检测出来,测序结果可以代表样品中的真实情况.
表2中的Chao指数通常被用来估算当测序序列趋向无穷时可获得的OTU数量,Chao指数越大,表明样品中所含物种种类越多,样品的丰富度越高. Shannon-Wiener多样性指数常用来估算样品中微生物多样性指数,Shannon-Wiener多样性指数越大,说明群落多样性越高. 在驯化的初始阶段(1~7 d),微生物的Chao指数基本稳定,而Shannon-Wiener多样性指数却有所下降. 这可能是因为含SA的废水刚进入后,一些微生物种群由于不适应含SA的而消亡,多样性下降;而部分微生物种群内却逐渐衍生更多种类的微生物,丰富度可以基本保持稳定. 之后,Shannon-Wiener多样性指数呈一个先略上升后略有下降并基本稳定的过程,说明随着污泥驯化时间的推移,微生物种群多样性结构趋于稳定,优势菌种基本确定. 总体上来看,Shannon-Wiener多样性指数的变幅较小,微生物种群多样性变化不大. 从Chao指数的角度来看,8~40 d细菌的丰富度呈上升趋势,这可能是因为含SA的废水,使反应器内部衍生出了一些新的微生物种类,而后随着驯化时间的延长(40 d之后),微生物逐渐适应了含SA的废水,菌群丰富度基本稳定并略有下降,而相应的SA去除率逐渐升至97%左右并保持稳定.
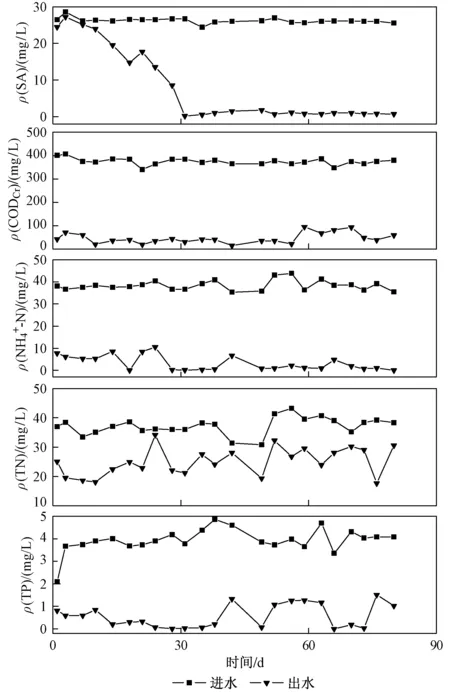
图3 MBR中进出水ρ(SA)、ρ(CODCr)、ρ(NH4+-N)、ρ(TN)及ρ(TP)Fig.3 The ρ(SA), ρ(CODCr), ρ(NH4+-N), ρ(TN) and ρ(TP) of effluent and influent in MBR

图4 样品细菌群落的稀释性曲线Fig.4 Rarefaction curve of sludge samples

表2 各个阶段细菌的Alpha多样性参数(相似度为97%)
为分析各个阶段细菌群落的相似程度,对各个阶段的污泥样品进行了主成分分析(PCA)和多样本相似度树状图分析,结果如图5所示. OTU数据被提取出两个主成分,对于细菌,两主成分分别解释PCA结果的77.57%和17.37%. 从图5可以看出,细菌样品可以分为两个大组:第一组包括D1、D7、D14和D24样品;第二组包括D40、D55和D68样品. 这两组不论是从PC1和PC2来看,均有较大差异性. 由此认为试验的驯化期和稳定期,细菌群落发生了显著变化. 第一组中的4个样品在PC1上也有较大差异,说明当进水中开始加入SA时,细菌群落内部发生相关菌群的富集与淘汰,逐渐适应含SA的废水,结合图3也可以看出随着微生物的富集和淘汰,出水ρ(SA) 逐渐降低. 第二组内3个样品表现出了较高的相似性,说明随着污泥驯化结束,细菌群落构成趋于稳定,图3中显示试验后期出水ρ(SA)为0.18~1.78 mg/L,MBR运行效果稳定. 从图5(b)中的相似度树状图也可以看出,样品分成了两个明显的大组.
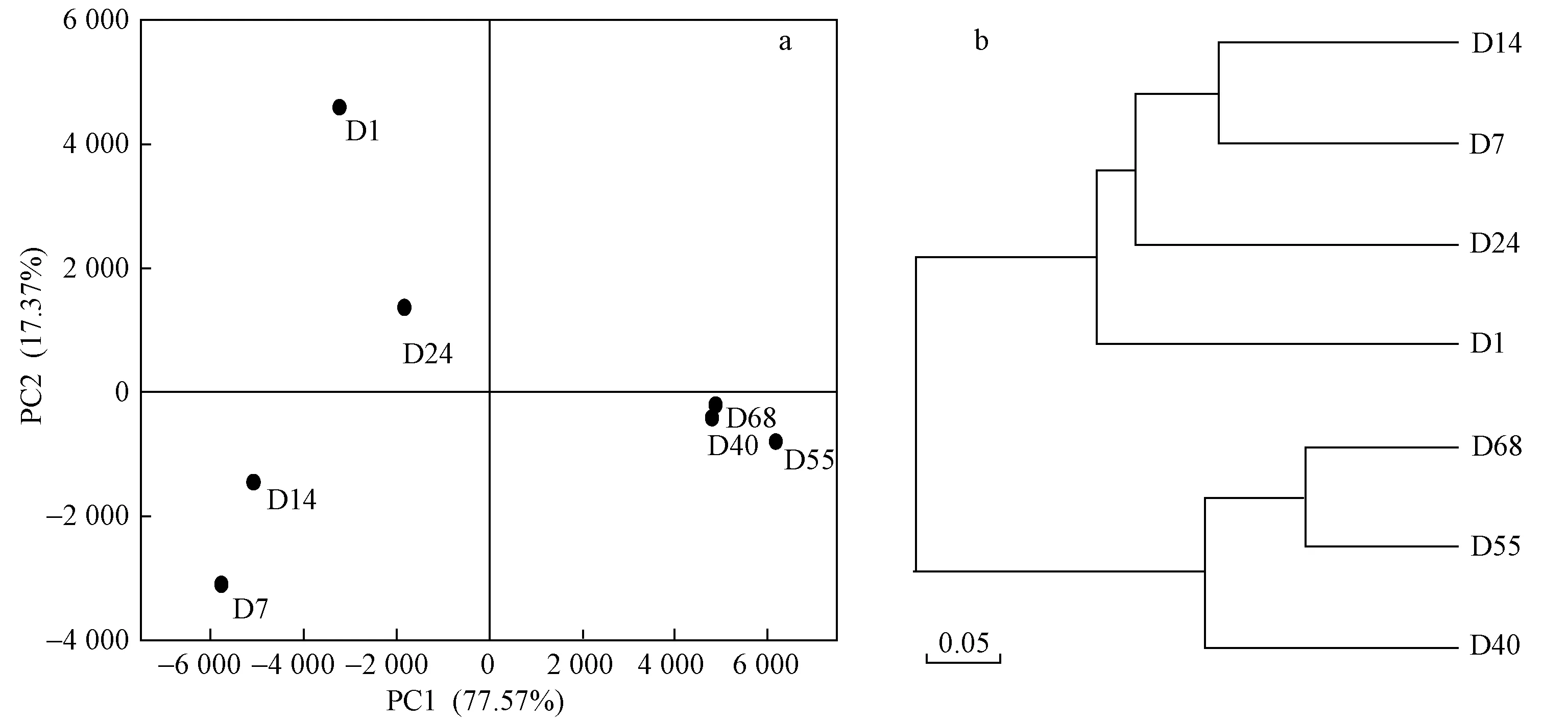
图5 各阶段微生物群落的主成分分析及相似度树状图Fig.5 The principal component analysis and similarity tree of sludge samples at different stages
2.4与SA降解相关的优势菌群分析
为了进一步分析与SA降解相关的优势菌种,分别对比7个样品在“门”和“科”层面上的微生物种群结构. 分析结果如图6所示,其中相对丰度为相应种群OTU数与各样品总OTU数的比值,在每个样品中相对丰度小于1%的细菌群落被划分为others. 7个样品中共检测拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、绿菌门(Chlorobia)、Parcubacteria、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、硝化螺旋菌门(Nitrospirae)、放线菌门(Actinobacteria)和Gracilibacteria 12个门. 其中,优势门(相对丰度>10%)为拟杆菌门、变形菌门和绿菌门,三种门总丰度保持为87.92%~93.69%. 虽然众多研究[8- 10,18- 19]表明,能以SA为唯一碳源和能源生长的菌种大部分为变形菌门,但是在该研究中,拟杆菌门相对丰度随着驯化过程逐渐增大(由12%升至54%左右),而变形菌门则逐渐减少(由63%降至27%左右),研究[20]表明,拟杆菌门类微生物更适宜在厌氧发酵的环境中存活,因此,可能是因为该研究中低ρ(DO)环境更适合拟杆菌的生长,并且存在能降解SA或其转化物的菌种. 绿菌门相对丰度的变幅不如前两个明显,由13%降至6%左右. 此外,Parcubacteria、疣微菌门和浮霉菌门的相对丰度有1%~2%的增加,而绿弯菌门、酸杆菌门、厚壁菌门、硝化螺旋菌门和放线菌门的丰度有1%以内的下降.

图6 各阶段污泥样品门水平和科水平的细菌变化情况Fig.6 The distribution on phylum and family of sludge samples
将个7样品中的微生物继续细分至细菌科可以更好地了解微生物在MBR中的功能. 相对丰度大于1%的细菌科共鉴定出27个,其中主要细菌科(相对丰度>10%)为噬几丁质菌科(Chitinophagaceae)、腐螺旋菌科(Saprospiraceae)、红环菌科(Rhodocyclaceae)、丛毛单胞菌科(Comamonadaceae)和拜叶林克氏菌科(Beijerinckiaceae)5个,其相对丰度之和为55.13%~67.90%. 其中,噬几丁质菌科随着驯化时间的延长相对丰度逐渐升高(由0.73%升至27.06%),成为最主要的微生物菌种,研究表明噬几丁质菌科普遍存在于工业废水处理系统中[21],在焦化废水(主要成分为苯酚)处理中是一种优势菌群[22],噬几丁质菌科的某些菌种可能能降解某些苯系物,而这些苯系物可能是SA降解的中间产物. 腐螺旋菌科在整个驯化过程中的相对丰度变化不大,其可分泌胞外聚合物,代谢葡萄糖、半乳糖、醋酸盐等[23]. 红环菌科的细菌,包括Thauera、Azoarcus和其他属的细菌经常在废水处理反硝化反应器群落中被发现[24],在试验过程中相对丰度由22%降至7%左右,降幅较大. 拜叶林克氏菌科相对丰度也由10%降至3%左右. 而具有降解芳香族化合物能力的丛毛单胞菌科细菌[25- 26]的相对丰度虽然由12%降至3%左右,但是丛毛单胞菌科中的氢噬胞菌属(Hydrogenophaga)却由0.2%升至2%,有研究[6- 8]表明,氢噬胞菌属中的某些菌种可以将SA降解为4-磺酸基-儿茶酚,是SA降解的一种常见的细菌,在SA的转化降解过程中发挥重要的作用. 此外,噬胞菌科和黄杆菌科相对丰度分别有大约6%和4%的上升,而疣微菌纲、硝化螺旋菌等则有约1%的下降.
3 结论
a) 曝气强度为72 m3(m2·h),运行通量为20 L(m2·h) 时,超滤膜的清洗周期大约为30 d.
b) 在HRT为2 h的条件下,出水ρ(SA)在第31天降至0.5 mgL以下并保持稳定,驯化过程结束. 运行过程中对NH4+-N、CODCr、TN和TP的去除率分别为91.94%±8.80%、87.63%±5.95%、32.38%±11.6%和85.69%±13.82%.
c) 通过对驯化阶段以及稳定运行阶段时生物反应区污泥进行微生物菌群分析发现,拟杆菌门为处理含SA废水的优势菌门,而噬几丁质菌科是主要的优势菌科.
[1] PEREI K,RAKHELY G,KISS I,etal.Biodegradation of sulfanilic acid byPseudomonaspaucimobillis[J].Applied and Environmental Microbiology,2001,55(1):101- 107.
[2] COUGHLIN M F,KINKLE B K,TEPPER A,etal.Characterization of aerobic azo dye-degrading bacteria and their activity in biofilms[J].Water Science and Technology,1997,36(1):215- 220.
[3] RIU J,SCHONSEE I,BARCELO D,etal.Determination of sulphonated azo dyes in water and wastewater[J].Trends in Analytical Chemistry,1997,16(7):405- 419.
[4] TOPAC F O,DINDAR E U,CAROGLU S,etal.Effect of a sulfonated azo dye and sulfanilic acid on nitrogen transformation[J].Journal of Hazardous Materials,2009,170(23):1006- 1013.
[5] CHUNG K T,CEMIGLIA C E.Mutagenicity of azo dyes: structure-activity relationships[J].Mutation Research,1992,277(3):201- 220.
[6] FEIGEL B J,KNACKMUSS H J.Bacterial catabolism of sulfanilic acid via catecho- 4-sulfonic[J].FEMS Microbiology Letters,1988,55(1):113- 118.
[7] FEIGEL B J,KNACKMUSS H J.Syntrophic interactions during degradation of 4-aminobenzenesulfonic acid by a two species bacterial culture[J].Archives of Microbiology,1993,159(2):124- 130.
[8] GAN H M,SHAHIR S,IBRAHIM Z,etal.Biodegradation of 4-aminobenzenesulfonate byRalstoniasp.PBA andHydrogenophagasp.PBC isolated from textile wastewater treatment plant[J].Chemosphere,2011,82(4):507- 513.
[9] CHEN Gang,CHENG Kayu,MANEESHA G,etal.Aerobic degradation of sulfanilic acid biodegradation using activated sludge[J].Water Research,2012,46(1):145- 151.
[10] UEDA T,HATA K.Domestic wastewater treatment by a submerged membrane bioreactor with gravitational filtration[J].Water Research,1999,33(12):2888- 2892.
[11] HUANG Jian,WANG Zhiwei,ZHANG Junyao,etal.A novel composite conductive microfiltration membrane and its anti-fouling performance with an external electric field in membrane bioreactors[J].Scientific Reports,2015,5:9268.
[12] LE CLECH P,JEFFERSON B,CHANG I S,etal.Critical flux determination by the flux-step method in a submerged membrane bioreactor[J].Journal of Membrane Science,2003,227(12):81- 93.
[13] 国家环境保护总局.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[14] HAN Xiaomeng,WANG Zhiwei,ZHU Chaowei,etal.Effect of ultrasonic power density on extracting loosely bound and tightly bound extracellular polymeric substances[J].Desalination,2013,329(18):35- 40.
[15] FROLUND B,GRIEBE T,NIELSEN P H.Enzymatic-activity in the activated-sludge floc matrix[J].Applied Microbiology and Biotechnology,1995,43(4):755- 761.
[16] 荣宏伟,李健中,张可方.铜对活性污泥微生物活性影响研究[J].环境工程学报,2010,4(8):1709- 1713. RONG Hongwei,LI Jianzhong,ZHANG Kefang.Study on effects of copper on microbialactivity of activated sludge[J].Chinese Journal of Environmental Engineering,2010,4(8):1709- 1713.
[17] JUDD S J.The MBR book:principles and applications of membrane bioreactors in water and wastewater treatment[M].Oxford:Elsevier,2006.
[18] WANG Yanqing,ZHANG Jinsong,ZHOU Jiti,etal.Biodegradation of 4-aminobenzenesulfonate by a novelPannonibactersp.W1[J].Journal of Hazardous Materials,2009,169(123):1163- 1167.
[19] SINGH P,BIRKELAND N K,IYENGAR L,etal.Mineralization of 4-aminobenzenesulfonate (4-ABS) byAgrobacteriumsp.strain PNS- 1[J].Biodegradation,2006,17(6):495- 520.
[20] DUNCAN S H,SCOTT K P,RAMSAY A G,etal.Effects of alternative dietary substrates on competition between human colonic bacteria in an anaerobic fermentor system[J].Applied and Environmental Microbiology,2003,69(2):1136- 1142.
[21] WANG Xiaohui,HU Man,XIA Yu,etal.Pyrosequencing analysis of bacterial diversity in 14 wastewater treatment systems in China[J].Applied and Environmental Microbiology,2012,78(19):7042- 7047.
[22] MA Qiao,QU Yuanyuan,SHEN Wenli,etal.Bacterial community compositions of coking wastewater treatment plants in steel industry revealed by Illumina high-throughput sequencing[J].Bioresource Technology,2015,179:436- 443.
[23] 高大文,辛晓东.MBR膜污染过程中微生物群落结构与代谢产物分析[J].哈尔滨工业大学学报,2014,46(2):26- 32. GAO Dawen,XIN Xiaodong.Analysis of microbial community structure and metabolites during the MBR membrane fouling process[J].Journal of Harbin Institute of Technology,2014,46(2):26- 32.
[24] GINIGE M P,KELLER J,AND BLACKALL L.Investigation of an acetate-fed denitrifying microbial community by stable isotope probing,full-cycle rRNA analysis,and fluorescent in situ hybridization-microautoradiography[J].Applied and Environmental Microbiology,2005,71(12):8683- 8691.
[25] BOON N,GORIS J,DE VOS P,etal.Genetic diversity among 3-chloroaniline-and aniline-degrading strains of theComamonadaceae[J].Applied and Environmental Microbiology,2011,67(3):1107- 1115.
[26] KHAN S T,HORIBA Y,YAMAMOTO M,etal.Members of the familyComamonadaceaeas primary poly (3-hydroxybutyrate-co- 3-hydroxyvalerate)-degrading denitrifiers in activated sludge as revealed by a polyphasic approach[J].Applied and Environmental Microbiology,68(7):3206- 3214.
Sulfanilic Acid Biodegradation and Resulting Microbial Communities Using Membrane Bioreactor
YAN Kaili, ZHENG Junjian, WANG Zhiwei*, WU Zhichao
School of Environmental Science and Engineering, Tongji University, Shanghai 200092, China
A continuous-flow membrane bioreactor (MBR) was operated for the treatment of simulated wastewater containing 25 mg/L sulfanilic acid (SA) to study SA biodegradation. After 31 d acclimation period, SA was degraded completely, and the removal efficiencies of CODCr, NH4+-N, TN and TP were 87.63%±5.95%, 91.94%±8.80%, 32.38%±11.6%, and 85.69%±13.82%, respectively. At the same time, the microbial communities in the sludge of different phases were investigated. At the phylum level, Bacteroidetes, Proteobacteria and Chlorobia were found to be the main taxa in the reactor, and Bacteroidetes were the dominant phylum responsible for the SA degradation. At the family level, it was found that the microbial communities were dominated by Chitinophagaceae, Saprospiraceae, Rhodocyclaceae, Comamonadaceae and Beijerinckiaceae, and Chitinophagaceae became more dominant during long-term operation. The results showed that the good removal efficiency of SA, CODCr, NH4+-N and TP was achieved, and Bacteroidetes and Chitinophagaceae were the dominant phyla and families for the SA degradation, respectively.
sulfanilic acid; membrane bioreactor; microbial communities
2017-01-16
:2017-05-25
国家自然科学基金项目(51422811)
闫凯丽(1992-),女,河南林州人,kailiyan@163.com.
*责任作者,王志伟(1980-),男,河南商丘人,教授,博士,博导,主要从事污水处理与资源化研究,zwwang@tongji.edu.cn
X788
:1001- 6929(2017)09- 1433- 07
ADOI:10.13198/j.issn.1001- 6929.2017.02.76
闫凯丽,郑君健,王志伟,等.膜生物反应器降解对氨基苯磺酸的性能及微生物群落特征[J].环境科学研究,2017,30(9):1433- 1439.
YAN Kaili,ZHENG Junjian,WANG Zhiwei,etal.Sulfanilic acid biodegradation and resulting microbial communities using membrane bioreactor[J].Research of Environmental Sciences,2017,30(9):1433- 1439.

