万古霉素修饰磁性纳米粒子用于富集分离细菌的研究
饶大伟,伍 娇,陈仪轩,杨 坤
(四川大学 化学工程学院 资源与环境微生物实验室,四川 成都 610065)
万古霉素修饰磁性纳米粒子用于富集分离细菌的研究
饶大伟,伍 娇,陈仪轩,杨 坤*
(四川大学 化学工程学院 资源与环境微生物实验室,四川 成都 610065)
利用溶剂热合成法制备Fe3O4磁性纳米粒子,并以N-膦羧甲基)亚氨基二乙酸(PMIDA)为桥连接Fe3O4和万古霉素从而形成Fe3O4-PMIDA-Van 体系用以富集并检测致病菌,文中介绍了两种不同的Fe3O4磁粒表面修饰方法, 采用红外和Zeta电势对产物进行表征,并研究了其对革兰氏阴性菌大肠杆菌(E.coli)和革兰氏阳性菌肠球(Enterococcus)的吸附作用。最后通过 PCR检测的方法也确定磁粉富集菌体的有效性及。结果表明,该磁性纳米颗粒能在短时间内实现样品中细菌的富集,并且对菌体的吸附平衡可以用Langmuir吸附等温性进行描述,其对E. coli和Enterococcus的理论浓缩倍数分别高达2200和4000倍。
磁性纳米粒子;菌体富集;PMIDA;万古霉素
近年来,虽已经开发出众多精密的生物传感器和分析方法用于致病菌的检测[1-5],但现今致病菌检测方面的研究多重视检测方法和设备(微设备或生物传感器)的开发,却忽视了样品制备过程的重要性[6]。目前的检测手段在检测低浓度的 致病菌时,所需的富集培养时间较长,难以达到即时检测的目的。
磁性纳米粒子是近年发展起来的一种新型材料,由于具有超顺磁性,在环境中能达到快速分离的作用而在生物技术领域被越来越多的研究学者关注。万古霉素是一种糖肽类广谱抗生素,它对细菌有吸附作用主要是万古霉素与革兰氏阳性菌细胞壁表面末端D-Ala-D-Ala[7]部分,通过氢键来完成与革兰氏阳性菌的结合。因此为了结合以上两种优势,通过文献调研,我们发现有机磷酸分子(磷酸化合物、含磷化合物、次磷酸化合物及其衍生物)与金属氧化物、羟化物、磷酸盐相互之间有着强烈亲和作用[8],因此我们选择PMIDA(双甘膦)—廉价的磷酸偶联剂作为中间媒介,该分子中含有 1个磷酸基团和 2个羧基,当磷酸基团和纳米粒子形成紧密连接时,另一端的羧基与万古霉素的亚氨基和氨基在EDC和NHS催化下反应形成酰胺键,从而将 Fe3O4磁性纳米颗粒与万古霉素成功地结合在一起,形成Fe3O4-PMIDA-Van 体系。事实上,通过抗生素与致病菌之间的结合力来吸附菌体已经有很多的报道,而本论文优势在于合成方法简单、快速,成本低,并且也取得了可观的吸附效果,其对E. coli和Enterococcus的理论浓缩倍数分别高达2200和4000倍。
1 磁性Fe3O4-PMIDA-Van吸附菌体原理
图1展示了在磁性纳米粒子表面连接PMIDA以及万古霉素的全过程。其中PMIDA是一种廉价的膦酸偶联剂,有机膦酸分子(膦酸化合物、含磷化合物、次磷酸化合物和他们的衍生物)与金属氧化物、羟化物、碳酸盐、磷酸盐的有强烈亲和作用[8]该分子中含有1个磷酸基团和2个羧基。当磷酸基团与纳米粒子紧密相连时,另一端的-COOH使纳米粒子间产生静电排斥,这使得铁磁流体异常稳定,然后在EDC和NHS的催化下,PMIDA上的-COOH与表面含有-NH2的万古霉素发生酰化反应,从而连接到MNP-PMIDA体系上。得到万古霉素修饰的磁性纳米颗粒Fe3O4-PMIDA-Van。其原理合成图如图1。
2 实验部分
2.1 试剂与仪器
聚乙二醇 2000、聚乙二醇 6000、三氯化铁(FeCl3·6H2O)、无水乙酸钠、无水乙醇、氢氧化钠,以上几种药品均为分析纯,购买于成都市科龙化工试剂厂;N-(膦酰基甲基)亚氨基二乙酸(PMIDA)、2-(N-吗啡啉)乙磺酸(MES)、N-3二甲基氨丙基-N′-乙基碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS),以上药品也同为分析纯,购买于合肥博美生物科技有限责任公司,盐酸去甲基万古霉素(Van)、琼脂糖购买于biosharp公司,LB肉汤、营养肉汤购买于北京陆桥技术有限责任公司。实验用水均为无菌水。
傅里叶变换红外光谱仪,Z eta电位仪,ABI Veriti梯度PCR仪 9902(Applied Biosystems),多功能水平电泳槽 EPS600(Tanon);凝胶成像仪 JY04S-3E(北京君意东方电泳设备有限公司)。
2.2 (Fe3O4-PMIDA-Van)复合纳米粒子的合成
2.2.1 Fe3O4磁性纳米粒子的表面活化
采用溶剂热法制备取Fe3O4粒子,将FeCl3· 6H2O(2.7 g,10 mmol),无水乙酸钠(3.6 g)和聚乙二醇(1.0 g)加入乙二醇溶液(40 mL)中,待完全溶解,然后加入反应釜中,在200 ℃下反应8 h;将上步骤所得产物洗涤干燥处理后,取50 mg该粒子分散在1 mL去离子水中,加入NaOH(183 mg),PMIDA(250 mg),水浴条件下用超声波细胞粉碎机超声探头超声15 min(5s开/5s关,2 %,20 ℃),然后于摇床27℃保温振荡8 h后。分离洗涤出粒子,然后分散在1 mL MES(110 mmol/L,pH值=5)缓冲液中,得到表面活化磁粉(Fe3O4-PMIDA)。
2.2.2 万古霉素修饰表面活化的Fe3O4磁性纳米粒子(Fe3O4-PMIDA-Van)
方法一:向以上分散在MES(110 mmol/L,pH值=5)缓冲液中的表面活化磁粉Fe3O4-PMIDA中加入EDC(33 mg)和NHS(9.99 mg),于冰浴条件下用超声波细胞粉碎机探头超声3 min(2%, 5 s 开/5 s 关, 20 ℃)后,摇床27 ℃保温振荡1 h。然后用MES(110 mmol/L,pH值=5)缓冲液洗涤3次,重新分散于1 mL的MES(110 mmol/L,pH值=5)缓冲液中,加入万古霉素(50 mg),于27 ℃摇床保温振荡24 h。反应结束后,用去离子水洗涤,得到万古霉素修饰的磁性纳米颗粒(Fe3O4-PMIDA-Van)。
方法二:称取向1 mL MES(110 mmol/L,pH值=5)缓冲液中加入万古霉素(15 mg)和 EDC(15 mg),再加入分散于MES(110 mmol/L,pH值=5)缓冲液中Fe3O4-PMIDA混合液1 mL,于冰水浴条件下用超声波细胞粉碎机超声(2%,5 s 开/5 s 关,20 °C)15min后。再将以上反应液于普通超声20 min,放于27℃摇床中保温振荡反应 24 h。
2.3 Fe3O4-PMIDA-Van与菌体的吸附平衡实验
取20 μL Fe3O4-PMIDA-Van悬浮液与1mL不同细胞浓度的细菌稀释液(用高压灭菌蒸馏水制备)在管式旋转器上在室温下温育10min后,使用强磁铁将磁性颗粒与液相分离。记录吸附前(和磁分离后)的液相在600nm的光密度(OD)值,通过适当稀释在线性范围内检测所有光密度。基于吸附和磁分离前后的悬浮液中的细菌量的差计算吸附细菌的量。对于大肠杆菌,显示600 nm处的1 OD等同于2.5×1010CFU/mL,对于肠球菌,1OD = 6.4×109CFU/mL。通过将观察数据拟合到Langmuir方程获得吸附等温线:

(1)
其中:
q:每毫升磁球中吸附的菌体数(CFU/mL);c: 吸附平衡液相浓度(CFU/mL);kd:解离常数(CFU/mL);qmax:最大吸附量(CFU/mL)。
2.4 菌体的PCR检测实验
将培养了12 h的细菌培养物,通过高压灭菌的蒸馏水将大肠杆菌稀释成50至5×106CFU/mL,肠球菌稀释成的细菌稀释梯度1至105CFU/mL,每个菌体浓度的体积为3.6 mL,在添加Fe3O4-PMIDA-Van之前,①从每个管各自取90 μL样品于新试管,再向每只试管中加入10 μL 0.25 mol/L的NaOH溶液用于随后的PCR扩增;②向每只试管中加入20 μL(Fe3O4-PMIDA-Van)磁粉,吸附10 min后,取出上清液90 μL,加入10 μL 0.25 mol/L的已灭菌的NaOH溶液裂解菌液;③向上述步骤②小心地除去剩余的上清液后,回收每个管中的颗粒-细菌聚集体,并重悬于20μL的0.025 mol/L NaOH中;另外,20μL Fe3O4-PMIDA-Van悬浮液加入3.6 mL以上稀释所用的高压灭菌过的蒸馏水中,经过以上同样的处理方式来作为阴性对照。将以上三组菌液放于75 ℃中保温10min,使其裂解出DNA,使用强磁体从颗粒-细菌聚集体样品和阴性对照中除去磁性颗粒,小心转移上清液到干净的离心管,液体样品用作随后PCR扩增的模板。分别使用β-酰胺类抗生素的抗性基因Bla-TEM[9](FOR [5'-CATTTCCGTGTCGCCCTTATTC-3']和REV [5'-CGTTCATCCAT AGTTGCCTGAC-3'])和多粘菌素类抗性基因mcr-1[10](FOR [5'-CGGTCAGTCCGTTTGTTC-'3]和REV [5'- CTTGGTCGGTCTGTAGGG-3'])两个特异性引物对来扩增肠球菌和大肠杆菌选定的基因序列。其中Bla-TEM引物的PCR反应条件为94℃ 5min的初始变性,35个循环的94℃ 30s,60℃ 30s和72℃ 48s,最后在72℃延伸5min终止反应。mcr-1引物的PCR反应条件为94℃ 15min的初始变性,33个循环的94℃ 30s,60℃ 90s和72℃ 48s,最后在72℃延伸5min终止扩增。相应的PCR产物大小为800bp和309bp。扩增产物通过GelRed染色的琼脂糖凝胶电泳(1.5%(w / v)琼脂糖)检查。
3 结果与讨论
3.1 表征
通过FTIR检测Fe3O4-PMIDA-Van磁性粒子表面上的官能团,结果显示在图2中。图2A为Fe3O4的红外图谱,中心在594 cm-1的特征峰可以归因于Fe-O的伸缩振动。3400 cm-1出现的峰值为Fe3O4表面羟基的特征峰;相比于2A,2B在1050 cm-1左右出现了较明显的新吸收峰,推测为PMIDA叔胺结构C-N的振动吸收峰。并且B的整体吸收峰强度比A要有所增强,推测一方面为掺入新分子后Fe3O4纳米粒子的晶化率降低,另一方面为连接的PMIDA分子含有羟基和强电负性O原子,易在Fe3O4纳米粒子表面形成氢键,使化学键的极化程度增大,红外吸收峰强度增强;在修饰上万古霉素后,图2C中1224.87 cm-1和1188.92 cm-1,推测为芳基醚与脂肪基醚C-O-C的不对称伸缩振动峰,1040 cm-1为它们的对称伸缩振动峰;1641 cm-1处的较强峰和1550 cm-1附近的较弱峰推测分别为酰胺基Ⅰ带中C=O伸缩振动和N-H弯曲振动与酰胺基Ⅱ带C-N伸缩振动和N-H弯曲振动,上述结果表明,PMIDA成功的将万古霉素修饰到Fe3O4上形成Fe3O4-PMIDA-Van体系。而Zeta电势的实验结果(如表1)也印证了以上的结果,Fe3O4的Zeta电势为22.7 mV,主要是由于该用10 mmol/L的盐酸活化因此表现正电荷,而Fe3O4-PMIDA的Zeta电势-11.8 mV主要为修饰上PMIDA后,表面带有的-COO-显示出电负性, Fe3O4-PMIDA-Van的Zeta电势42.5 mV,可能是由于修饰上万古霉素表面的-NH2表现出正电势。以上结果都是在蒸馏水中测量。

表1 Fe3O4,Fe3O4-PMIDA和Fe3O4-PMIDA-Van(方法二)的电势
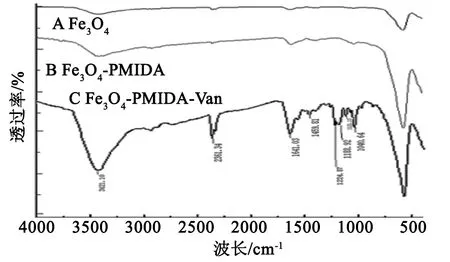
图2 Fe3O4,Fe3O4-PMIDA和Fe3O4-PMIDA-Van的红外图谱
Fig.2 Infrared spectra of Fe3O4,Fe3O4-PMIDA and Fe3O4-PMIDA-Van
3.2 细菌浓度的定量分析过程
我们观察到两种方法制备的Fe3O4-PMIDA-Van颗粒对大肠杆菌和肠球菌的吸附平衡很好的符合了Langmuir(公式1)模型。两种方法制备Fe3O4-PMIDA-Van颗粒对两种细菌的吸附参数总结在表2中,在吸附等温线的基础上,使用质量守恒分析来检查磁性细菌浓缩过程,可以估计其浓度程度。当菌液被稀释到低浓度时(比如c≤105),c值会比kd值小2个数量级,即c值相对于kd极小,可理解为kd+ c =kd,则Langmuir方程就可以被简化为:

(2)
而质量平衡可以表达为:
c0V1=cV1+qVs
(3)
c0:原始菌液的浓度(CFU/mL);V1:样品溶液的体积(mL);Vs:加入磁球的体积(mL)。
联立等式(2)、(3),可得:

(4)
所以,浓缩比q/C0可表达为:

(5)
其大小主要取决于磁球对细菌的吸附特性(qmax/kd)和固液两相的比(V1/Vs),
而当V1/Vs趋近于无穷大时,理论最大浓缩比q/c0=qmax/kd。

图3 方法一对大肠杆菌吸附数据拟合吸附等温线
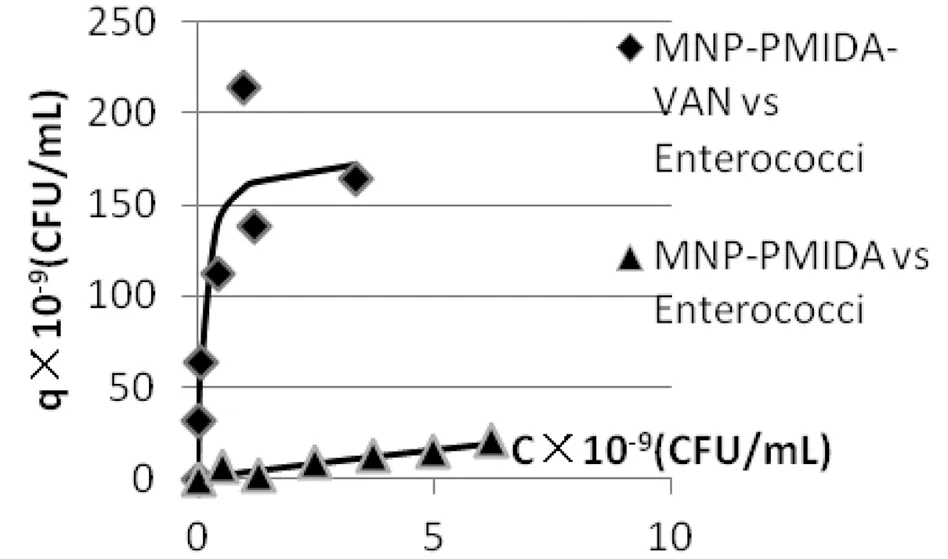
图4 方法一对肠球菌的吸附数据拟合吸附等温线

图5 法二对大肠杆菌和肠球菌的吸附数据拟合吸附等温线
由图3~5的数据处理可知,Fe3O4-PMIDA对两种菌的理论最高浓缩比分别约为12倍和4倍,可见其对于细菌几乎不存在吸附作用。而由方法一制得的Fe3O4-PMIDA-Van对大肠杆菌和肠球菌均表现出吸附作用。其中对大肠杆菌的理论最高浓缩倍数约2200倍,对肠球菌测理论最高浓缩倍数近1500倍,即方法一制得的Fe3O4-PMIDA-Van对大肠杆菌的吸附选择性强于肠球菌(表2)。而由方法二制得的Fe3O4-PMIDA-Van只对肠球菌表现出较强的吸附作用,理论最高浓缩比高达约4000倍;而对大肠杆菌的理论最高浓缩比仅约为500倍,方法二制得的Fe3O4-PMIDA-Van对肠球菌的吸附选择性强于大肠杆菌(表3)。

表2 方法一 Fe3O4-PMIDA-Van对细菌吸附朗缪尔等温线参数

表3 方法二 Fe3O4-PMIDA-Van对细菌吸附朗缪尔等温线参数
3.3 磁性吸附及PCR-Gel检测
使用方法一制备的Fe3O4-PMIDA-Van(Ⅰ)磁粉对大肠杆菌的水性样品进行磁性浓缩,随后进行PCR检测。通过琼脂糖凝胶电泳分析PCR产物,如图6所示。如凝胶中所示,在凝胶中都没有看到非特异性产物,说明引物设计和PCR条件是比较合理的。从前7个样品(泳道1至7),可以看出对于大肠杆菌,无磁性浓度的PCR扩增的检测限为约106CFU / mL。接下来的六个样品(泳道8至14)代表用Fe3O4-PMIDA-Van(Ⅰ)吸附后收集的上清液。测试的任何上清液中都没有检测到细菌,显然,通过Fe3O4-PMIDA-Van(Ⅰ)的大肠杆菌捕获效率非常高,在磁性浓缩(凝胶上的泳道15至21)后,分别将大肠杆菌的PCR扩增的检测限提高至104和103CFU / mL。而且比较前六个泳道和泳道15之间的条带强度,细菌浓度变化是显而易见的。
使用方法二制备的Fe3O4-PMIDA-Van(Ⅱ)磁粉对肠球菌的水性样品进行磁性浓缩后进行PCR,通过琼脂糖凝胶电泳分析PCR产物,如图7所示。从前7个样品(泳道1至7)和接下来的用Fe3O4-PMIDA-Van(Ⅱ)吸附后收集的上清液的7个样品(泳道8至14)测试中都没有检测到细菌,原因是原始样品的浓度稀释较低,未达到 PCR扩增检测不到的水平,但是,通过Fe3O4-PMIDA-Van(Ⅱ)磁性浓缩(凝胶上的泳道15至21)后,出现了两条较强条带,细菌浓度变化也是显而易见的。

其中1-6、8-13分别为原始菌液、磁粉吸附原始菌液之后上清液,15-20为吸附菌液的磁粉菌体,而7,14,21分别阴性对照
图6 Fe3O4-PMIDA-Van(Ⅰ)PCR分析
Fig.6 PCR analysis of Fe3O4-PMIDA-Van(Ⅰ)

其中1-6、8-13分别为原始菌液、磁粉吸附原始菌液之后上清液,15-20为吸附菌液之后的磁粉菌体,而7,14,21分别阴性对照
图7 Fe3O4-PMIDA-Van(Ⅱ)PCR分析
Fig.7 PCR analysis of Fe3O4-PMIDA-Van(Ⅱ)
4 讨论
以上的结果表示:方法一制得的Fe3O4-PMIDA-Van磁粒的细菌吸附实验结果表明此法制得的磁粒对大肠杆菌的吸附选择性强于肠球菌;而方法二的实验结果表明对肠球菌的吸附选择性强于大肠杆菌。方法一是先通过将已经制得的Fe3O4-PMIDA用EDC与其PMIDA结构中的羧基反应生成一种不稳定的脲衍生物中间物,再用NHS与该不稳定中间产物反应生成更稳定的酯化物而增强碳二亚胺交联产物的稳定性[10-11],防止其自身重排成相应的稳定的脲的副产物的方法获得Fe3O4-PMIDA活化后的中间体,再用万古霉素中的氨基和亚氨基进攻该中间体的O-异酰基脲结构形成酰胺交联最终生成Fe3O4-PMIDA-Van磁粒。而方法二是先将EDC与万古霉素溶解于MES缓冲液并混合一段时间,再将实验制得的Fe3O4-PMIDA加入混合液中以与方法一相同的原理进行反应,只是其中没有加入NHS。
针对以上实验结果,我们有如下猜测:
方法一制得的Fe3O4-PMIDA-Van磁粒对大肠杆菌的吸附选择性强于肠球菌可能是因为万古霉素的氨基与亚氨基主要集中在吸附革兰氏阳性菌的活性部位内部,而在万古霉素以固体形式溶解于已经充分活化的Fe3O4-PMIDA分散液时,该部位内的氨基与亚氨基与活化的中间体发生快速反应,导致大部分万古霉素以单分子的形式连接在磁粒表面且其活性部位因结构变化丧失活性。同时,以此方式连接的万古霉素朝向外侧的配糖基可能与革兰氏阴性菌表面的尚未探究清晰的不知名的受体相结合导致该法制得的磁粒对大肠杆菌的吸附选择性强于肠球菌;而据报道EDC也可用于活化磷酸酯基团[12],故推测过量的EDC使得PMIDA与Fe3O4所成的亚磷酸酯键断裂,最终导致该实验方案难以获得完整的Fe3O4-PMIDA-Van磁粒,这也可能是造成方法一中实验重复率较低的原因。
根据查阅的文献可知万古霉素吸附革兰氏阳性菌的原理为万古霉素的N端(N-甲基亮氨酸)、B-羟基氯代酪氨酸、天冬氨酸以及对羟基苯基甘氨酸中的4个NH聚合成簇与D-Ala-D-Ala的C-端羧基阴离子形成氢键,且N端N-甲基亮氨酸折叠形成一个疏水的腔体,加强了该氢键作用力[13],而本实验方法二所制备的磁粉对革兰氏阳性菌的非常良好的吸附作用原因可能有:1)在万古霉素溶解于MES缓冲溶液中,通过自身含有的大量氢键进行了自组装形成双聚体;同时,在EDC的催化作用下,万古霉素可能通过自身具有的羧基和氨基进行分子间的酰胺化反应形成二聚体甚至是多聚体。1998年,Williams[14]通过进一步的研究表明万古霉素二聚体的形成可大大提高万古霉素对革兰氏阳性菌的吸附作用,并且形成二聚体的万古霉素按照方法一里的方式连接在Fe3O4-PMIDA上后因不以单分子形式存在致使吸附部位仍具有活性,而配糖基中的氨基用于与其它万古霉素分子的羧基进行酰胺连接或背靠背形成双聚体的话可能导致配糖基无法用于吸附革兰氏阴性菌的未知受体,最终导致方法二制得的Fe3O4-PMIDA-Van磁粒对革兰氏阴性菌吸附能力大大减弱[14-15];2)方法二中EDC可能首先与万古霉素反应消耗了一定量。并且在Fe3O4-PMIDA加入后,由于反应的难易程度,EDC可能选择与羧基先进行反应进而催化Fe3O4-PMIDA与万古霉素的酰胺化反应,没有足够的时间和浓度继续催化Fe3O4-PMIDA亚磷酸酯基断裂,使完整Fe3O4-PMIDA-Van形成的可能性大大增加;3)据报道,由于万古霉素的过度使用,细菌糖蛋白合成启动子C-端(D-Ala-D-Ala)经自身修饰部分变成D-Ala-D-Lactate,即以酯键代替酰胺键。酰胺键与酯键的转换不仅导致一个氢键的减少,而且D-Ala-D-Lactate的酯氧原子与万古霉素的对羟基苯基甘氨酸的羰氧原子之间的排斥作用使万古霉素与胞壁酰五肽作用大大减弱。对于该类万古霉素耐药革兰氏阳性菌而言,EDC可能与万古霉素的对羟基苯基甘氨酸的羧基进行反应生成不稳定的脲衍生物中间物,而方法二中并未加入NHS,不稳定的脲衍生物中间物进而自身重排成相应的稳定的脲的副产物,该脲副产物中包含的许多酰胺键的-NH-可能与D-Ala-D-Lactate的酯氧原子形成氢键,提高万古霉素对革兰氏阳性耐药菌的吸附能力。
5 结论
本篇文章运用了一种简单、快速、廉价、对环境友好的合成方法,用PMIDA在磁性纳米粒子表面引入活性集团,再在EDC和NHS催化下与万古霉素连接,形成Fe3O4-PMIDA-Van体系,用以吸附革兰氏阴性菌大肠杆菌和革兰氏阳性菌肠球菌,通过实验和理论分析表明,经修饰后的磁性纳米粒子富集菌体稀释液,可以将PCR检测灵敏度提高两到三个数量级。此种磁性纳米粒子用在菌体的磁性分离中,可用于在短时间内提高样品中的菌浓度,大大缩短检测时间,总体上,我们的研究表明本方法制备的磁粉和PCR检测提供了一种吸引人的替代免疫磁性分离/PCR改进农业和食品生物技术应用的病原体检测。
[1] Lazcka O,Del Campo F J,Munoz F X.Pathogen detection: a perspective of traditional methods and biosensors[J].Biosens Bioelectron,2007,22:1205-1217.
[2] Palchetti I,Mascini M.Electroanalytical biosensors and their potential for food pathogen and toxin detection[J].Anal Bioanal Chem,2008,391:455-471.
[3] Morris B A,Sadana A.A fractal analysis of pathogen detection by biosensors[J].Biophys Chem,2005,113:67-81.
[4] Kim D K,Yoo S M,Park T J,et al.Plasmonic properties of the multispot copper-capped nanoparticle array chip and its application to optical biosensors for pathogen detection of multiplex DNAs[J].Anal Chem,2011,83:6215-6222.
[5] Cho I H,Irudayaraj J.In-situ immuno-gold nanoparticle network ELISA biosensors for pathogen detection[J].Int J Food Microbiol,2013,164:70-75.
[6] Brehm-Stecher B,Young C,Jaykus L A,et al.Sample preparation: the forgotten beginning[J].J Food Prot,2009,72:1774-1789.
[7] Walsh C. Microbiology-deconstructing vancomycin[J]. Science,1999,284(5413):442-443.
[8] Mutin P H,Guerrero G,Vioux A.Hybrid materials from organophosphorus coupling molecules[J].Journal of Materials Chemistry,2005,15(35-36):3761-3768.
[9] Liu Y Y,Wang Y,Walsh T R,et al. Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study[J].Lancet Infectious Diseases,2016,16(2):161-168.
[10] Lee J M,Edwards H H L,Pereira C A,et al.Crosslinking of tissue-derived biomaterials in 1-ethyl-3-(3-dimethyl-aminopropyl)-carbodiimide(EDC)[J]. J Biomed Med,1996,7(9):531-541.
[11] Olde D L H,Dijkstra P J,Van Luyn M J,et al.Cross-linked of dermal sheep collagen using a water-soluble carbodiimde[J].Biomaterials,1996,17(8):765-773.
[12] 喻 平,胡泉源,祁小云,等.EDC在有机合成中的应用研究进展[J].广州化工,2011(8):9-11,23.
[13] Pearce C M,Gerhard U,Williams D H.Ligands whichbind weakly to vancomycin:studies by13C NMR spectroscopy[J].Journal of the Chemical Society,1995,12(1):159-162.
[14] Dancer R J,Try A C,Sharman G J,et al.Binding of a vancomycin group antibiotic to a cell wall analogue from vancomycin-resistant bacteria[J].Chemical Communications,1996,12:1445-1446.
[15] Konrad Bleicher,Mengfen Lin,And M J S,et al.Diffusion edited NMR: screening compound mixtures by affinity NMR to detect binding ligands to vancomycin[J].Journal of Organic Chemistry,1998,63(23):8486-8490.
(本文文献格式:饶大伟,伍 娇,陈仪轩,等.万古霉素修饰磁性纳米粒子用于富集分离细菌的研究[J].山东化工,2017,46(11):42-46.)
Vancomycin-modified Magnetic Nanoparticles and the Endowed Bacteria Enrichment Capacity
RaoDawei,WuJiao,ChenYixuan,YangKun*
(College of Chemical Engineering,Sichuan University,Chengdu 610065,China)
In this study,magnetic Fe3O4nanoparticles were synthesized by solvent thermal synthesis method,followed by modifying the surface of Fe3O4nanoparticles containing hydroxyl using phosphonomethyl iminodiacetic acid,thus the formation of Fe-O-P bonds tightly fixed to the magnetic surface of the nanoparticles to successfully introduce -COOH. The s
Table surface functionalized nanoparticles were further linked with vancomycin (Van) for the enrichment of bacteria.Then the shape and structure of Fe3O4-PMIDA-Van Composite Nanoparticles were characterized by using a transmission electron microscope (TEM) .The adsorption capacity of the Van modified MNPs to gram-negative (E. coli) and gram-positive (Enterococcus)bacteria were determined,respectively. These result demonstrated that surface modified nanoparticles exhibited high affinity to bacteria,which could realize fast enrichment of bacteria from samples .And adsorption isotherms were obtained by fitting observed data to the Langmuir equation. In the case of bacteria concentration with the MNPs,the theoretical highest concentration ratio were calculated to be 2300 and 1300 for E. coli and Enterococcus,respectively.
magnetic nanoparticles;bacteria enrichment;PMIDA;Van
2017-04-07
国家自然科学基金(11375123)
饶大伟(1990—),男,硕士在读,主要从事化学与生物工程研究;*通讯作者:杨 坤,副教授。
TQ138.1
A
1008-021X(2017)11-0042-05

