农杆菌介导FaCBL1基因转化红颜草莓的研究
王全智+魏跃

摘要:为了建立草莓品种红颜(Fragaria×ananassa Duch. Benihoppe)的高效稳定转基因体系,以草莓红颜组培苗的叶片作为试验材料,对影响基因的因子进行优化,获得稳定高效的转基因体系。结果表明,农杆菌菌液D600 nm=0.4、侵染时间20 min、培养3 d后草莓抗性芽诱导率较高。用350 mg/L羧苄青霉素(carbenicillin,简称Cb)作为抑菌抗生素能够有效抑制农杆菌而不伤害草莓叶片;用20 mg/L卡那霉素(kanamycin,简称Kan)作为筛选抗生素能够尽可能多的去除非抗性芽。荧光定量PCR检测结果表明,草莓FaCBL1基因已经成功转入草莓基因组中。
关键词:农杆菌;草莓;FaCBL1基因;转化
中图分类号: S668.401文献标志码: A文章编号:1002-1302(2017)12-0039-03
E-mail:1109238212@qq.com。八倍体栽培草莓品种红颜(Fragaria×ananassa Duch. Benihoppe)是由日本引入我国栽培的优良品种,该品种果实果形正,鲜食口感好,丰产性好,品质优良,适于设施栽培,目前已经成为我国栽培面积较大的一个品种,尤其是在江、浙地区,栽培面积较大,占草莓总栽培面积的50%以上。但是由于该品种耐储性差,货架期短,而且该品种抗病性差,育苗过程极易感染炭疽病,成苗率低,设施栽培过程中容易感染白粉病和灰霉病。因此,亟待对该品种进行改良,而传统的育种方法周期长,见效慢。近年来,由于转基因技术在作物品种改良中的广泛应用,也有多项关于草莓基因改良的报道。因此,用分子育种的方法改良草莓基因在未来草莓产业的发展中是一条必经之路,能够为草莓分子育种开辟一条新途径,对红颜草莓的推广种植和提高红颜草莓生产的经济效益有重要的意义。
钙调磷酸酶B类似蛋白(calcineurin B-like,简称CBL)是在植物抗逆中起着重要作用的一类基因家族。其中CBL1基因在抗逆以及果树果实发育、品质形成等方面都有重要的作用[1]。而草莓果实的发育是果树学科研究的重要问题之一,研究草莓果实成熟发育对培育草莓优良品种有重要意义,因此,研究草莓FaCBL1基因在草莓果实发育中的作用及其功能是未来草莓分子生物学研究中的一条重要途径[2]。而基因功能的验证有赖于一个高效稳定的遗传转化体系。因此,建立一个高效稳定的FaCBL1基因遗传转化体系,能够为探讨逆境相关基因在果实发育中的作用奠定一个良好的基础。
1材料与方法
1.1试验材料
试验选用草莓品种红颜组培苗,由江苏农林职业技术学院农学园艺系组织培养实验室保存。组培苗在MS+0.5 mg/L BA+0.1 mg/L NAA的培养基上继代培养备用。取草莓叶片剪去叶尖和叶缘,将叶片剪成3 mm×3 mm的叶块备用。
1.2菌株、载体和基因
本试验所用农杆菌(Agrobacterium tumefaciens)是GV3101,由江苏现代园艺工程技术中心实验室保存。GV3101含有植物表达载体pK7WG2D,该载体上含有的目的基因是FaCBL1基因,并带有β-葡糖苷酸酶基因(GUS)和卡那霉素(Kan)抗性的新霉素磷酸转移酶基因(nptⅡ)。
1.3培养基及培养条件
共培养培养基(G1):MS+4.0 mg/L 6-BA+0.2 mg/L IBA;筛选培养基(G2):MS+4.0 mg/L 6-BA+0.2 mg/L IBA+20 mg/L Kan+350 mg/L Cb;伸长培养基(G3):MS+0.5 mg/L 6-BA+0.1 mg/L NAA+20 mg/L Kan+350 mg/L Cb;生根培养基(G4):MS+0.1 mg/L IBA+25 mg/L Kan+300 mg/L Cb。所有培养基中均附加琼脂7 g/L、蔗糖30 g/L。培养条件为光—暗周期16 h—8 h,光照度2 000~3 000 lx,温度23~25 ℃。培养55 d后统计数据。
1.4转基因方法
1.4.1农杆菌的培养将保存的菌转移到附加100 mg/L壮观霉素的LB固体培养基上,28 ℃倒置培养2~3 d,长出单菌落后,挑取单菌落放于附加100 mg/L壮观霉素的LB液体培养基中,28 ℃振荡培养至菌液D600 nm为0.8~1.2,室温下 5 000 r/min 离心10 min,收集菌体并用新鲜的MS液体培养基活化菌体。
1.4.2葉片转化方法首先将叶片剪到新鲜的MS液体中,剪好后放在活化好的液体菌液中侵染,侵染以后的叶片用无菌滤纸吸干表面残留的菌液后接种于G1培养基上共培养。共培养结束后,将外植体转入G2筛选培养基上进行选择培养和再生,28 d后更换1次新的筛选培养基,待抗性芽长出后,将抗性芽转入G3伸长培养基上生长,40 d后,将抗性芽从茎基部切下,转入G4生根培养基上生根,获得完整的抗性苗。
1.4.3植物筛选抗生素浓度的确定将叶片分别接种于含有Kan浓度为10、15、20、25 mg/L的G1培养基上,暗培养 14 d 后转至光下再培养30 d,统计叶片褐化率、愈伤形成率和不定芽再生率,确定最适的Kan浓度。
1.4.4抑制农杆菌抗生素浓度的选择将共培养后的叶片分别接种于含有Cb浓度为200、350、500 mg/L的G1培养基上,经暗培养14 d,筛选培养至40 d后,观察农杆菌的抑菌程度并确定最适的Cb浓度。
1.4.5菌液浓度、侵染时间、共培养时间的优化选择培养菌液的D600 nm分别设为0.1、0.2、0.3、0.4、0.5、0.6;叶片的浸染时间分别设为10、15、20、25、30 min;共培养时间分别设为1、2、3、4、5 d;确定最佳的菌液浓度、侵染时间、共培养时间。endprint
1.5评价指标与数据调查
用GUS基因的瞬时表达率来选择最佳的菌液浓度、侵染时间、共培养时间。GUS瞬时表达率=(显示蓝色的叶片数/所剪的总叶片数)×100%。
1.6转FaCBL1基因草莓植株的检测
1.6.1检测方法
1.6.1.1GUS染色转化过程中获得的抗性芽长出叶片后,剪取3 mm×3 mm的叶块装于含GUS染色液的离心管中,于37 ℃培养箱中进行GUS组织染色,16~24 h后取出叶片,用70%乙醇脱色,至叶片中的叶绿素完全脱除为止。叶绿素脱除干净后,叶片显示蓝色的为转基因植株,显示白色的为非转基因植株。
1.6.1.2荧光定量PCR检测提取转基因植株和对照植株总RNA进行反转录获得cDNA,采用实时荧光定量PCR(real-time quantitative PCR,简称RT-qPCR)的方法,检测基因的相对表达量。相关基因和内标Actin基因RT-qPCR扩增的总反应体系为20 μL,包括10 μL SYBR premix Ex Taq混合液,2 μL cDNA,1 μL上游引物(10 μmol/L),1 μL下游引物(10 μmol/L),6 μL无核酸污染的灭菌水。反应程序:94 ℃ 预变性2 min,94 ℃变性20 s,55 ℃退火30 s,72 ℃延伸30 s,40个循环,每次循环的第3步进行荧光采集。最后从 60 ℃ 升温至95 ℃,每隔30 s上升0.5 ℃,共71个循环。检测其荧光值,绘制熔点曲线。标准品cDNA和待测样品均设置3次重复。
2结果与分析
2.1卡那霉素浓度对草莓转化的影响
转基因植物筛选抗生素的浓度应当是在不伤害植物本身的情况下能够长愈伤,而不能够诱导过多的芽,因此叶片接种于不同浓度Kan的培养基中培养30 d后,需要统计叶片的黄化率和白化率。随着培养基中Kan浓度的增加,外植体失绿、黄化、皱褶、坏死的现象加重,当Kan浓度达到30 mg/L时,外植体黄化,而且没有再生芽,可见Kan对转化外植体再生率有很大影响。由图1可知,在Kan浓度为20 mg/L时,叶片褐化率达到75%,有一定数量的愈伤组织形成,但是有少量不定芽生成。因此,Kan浓度达到20 mg/L时能够部分抑制草莓不定芽的再生,可作为草莓转基因过程中植物筛选抗生素Kan的最佳浓度。
2.2羧苄青霉素浓度对草莓转化的影响
本试验使用转基因中常用的Cb抗生素抑制农杆菌,Cb对草莓的再生会产生一定的影响。低浓度的Cb在转基因初期一般都能够抑制大部分农杆菌的生长,但在后期移至光下培养时不能够很好地抑制农杆菌的生长。本试验中,在Cb浓度为350 mg/L时可以完全抑制农杆菌的生长,而且对草莓外植体的再生率影响不大。因此,可以用选用Cb浓度为 350 mg/L 作为抑制培养基中农杆菌生长的最佳浓度。
2.3菌液浓度、侵染时间、共培养时间的选择
由图2可知,菌液D600 nm在0.1~0.4之间时,随D600 nm的增加,GUS瞬时表达率随之上升;在D600 nm=0.4时,GUS瞬时表达率最高。菌液浓度过高会导致叶片切口处褐化,外植体容易死亡;浓度过低农杆菌数目不足,会使转化效率降低。因此,D600 nm=0.4时菌液浓度为最佳。
由图3可知,随侵染时间的增加,GUS瞬时表达率随之上升,侵染外植体20 min时,GUS瞬时表达率达到最高值。侵染时间过长,外植体容易褐化变烂。因此,最佳侵染时间选为20 min。
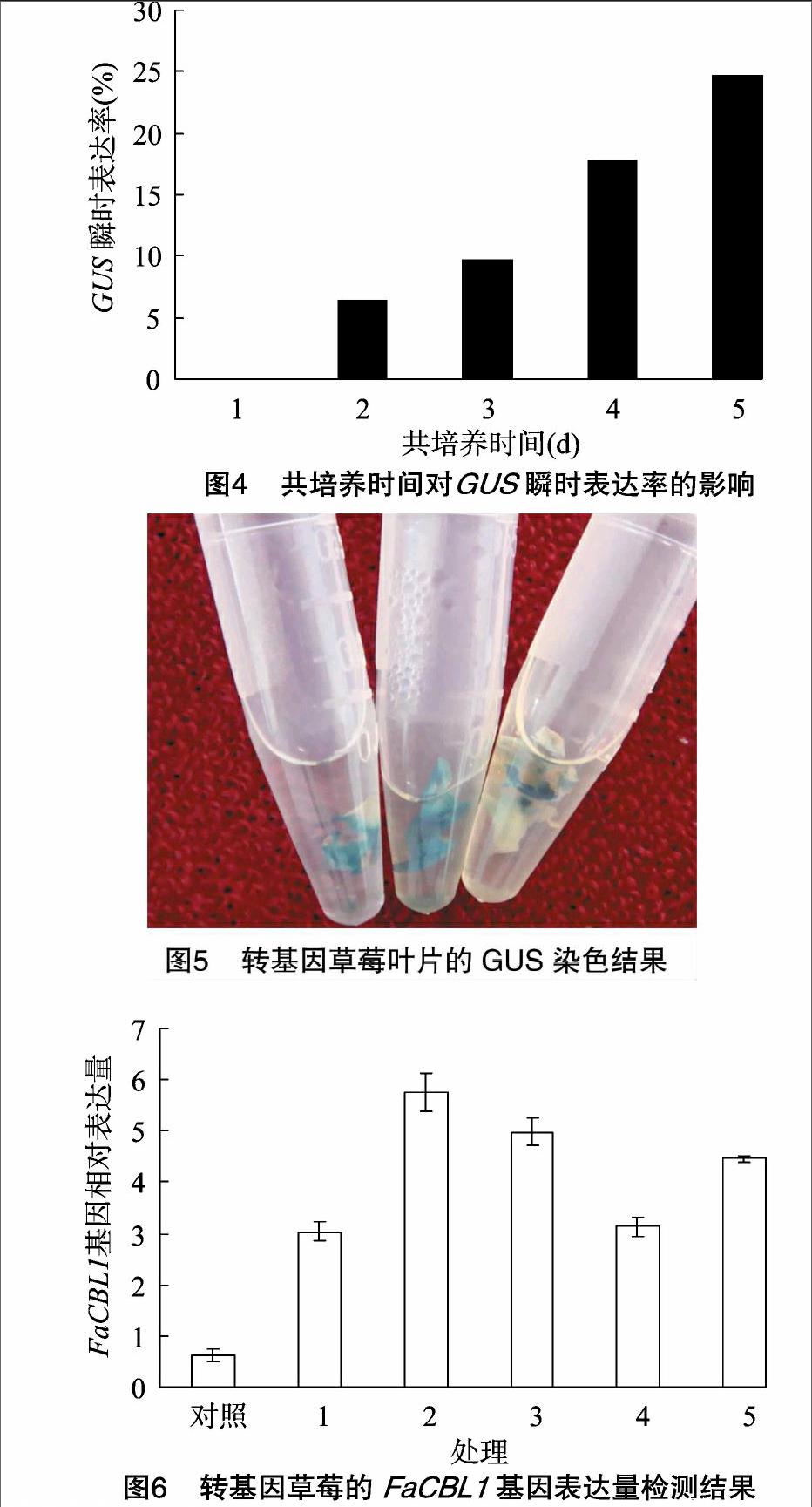
由图4可知,外植体在共培养2 d时开始有GUS瞬时表达,随着共培养时间的加长,GUS瞬时表达率逐渐升高,但是在共培养4 d时农桿菌的生长已经很难被抑制。因此,以共培养3 d为最佳。
2.4抗性芽的伸长、生根
将生长健壮的抗性芽转入伸长培养基中,抗性芽能很好地长大、增殖。将增殖的抗性苗分株,单株放入生根培养基中可以正常生根,生根率达到90%以上。
2.5转基因植株的GUS组织化学染色检测
通过根癌农杆菌介导FaCBL1基因转红颜草莓,共获得8株转基因植株,其中5株GUS阳性植株,GUS染色鉴定的部分结果如图5所示。
2.6转基因草莓植株的荧光定量PCR检测
对GUS染色为阳性的5株草莓转基因植株进行荧光定量PCR检测。提取PCR阳性植株和阴性对照植株的总RNA,以其为模板进行反转录,再以反转录合成的cDNA第1链为模板进行荧光定量PCR扩增。由图6可知,5个转基因株系的FaCBL1基因与对照相比都有较高的表达量,且均高于对照,说明基因已经完全转入草莓中。
3讨论
草莓作为一种兼具观赏和高营养价值的水果,目前在国内外的种植面积日益增加。尤其在我国,随着观光农业的不断发展,种植草莓将会是我国观光农业发展的一项重要经济收入。目前,我国江、浙、沪地区的城郊已经开始大面积种植草莓,集观光旅游于一体,还能够增加农民的收入。
基因工程的不断发展为草莓育种提供了新的技术手段,可以针对草莓栽培中不能够解决或者难以解决的问题有目的地对草莓进行基因改良,而不改变草莓原有的特性。目前在草莓的转基因中,最常用的方法就是农杆菌转化法,这个方法操作较为简单,但是转化效率低、转化重复性差。本试验通过转化方法的优化,建立了一个高效稳定的基因转化体系,对影响遗传转化的因素进行了优化。
基因转化中要使用选择性抗生素有效地筛选转化成功的细胞。本试验中所用的载体上带有的筛选基因标记是Kan,关于Kan的浓度已经有许多的研究报道[3-4],在草莓的遗传转化中Kan的浓度一般在20~30 mg/L之间[5],本试验中选择Kan的最佳浓度为20 mg/L。
农杆菌介导法中为了抑制农杆菌常用Cb作为抑菌性抗生素,本试验对3种Cb浓度作了比较,结果表明,使用 350 mg/L Cb可以有效抑制农杆菌的生长而对外植体造成的伤害不大。这与其他研究者得出的结论[6-8]不同,可能是由于菌株不同或者菌株活性不同,所用抗生素种类以及浓度也有所不同[9]所致。endprint
菌液的浓度和侵染时间对遗传转化有很大的影响,菌液浓度过高,对植物材料的毒害较大,容易导致外植体褐化、坏死,而且后期用抑菌抗生素除菌也很困难;菌液浓度过低,农杆菌数目不多,侵染能力较弱,转化效率也就降低,因此要选择适宜的菌液浓度才能有效地提高转化效率。侵染时间过长容易导致外植体中毒死亡,侵染时间太短,农杆菌不能充分被受伤细胞吸收,转化效率较低,因此,掌握好侵染时间有助于提高遗传转化率。本试验结果表明,D600 nm=0.4时的菌液浓度侵染外植体20 min效果最佳,这与张红梅等的结论[10-13]一致。
本试验通过优化一系列的转化条件,建立起一个稳定有效的转基因体系,能够为今后草莓的基因改良提供借鉴。
参考文献:
[1]蒋天梅,殷学仁,王平,等. 乙烯调控非跃变型果实成熟衰老研究进展[J]. 园艺学报,2011,38(2):371-378.
[2]张勇,汤浩茹,罗娅,等. 草莓FaCBF1基因的克隆及表达分析[J]. 园艺学报,2014,41(2):240-248.
[3]张志宏,吴禄平. 草莓主栽品种Tudla遗传转化体系的建立[J]. 農业生物技术学报,1998,6(2):200-204.
[4]金万梅,尹淑萍,鲁韧强,等. GO基因对草莓遗传转化及抗病性鉴定[J]. 分子植物育种,2005,3(6):797-800.
[5]秦永华,张上隆. 草莓转基因研究进展[J]. 遗传,2007,29(2):150-156.
[6]Mathews H,Wagoner W,Kellogg J,et al. Genetic transformation of strawberry:stable integration of a gene to control biosynthesis of ethylene[J]. In Vitro Cellular & Developmental Biology-Plant,1995,31(1):36-43.
[7]Oosumi T,Gruszewski H A,Blischak L A,et al. High-efficiency transformation of the diploid strawberry (Fragaria vesca) for functional genomics[J]. Planta,2006,223(6):1219.
[8]Barceló M,Elmansouri I,Mercado J A,et al. Regeneration and transformation via Agrobacterium tumefaciens of the strawberry cultivar Chandler[J]. Plant Cell,Tissue and Organ Culture,1998,54(1):29-36.
[9]金建凤,高强,陈勇,等. 转移拟南芥CBF1基因引起水稻植株脯氨酸含量提高[J]. 细胞生物学杂志,2005,27(1):73-76.
[10]张红梅,王俊丽. “全明星”草莓叶片遗传转化体系的建立[J]. 生物技术,2005,15(3):68-70.
[11]王俊丽,葛会波,彭士琪,等. 草莓外源LEAS基因的导入[J]. 园艺学报,2003,30(3):322-324.
[12]张志宏,吴禄平,代红艳,等. 草莓主栽品种再生和转化的研究[J]. 园艺学报,2001,28(3):189-193.
[13]那杰,王关林,夏然,等.endprint

