土壤杆菌K1026对樱桃冠瘿病病原菌的抑制作用及田间防治效果
魏艳丽, Ryder Maarten, 李纪顺, 扈进冬, 李红梅, 李金萍, 杨合同*
(1. 山东省科学院生态研究所, 山东省应用微生物重点实验室, 济南 250014; 2. 澳大利亚阿德莱德大学农业食品葡萄酒学院, 阿德莱德 5064; 3. 山东省科学院, 济南 250014)
土壤杆菌K1026对樱桃冠瘿病病原菌的抑制作用及田间防治效果
魏艳丽1, Ryder Maarten2, 李纪顺1, 扈进冬1, 李红梅1, 李金萍3, 杨合同1*
(1. 山东省科学院生态研究所, 山东省应用微生物重点实验室, 济南 250014; 2. 澳大利亚阿德莱德大学农业食品葡萄酒学院, 阿德莱德 5064; 3. 山东省科学院, 济南 250014)
由致病性根癌土壤杆菌Agrobacteriumspp.侵染引起的根癌病对樱桃等果树生产造成严重的影响。利用双层平板、胡萝卜圆盘法和接种指示植物番茄等方法验证了澳洲生防菌株K1026对2种不同原生物型樱桃冠瘿病病原菌的抑制作用;检测了不同接种时间对病原菌侵染产生瘤状组织的影响,结果显示提前或者在病原菌接种后20 h内接种K1026可抑制胡萝卜产生瘤状组织;研究了K1026对大樱桃根癌病的作用机制是产生土壤杆菌素和竞争附着位点;田间试验表明K1026蘸根处理,对‘中国樱桃’株系冠瘿病的防治效果达81.61%,使发病率降低至18.13%。
冠瘿病; 土壤杆菌K1026; 土壤杆菌素; 生物防治; 田间试验
植物冠瘿病又称为根癌病,是由根癌土壤杆菌Agrobacteriumspp.引起的一种细菌性病害[1],其寄主范围广,达59科142属300余种,可危害核果类、浆果类、梨果类、坚果类等果树及观赏植物根茎部,使植株地上部分发育受阻,直接影响果树生产,造成重大经济损失[2]。
引起植物根癌病的病原菌主要有A.tumefaciens(原生物Ⅰ型),A.rhizogenes(原生物Ⅱ型),A.vitis(原生物Ⅲ型),根据它们Ti质粒产生的生物碱类型又可以分为胭脂碱型、章鱼碱型和土壤杆菌素碱型等三种类型[3]。植物根癌病的生物防治与病原菌的种类和Ti质粒类型密切相关,生防菌产生有抑菌活性的土壤杆菌素是它的作用机制之一,但并不是唯一的[4]。如生防菌AgrobacteriumrhizogenesK1026可产生土壤杆菌素A84和A434[4],可以抑制多种致病性土壤杆菌,但对引起葡萄根癌病的原生物Ⅲ型病原菌并没有抑制作用。鉴于引起植物根癌病的病原菌复杂的致病和生防机制,目前已对重要的寄主植物,如葡萄、樱花、树莓[5]、樱桃、桃树的病原菌类型进行调查并分离获得了相应的生防菌株。
樱桃Cerasuspseudocerasus是山东泰安地区的主栽果树之一,根癌病对其生长造成严重的影响,部分苗圃的发病率接近100%。在前期研究中,本研究室发现引起山东泰安地区食用大樱桃根癌病的病原菌主要为原生物Ⅰ型和Ⅱ型,Ti质粒类型为胭脂碱型。本文研究了遗传工程菌A.rhizogenesK1026菌株对大樱桃不同原生物类型病原菌的抑制作用,及存在的可能生防机制,并通过田间试验进行验证,为生防菌株K1026在山东泰安地区的应用提供理论基础。
1 材料和方法
1.1 供试菌株及植物
1.1.1 供试菌株
生物防治菌株K1026由澳大利亚阿德莱德大学Ryder Maarten教授提供,属于非致病性发根土壤杆菌Agrobacteriumrhizogenes。
病原菌C31-32由本实验室分离自食用大樱桃根癌组织,属胭脂碱型Ti质粒,原生物Ⅰ型土壤杆菌A.tumefaciens。
病原菌C31-8由本实验室分离自食用大樱桃根癌组织,属胭脂碱型Ti质粒,原生物Ⅱ型土壤杆菌A.rhizogenes。
1.1.2 供试植物
供试胡萝卜根茎购买自菜市场,品种为‘春红二号’;供试番茄品种为‘佳粉15号’;田间试验所用的一年生樱桃苗木为‘中国樱桃’株系。
1.2 培养基
YMA培养基:K2HPO40.5 g/L、CaCl20.2 g/L、NaCl 0.2 g/L、MgSO4·7H2O 0.2 g/L、酵母浸粉1 g/L、甘露醇10 g/L、微量元素(1 000×)2 mL,蒸馏水定容至1 000 mL,pH 7.2~7.4,琼脂15 g,121℃灭菌 20 min后备用。其中微量元素(1 000×)的配方为:FeCl35 g/L、MnCl20.1 g/L、ZnCl20.5 g/L。
产素培养基(Stonier’s培养基)[6]:CaSO4·2H2O 0.1 g、MgSO4·7H2O 0.2 g、NaCl 0.2 g、NH4NO32.7 g、柠檬酸钾10 g、谷氨酸钠2 g、NaH2PO4·2H2O 0.3 g、K2HPO4·3H2O 1.15 g、YMA培养基中微量元素(1 000×)1 mL、蒸馏水定容至1 000 mL,调整pH7.2,琼脂15 g,121℃灭菌 20 min,倒平板前加入抽滤灭菌的生物素,使终浓度达到0.2 mg/L。
1.3 方法
1.3.1 平板法检测K1026产生的土壤杆菌素对樱桃根癌病原菌的抑制作用
参照Stonier的方法[6],将活化的K1026菌株点接在产素培养基平皿中心,28℃培养2 d后用灭菌棉棒拭去菌苔,用三氯甲烷熏蒸5 min,杀死生长的K1026菌株。
挑取YMA平板上培养24 h的病原菌C31-8和C31-32,分别用无菌水制备成OD600=0.3左右的菌悬液,取1 mL与4 mL含0.6%琼脂的0.2 mol/L磷酸缓冲液充分混匀后,倾倒至上述培养皿内,使覆盖成均匀的薄层,每个病原菌重复3次,置28℃培养3~7 d,观察抑制圈的出现情况。
1.3.2 胡萝卜圆盘法检测K1026对樱桃根癌病病原菌的抑制作用
选择新鲜、无损伤的胡萝卜根茎,用自来水清洗干净,用70%乙醇擦洗后火焰干燥,横切成5 mm厚的圆片,用干净的手术刀片切除胡萝卜圆片外周部分,放在铺有水琼脂的培养皿内,靠近根端的一面朝上。
挑取在YMA培养基上生长24 h的病原菌C31-8、C31-32和生防菌K1026,分别用无菌水制备成OD600=0.3左右的菌悬液,各吸取30 μL涂于胡萝卜圆盘上。设4个处理,分别为单独接种病原菌,病原菌和K1026菌悬液按1∶5的体积比例混合后接种。每个处理重复接种2~3个胡萝卜片,同时设无菌水对照,25℃保湿两周左右观察结果。
1.3.3 番茄接种K1026对根癌病原菌C31-8的抑制作用
取生长50 d左右的健康番茄植株,利用针刺法接种,每株番茄各取3个不同的分枝进行处理。先用75%乙醇表面消毒,用无菌注射针头轻刺番茄茎部10针左右,造成微小创伤。将分别在YMA培养基上生长24 h的病原菌C31-8和生防菌K1026,用无菌水制备成OD600=0.3左右的菌悬液,用无菌棉蘸取菌悬浮液包裹于创伤处48 h,设3个处理,分别为只接种病原菌,病原菌和生防菌K1026菌悬液按1∶5的体积比例混合后接种,以及无菌水对照。每个分枝连续处理5个点作为重复, 21 d后调查创伤处根癌组织的产生情况。
1.3.4 不同接种时间对病原菌瘤状组织产生的影响
利用胡萝卜切片法检测,挑取分别在YMA培养基上生长24 h的病原菌和生防菌K1026,用无菌水制备成OD600=0.3左右的菌悬液,分别于病原菌接种前2 h、接种后0、12、24、36、48、72 h接种。每片胡萝卜接种病原菌悬液20 μL,接种新鲜制备的K1026菌悬液40 μL,每个处理设3个重复。26℃保湿培养2周,小心切下瘤状组织并称重。
1.3.5 生防菌株K1026对中国樱桃冠瘿病田间防治试验
田间试验于2016年3月21日至11月30日在山东省泰安市岱岳区樱桃育苗地进行,土壤类型为棕壤,pH 6.34,经检测土壤中总氮、磷、钾和有机质的含量分别为1.35、1.24、1.9和22.4 g/kg。试验地块有连续5年的‘中国樱桃’育苗史,冠瘿病发病4年,试验在严重发病地块进行。用无菌水洗下在YMA培养基上生长24~48 h的生防菌K1026,与无菌草炭充分混匀,调整有效活菌数2×109cfu/g,制备成K1026草炭制剂。试验设K1026草炭制剂和清水对照2种处理,小区面积4.5 m2,每小区定植15株樱桃苗,每处理重复8次,随机区组排列。
试验用苗为‘中国樱桃’一年生健康实生苗,处理前修剪根部,造成伤口利于土壤杆菌侵染,采用蘸根法。用纯净水将K1026草炭制剂100 g稀释至5 L,将根部分别浸入K1026溶液和清水中30 s,按株行距40 cm定植于小区中,浇水,其他常规管理同大田。
11月30日调查结果时首先统计各小区苗木成活率,然后小心挖出完整植株,用清水清洗干净后统计有根癌组织和没有根癌组织的苗木数量,最后用锋利的刀子取下根癌组织,再次清洗、晾干后称量根癌组织的重量。计算无瘤植株比率、平均每株瘤重和防治效果。
防治效果(%)=(对照平均每株瘤重-处理平均每株瘤重)/对照平均每株瘤重×100。
试验数据用DPS 6.50统计软件处理,并采用LSD法检测处理间差异显著性。
2 结果分析
2.1 生防菌K1026产生的土壤杆菌素对根癌病原菌的抑制作用
K1026在产素培养基上培养48 h后可产生大量土壤杆菌素A84[7],抑制病原菌的生长,被测2株病原菌接种后均在K1026接种点附近产生明显的抑菌圈。C31-32培养24 h后产生的抑菌圈直径范围为55~60 mm,边缘清晰;而C31-8抑菌圈出现较晚,48 h后才在K1026接种点附近观测到两个同心抑菌圈(图1),一个直径约40 mm左右,边缘模糊,另一个直径大于70 mm,边缘清晰。

图1 待测病原菌C31-32(左)和C31-8(右)对土壤杆菌素的敏感性Fig.1 Sensitivities of pathogenic agrobacteria C31-32(left)and C31-8(right)to agrocin production by K1026
2.2 K1026对病原菌侵染产生瘤状组织的影响
胡萝卜切片接种病原菌2周后,在次生木质部周围均可以产生乳黄色的瘤状组织,而接种病原菌和生防菌K1026混合悬液的处理,则没有瘤状组织产生(图2)。

图2 K1026对病原菌侵染产生瘤状组织的影响Fig.2 Effects of K1026 on tumor tissues caused by pathogenic agrobacteria on carrot discs
以番茄为指示植物,检测生防菌株K1026对病原菌的抑制作用。结果显示,番茄茎部接种病原菌C31-8,2周后针刺部位肿大产生不规则瘤状组织;病原菌和生防菌K1026混合接种,针刺部位与无菌水对照相比没有瘤状组织产生(图3)。

图3 K1026对病原菌侵染番茄茎引起的瘤状组织的影响Fig.3 Effects of K1026 on tumor tissues caused by pathogenic agrobacteria on tomato stems
2.3 K1026不同接种时间对病原菌侵染产生瘤状组织的影响
接种K1026可显著减少瘤状组织的发生(表1),与只接种病原菌C31-32的处理相比,提前接种K1026对瘤状组织减少率为95.52%;同时接种生防菌和病原菌瘤状组织减少率为89.22%。接种病原菌后再接种生防菌K1026也可影响瘤状组织的产生,但间隔时间越长胡萝卜切片产生的瘤状组织越多,即K1026对病原菌的抑制效果越低,间隔48 h后接种K1026,瘤状组织减少率为56.90%,说明K1026对冠瘿病的防治以预防为主,但也存在其他防治机制。
表1K1026不同接种时间对胡萝卜瘤状组织产生的影响1)
Table1EffectsofK1026inoculationtimeontumourtissueformationbypathogenicAgrobacteriumC31-32

处理时间/hTreatmenttime平均瘤重/gFreshweightoftumourpercarrot瘤状组织减少率/%Reductionoftumourtissueformation-2(0.0065±0.0025)d95.520(0.0155±0.0016)d89.2212(0.0240±0.0014)c83.3524(0.0340±0.0064)bc76.3648(0.0620±0.0013)b56.90C31⁃32only(0.1439±0.0123)a-
1) -2表示接种病原菌前2 h接种生防菌K1026; 0、12、24和48分别表示病原菌接种后用生防菌处理的时间。同列数据后不同小写字母表示经LSD检验在0.05水平差异显著。 -2 represents pre-inoculation of K1026, 2 h before inoculation of the pathogen; 0, 12, 24 and 48 h are different times of addition of biocontrol bacteria K1026 after pathogen inoculation. Different letters in the same column indicate significant difference at 0.05 level.
2.4 生防菌株K1026对‘中国樱桃’冠瘿病田间防治效果
K1026对‘中国樱桃’一年生苗的田间防治试验分为2个处理,8个重复。结果K1026蘸根处理后定植于含有病原菌的土壤中,8个月后调查,无瘤健康植株比率提高至81.87%(见图4),冠瘿病发病率从54.29%降低至18.13%。
提前接种K1026也可减少瘤状组织大小,从而降低植株感病程度。与清水对照相比,瘤重减少率(即防治效果)可达81.61%。
3 讨论
K1026可产生土壤杆菌素A84和A434,对于含有胭脂碱类型Ti质粒的土壤杆菌具有明显的抑制作用[7]。本试验选用的两株病原菌分离自山东泰安大樱桃根癌组织,分属于原生物Ⅰ型和Ⅱ型,含有胭脂碱类型Ti质粒。通过双层平板、胡萝卜切片和接种指示植物番茄等3种不同的方法检测K1026对病原菌的抑制作用结果是一致的。证明K1026能明显抑制两株病原菌的生长,其抑制作用除产生土壤杆菌素外,还可以通过营养竞争和定殖侵染位点起作用。
利用Stonier的双层平板法Pulawska等[8]测定了409株致瘤菌对土壤杆菌素A84的敏感性,发现约41%的菌株可产生不同大小的抑菌圈。本试验的2株病原菌经测定也可产生两种不同形式的抑菌圈,C31-32与模式菌株C58相似[9],产生的抑菌圈直径约55~60 mm,边缘清晰,推测是由于土壤杆菌素A84的抑制作用;而C31-8可以产生两个同心抑菌圈,一个边缘清晰直径大于60 mm,另一个直径为40 mm左右,边缘模糊,推测是由于K1026产生的土壤杆菌素A434的作用。
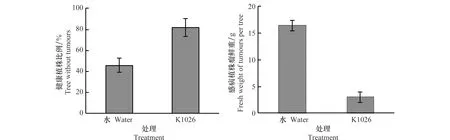
图4 K1026制剂对‘中国樱桃’冠瘿病结瘤及根癌组织大小的影响Fig.4 Inhibitory effects of K1026 on incidence of crown gall disease and fresh weight of tumours in ‘Chinese cherry’ rootstock in the field
土壤杆菌对受伤植株产生的分泌物有趋化性,致病菌可以附着到植物细胞表面,在伤口部位存活超过16 h,将遗传信息片段导入植物创伤中,使正常的植物细胞转化成肿瘤细胞,进而形成冠瘿瘤[10]。致病及无致病土壤杆菌互相竞争有限的附着位点,这种竞争作用是K1026的另一个生防机制。本试验研究了接种病原菌前后不同时间用K1026处理对病原菌的抑制作用,发现于接种病原菌前2 h和同时接种处理,瘤重减少率分别为96.77%和82.23%,接种病原菌24 h后再接种K1026,防治效果急剧下降,其生防效果只能依靠产生的土壤杆菌素实现。
以上结果表明提前接种K1026,可较好地抑制病原菌的侵染。因此,在田间试验过程中采取健康植株蘸根处理,通过修剪根系人为制造伤口,易于K1026进入植物组织,与致病菌竞争附着位点而达到81.61%的防治效果,降低发病率至18.13%。说明生防菌株K1026可用于樱桃等核果类果树根癌病的生物防治。
[1] 李淑平, 张福兴, 孙庆田, 等. 樱桃根癌病研究进展[J]. 烟台果树, 2010(2): 7-9.
[2] Kerr A. Biological control of crown gall [J]. Australasian Plant Pathology, 2016, 45(1): 15-18.
[3] Lindström K, Young J P W. International committee on systematics of prokaryotes subcommittee on the taxonomy ofAgrobacteriumandRhizobium[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61(12): 3089-3093.
[4] Clare B G, Kerr A, Jones D A. Characteristics of the nopaline catabolic plasmid inAgrobacteriumstrains K84 and K1026 used for biological control of crown gall disease [J]. Plasmid, 1990, 23(2): 126-137.
[6] Stonier T.AgrobacteriumtumefaciensConn. Ⅱ. Production of an antibiotic substance [J]. Journal of Bacteriology, 1960, 79: 889-898.
[7] Kim J G, Park Y K, Kim S U, et al. Bases of biocontrol: sequence predicts synthesis and mode of action of agrocin 84, the Trojan Horse antibiotic that controls crown gall [J].Proceedings of the National Academy of Sciences,2006,103:8846-8851.
[9] Cooksey D A. A spontaneous insertion in the agrocin sensitivity region of the Ti-plasmid ofAgrobacteriumtumefaciensC58[J]. Plasmid, 1986, 16(3): 222-224.
[10] Wang Hongyan, Wang Huimin, Wang Jianhui, et al. The pathogen of crown gall disease on flowing cherry and its sensitivity to strain K1026 [J]. European Journal of Plant Pathology, 2000, 106:475-479.
(责任编辑: 田 喆)
SuppressionofthepathogenofcherrycrowngalldiseasebyAgrobacteriumrhizogenesK1026anditscontroleffectsinthefield
Wei Yanli1, Ryder Maarten2, Li Jishun1, Hu Jindong1, Li Hongmei1, Li Jinping3, Yang Hetong1
(1.InstituteofEcology,ShandongAcademyofSciences,ShandongProvincialKeyLaboratoryofAppliedMicrobiology,Ji’nan250014,China; 2.SchoolofAgriculture,FoodandWine,UniversityofAdelaide,Adelaide5064,Australia; 3.ShandongAcademyofSciences,Ji’nan250014,China)
Crown gall, caused by pathogenicAgrobacteriumspp., is a serious problem in the production of cherry.Agrobacteriumrhizogenesstrain K1026 was introduced from Australia, and has shown a high efficiency in biocontrol of crown gall disease. This research verified the control action of K1026 against two different species (biovars) of crown gall pathogens by three different methods: double layer inhibition test on agar medium, carrot root disc bioassay and tomato stem inoculation. In addition, this study reported the effect of different K1026 inoculation times on tumour formation by pathogenic strains in the carrot disc bioassay. The results showed that K1026 could inhibit the generation of tumor tissues on carrot discs when inoculated up to 24 h after addition of the pathogen. The mechanisms of action of K1026 included the production of agrocin antibiotics (agrocin 84 and agrocin 434) and competition for adsorption and infection sites on the plant tissue. In field trials, strain K1026 demonstrated a mean inhibition of crown gall disease of cherry rootstock ‘Chinese Cherry’ of up to 81.61%, and the incidence of crown gall disease dropped substantially to 18.13%. These results suggest thatA.rhizogenesK1026 can be used for biocontrol of cherry crown gall disease in the field in China.
crown gall disease;AgrobacteriumrhizogenesK1026; agrocin; biological control; field trial
S 436.629
: ADOI: 10.3969/j.issn.0529-1542.2017.05.007
2017-02-06
: 2017-03-08
山东省重点研发计划(2016GNC113010);山东省外专局“智惠山东”外国专家项目
* 通信作者 E-mail: yanght@sdas.org

