ITS序列及其SNP位点在外来入侵杂草长芒苋、西部苋和糙果苋物种鉴定中的应用
徐 晗, 赵彩云, 刘勇波, 陈鹏程, 李俊生*
(1. 中国环境科学研究院, 北京 100012; 2. 中国检验检疫科学研究院, 北京 100176;3. 绍兴出入境检验检疫局, 绍兴 312000)
ITS序列及其SNP位点在外来入侵杂草长芒苋、西部苋和糙果苋物种鉴定中的应用
徐 晗1,2*, 赵彩云1, 刘勇波1, 陈鹏程3, 李俊生1*
(1. 中国环境科学研究院, 北京 100012; 2. 中国检验检疫科学研究院, 北京 100176;3. 绍兴出入境检验检疫局, 绍兴 312000)
对于以种子形态为物种主要识别依据的口岸部门,外来入侵杂草长芒苋、西部苋和糙果苋一直是鉴定的难点。本文对34种苋属植物的ITS序列和26S rDNA进行分析,通过SNP变异位点及特异性引物,借助PCR-RFLP方法,对长芒苋、西部苋与糙果苋进行快速、准确的分类鉴定。ITS序列分析表明,长芒苋种内变异小,种间变异显著,可与其他苋属植物明显区分。西部苋与糙果苋之间ITS序列差异小,需依据SNP位点来区别。
ITS序列; 异株苋亚属; 长芒苋; 西部苋; 糙果苋; 26S rDNA; SNP; PCR-RFLP
外来入侵植物长芒苋AmaranthuspalmeriWatson、西部苋A.rudisSauer和糙果苋A.tuberculatus(Moq.) Sauer隶属苋科Amaranthaceae苋属Amaranthus异株苋亚属Acnida,原产北美,是美国大豆、玉米田的超级杂草[1-2]。近几年随中美两国贸易增加,经粮谷等货物传入我国风险加大,已在我国口岸多次被截获[3]。长芒苋、西部苋和糙果苋雌雄异株,与中国苋属雌雄同株种类相比,容易区分。其中,长芒苋雌株具有圆锥形穗状长花序和芒尖状硬直苞片等明显特征,容易识别。但西部苋和糙果苋形态相近,种间常发生杂交,一直是分类上的难题。Sauer[4-5]根据雌花花被片数目及等位酶分析将西部苋和糙果苋分开。Robertson[6]和Pratt[7]认为西部苋和糙果苋地理分布重叠,不能分为严格意义上的两个种。Costea和Tardif[8]建议将二者并为一个种,将西部苋作为糙果苋的变种A.tuberculatus(Moq.) Sauer var.rudis(Sauer) Costea & Tardif。笔者对西部苋和糙果苋长期观察研究发现,形态学上,西部苋与糙果苋雌株可通过胞果以及叶片的特征来区分,但雄株却难以分清。此外,苋属种子小,仅1 mm左右,形态学分辨技术难以掌握,容易误判[9]。因此,借助新的方法来澄清两个物种的分类问题十分必要。
内转录间隔区ITS(internal transcribed spacer)位于rRNA编码基因18S、5.8S和26S之间。通常作条形码使用的ITS序列指ITS1、5.8S和ITS2。这些rDNA高度保守地分布在染色体的不同位置,在每个单倍染色体基因组中的拷贝数超过200个。根据保守序列中的单核苷酸多态性(single nucleotide polymorphism, SNP)位点设计引物进行特异性扩增比较,可用于物种鉴定。多拷贝序列26S rDNA是编码核糖体亚基的基因,序列长度在600 bp左右。Gutell等研究表明这段区域具有较高的变异率,可以用于亲缘关系较近的物种间的分类研究[10]。将ITS序列与26S rDNA相结合,可发现更有价值的分子标记,进而用于种下单元鉴定。
单核苷酸多态性是指由于单个核苷酸的变异所形成的遗传标记,其数量多、多态性丰富、适于快速、自动化分析。SNP的检测方法有多种,但是由于技术难度高、成本费用高,其应用受到了阻碍。PCR-RFLP分子标记技术又称酶切扩增多态性序列(cleaved amplified polymorphic sequences,CAPS)标记技术,是一类以PCR为基础的共显性的分子标记。自1993年Konieczny和Ausubel在拟南芥上发展CAPS标记以来[11],因其具有共显性、位点特异性、操作简单、成本低、所需DNA样品量少和对DNA的纯度要求不高等优点成为现代生物学研究的一个非常重要的分子标记技术。在种质鉴定、辅助育种、基因鉴定和图谱构建等领域得到相当广泛的应用[12-13]。
宋葆华等[14-15]曾采用RAPD方法和ITS序列对中国苋属植物系统进化关系进行研究,证明除凹头苋亚属Albersia以及苋亚属Amaranthus的绿穗苋A.hybridus复合群分类效果不理想之外, 运用ITS序列进行苋属植物的分类效果较好。本文在扩充物种和样本数量的基础上,采用ITS序列及其SNP位点对长芒苋、西部苋和糙果苋三种外来入侵植物进行分类研究。本研究在苋属植物种子分类鉴定以及西部苋和糙果苋的分类问题上具有十分重要的意义和应用价值。
1 材料与方法
1.1 试验材料
供试材料为2005年至今本实验室收集的苋属16种(表1)21个居群的51份样品,以及2种作为外类群的青葙Celosiaargentea和空心莲子草Alternantheraphiloxeroides的植株和种子标本。标本采自国内或来自口岸截获的粮谷下脚料中。所有材料均通过专家复核鉴定。
表1植物材料及来源
Table1Plantmaterialsandlocation

中文名Chinesename学名Scientificname标本来源Location标本采集信息(号)Collectioninformation白苋Amaranthusalbus中国内蒙古H.Xu(2012)北美苋A.blitoides中国内蒙古H.Xu(2012)凹头苋A.blitum中国北京H.Xu(2012)繁穗苋A.cruentus英国UKSEED胀果苋A.deflexus西班牙巴塞罗那H.Xu(2012)绿穗苋A.hybridus中国北京H.Xu(1113)长芒苋A.palmeri中国北京H.Xuetal.(2012)美国西雅图1⁃8⁃14928阿根廷1⁃8⁃14514中国福建H.Xuetal.(2010)反枝苋A.retroflexus中国内蒙古H.Xu(2012)刺苋A.spinosus中国福建H.Xuetal.(2010)菱叶苋A.standleyanus中国北京Z.Y.Li(11350)薄叶苋A.tenuifolius中国山东Y.T.Hou(2008)皱叶苋A.crispus中国河北H.Xuetal.(2010)苋A.tricolor中国北京H.Xu(2012)糙果苋A.tuberculatus中国福建H.Xuetal.(2010)
续表1Table1(Continued)

中文名Chinesename学名Scientificname标本来源Location标本采集信息(号)Collectioninformation西部苋A.rudis中国福建H.Xuetal.(2010)中国江苏H.Xuetal.(2011)中国广东H.R.Wu(2012)中国北京Z.X.Li(2012)皱果苋A.viridis中国北京H.Xu(2008)青葙Celosiaargentea中国北京H.Xu(2011)空心莲子草Alternantheraphiloxeroides中国重庆Z.Y.Li(2010)
1.2 DNA提取
称取经硅胶干燥的植物叶片或种子100 mg置于事先加入4 mm钢珠的2 mL EP管中,迅速放入液氮中冷冻,将EP管置于Geno/Grinder 2000 (SPEX SamplePrep)高通量研磨机上,1 000 r/min研磨1.5 min。用Tiangen植物基因组DNA提取试剂盒提取叶片总DNA。
1.3 基因扩增及测序
ITS序列通用引物为ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTA-TTGATATGC-3′)。PCR反应体系:25 mmol/L MgCl22 μL,2.5 mmol/L dNTPs 2 μL,10×PCR缓冲液2.5 μL,2.5 μmol/L引物各1.0 μL,聚合酶1 U,总DNA 1 μL(约30 ng),灭菌水补足25 μL。扩增程序:94℃变性5 min;94℃变性1 min,55℃退火1 min,72℃延伸90 s(进行30个循环);72℃延伸10 min。
ITS616序列通用引物为347f(5′-CCCGTGA-ACCATCGAGTT-3′)和807r (5′-AACATCAGA-CCTCTTCGCAGG-3)(专利申请号:2016111851567)。PCR反应体系25 μL:30 ng/μL模板DNA 1 μL,10 μmol/L引物各1 μL,2.5 mmol/L dNTPs 2.0 μL,5 U/μLTaqDNA聚合酶0.3 μL,10×PCR反应缓冲液2.5 μL,25 mmol/L MgCl22 μL,余量为水。PCR扩增程序为:94℃ 5 min;94℃ 30 s,51℃ 60 s,72℃ 35 s,35个循环;72℃ 10 min。3%琼脂糖凝胶电泳检查结果。PCR产物经琼脂糖凝胶电泳检测合格后,由上海生物工程技术服务有限公司测序,扩增引物同时作为测序引物进行双向测序。
1.4 序列分析及系统树构建
序列编辑和拼接应用Lasergenev 7.1软件中的SeqMan完成,用Clustal X进行序列比对。以青葙和空心莲子草为外类群,使用MEGA 6.0软件进行系统发育分析。空位被处理为缺失,以邻接法(neighbour-joining, NJ)构建系统分支树。NJ树序列间分化程度使用Kimura双参数遗传距离(Kimura 2-parameter distance,K2-P)度量,每一分支的自展支持率为1 000次重复取样的计算结果。
用于糙果苋和西部苋SNP位点分析的序列除来自本试验样本外,还含有GenBank中苋属植物ITS序列,共计34种177条。对序列进行比对分析后,根据糙果苋全基因组序列的contig00002片段(GenBank编号:ACQK00000000.1ACQK01000002.1),在SNP位点下游扩展寻找合适区间,通过Primer Premier 5软件设计特异引物,扩增易于检测该位点的序列。并将扩增的目的片段命名为ITS616(专利申请号:2016111851567)。
1.5 PCR-RFLP酶切反应
PCR-RFLP酶切反应体系为20 μL:1 μg/μL模板DNA 10 μL,10×buffer 2.0 μL,StyⅠ(Eco130 Ⅰ)酶1 μL,余量为水。PCR-RFLP酶切反应条件为:37℃水浴1 h。3%琼脂糖凝胶电泳检查结果。
2 结果与分析
2.1 ITS序列系统发育关系
以NJ法构建的ITS序列系统树将苋属植物分为5个进化支(图1)。其中,长芒苋与同亚属的西部苋和糙果苋分开,与刺苋聚在一起组成clade 3。且长芒苋种内变异小,种间变异显著,可与其他苋明显区分。西部苋和糙果苋以97%的自展支持率聚为clade 1,两者虽然可以与其他苋区分,但西部苋和糙果苋之间差异小,同源性高,需借助特异性位点进一步界定。
2.2 西部苋和糙果苋的区分
在对34种苋属植物的177条ITS基因序列进行比较后,发现糙果苋与西部苋以及其他苋在616位点存在稳定的变异,糙果苋在该位点为杂合位点A(A>G),西部苋及其他苋在该位点为纯合位点G(图2)。该SNP位点与相邻碱基组成“CCAAGG”,为StyⅠ内切酶识别位点。酶切后,糙果苋呈现3条带,依次为461、273、188 bp,其他无变异位点物种仅有461 bp一个条带(图3)。根据该特异性位点,可将西部苋和糙果苋相区分。

图1 根据NJ法构建的苋属植物ITS序列系统进化树图Fig.1 Phylogenetic tree of Amaranthus constructed by NJ method
3 讨论
ITS序列已广泛应用于解决科内不同等级的系统发育和分类问题[16],并被Kress等人选作植物条形码候选序列[17]。宋葆华等已对中国苋属16个类群ITS序列进行系统进化关系分析,表明ITS序列在苋属属内具有良好的分类价值[15]。但之前研究的种类不全,存在大量异名问题。本研究发现,苋属大部分植物,包括长芒苋,可以通过ITS序列相区分。但西部苋和糙果苋ITS序列的种间差异却很小,需借助SNP位点进一步辨识。SNP标记于1994年被首次提出,在拟南芥、水稻、马铃薯等植物的研究中已得到了很好的应用[18-20]。随着DNA条形码技术从基因跨越到基因组时代,SNP在物种鉴定、系统进化等领域发挥了越来越多的作用[21]。这种基因上的单核苷酸多态性可辅助形态特征,对糙果苋和西部苋进行最终判定。

图2 糙果苋ITS序列SNP位点(仅列出部分序列)Fig.2 The SNP of ITS sequences of Amaranthus tuberculatus
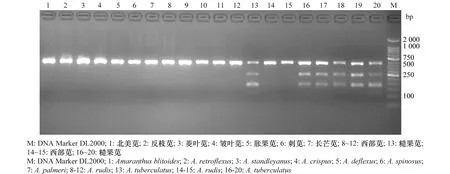
图3 苋属植物ITS 616序列酶切电泳图Fig.3 The electropherogram of enzyme-digested products of ITS 616 sequence
通过ITS序列,将长芒苋与西部苋和糙果苋复合群与苋属其他物种区分后,再根据SNP位点对西部苋和糙果苋进行辅助判定。形态上,西部苋雌株胞果周裂、1~2花被片、雌花花序间生有小叶、叶片黄绿或绿色并长椭圆形,与糙果苋雌株胞果不裂、无花被片、雌花花序细长无小叶、叶片深绿色并狭长椭圆形的特征相区别,但雄株间的形态却十分接近。二者在ITS序列上有稳定的SNP位点,且为杂合位点,而且变异位点较少。因此,综合形态特征和ITS序列分析,建议采用Costea和Tardif[8]的分类观点,即将西部苋作为糙果苋的变种A.tuberculatus(Moq.) Sauer var.rudis(Sauer) Costea & Tardif来处理。
[1] Ward S M, Webster T M, Steckel L E. Palmer amaranth (Amaranthuspalmeri): A review [J]. Weed Technology, 2013, 27(1):12-27.
[2] Bensch C N, Horak M J, Peterson D. Interference of redroot pigweed (Amaranthusretroflexus), palmer amaranth, and common waterhemp (A.rudis) in soybean [J]. Weed Science, 2003, 51: 37-43.
[3] 徐晗, 宋云, 范晓虹, 等. 3种异株苋亚属杂草入侵风险及其在我国适生性分析[J]. 植物检疫, 2013, 27(4): 20-23.
[4] Sauer J D. The grain amaranths and their relatives: A revised taxonomic and geographic survey [J]. Annals of the Missouri Botanical Garden, 1967, 54(2):103-137.

[6] Robertson K R. The genera of Amaranthaceae in the Southeastern United States [J]. Journal of the Arnold Arboretum, 1981, 62: 267-313.
[7] Pratt D B, Clark L G.AmaranthusrudisandA.tuberculatus, One species or two?[J]. Journal of the Torrey Botanical Society, 2001, 128(3): 282-296.
[8] Costea M, Tardif F J. Conspectus and notes on the genusAmaranthus(Amaranthaceae) in Canada [J]. Rhodora, 2003, 105(923): 260-281.
[9] 徐晗, 李振宇, 廖芳, 等. 苋属杂草种子形态学研究[J].植物检疫, 2014, 28(2): 33-38.
[10] Gutell R R, Fox G E. A compilation of large subunit RNA sequences presented in a structural format [J]. Nucleic Acids Research, 1988, 16(S): 175-269.
[11] Konieczny A, Ausubel F M. A procedure for mappingArabidopsismutations using co-dominant ecotype-specific PCR-based marker [J]. Plant Journal, 1993, 4(2):403-410.
[12] Rafalski A.Application of single nucleotide polymorphisms in crop genetics [J].Current Opinion in Plant Biology, 2002, 5(2): 94-100.
[13] Morin P A, Luikart G, Wayne R K, et al. SNPs in ecology, evolution and conservation[J].Trends in Ecology and Evolution, 2004, 19(4): 208-216.
[14] 宋葆华, 张荃, 张慧, 等. 基于RAPD指纹图谱重构苋属系统发育关系[M]//中国植物学会六十五周年年会学术报告及论文摘要汇编(1933-1998).北京:中国林业出版社, 1998: 116.
[15] 宋葆华, 陈之端, 汪小全, 等. 中国苋属nrDNA的ITS序列分析及其系统学意义[J]. 植物学报, 2000, 42(11):1184-1189.
[16] Baldwin B G, Sanderson M J, Porter J M. The ITS region of nuclear ribosomal DNA: A valuable source of evidence on angiosperm phylogeny [J]. Annals of the Missouri Botanical Garden, 1995, 82: 247-277.
[17] Kress W J, Wurdack K J, Zimmer E A, et al. Use of DNA barcodes to identify flowering plants [J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(23): 8369-8374.
[18] Törjk O, Berger D, Meyer R C, et al. Establishment of a high efficiency SNP-based framework marker set forArabidopsis[J]. Plant Journal, 2003, 36: 122-140.
[19] Hayashi K, Hashimoto N, Daigen M, et al. Development of PCR based SNP markers for rice blast resistance genes at the Piz locus [J]. Theoretical and Applied Genetics, 2004, 108: 1212-1220.
[20] Rickert A M, Kim J H, Meyer S, et al. First-generation SNP/InDel markers tagging loci for pathogen resistance in the potato genome [J].Plant Biotechnology Journal, 2003, 1(6): 399-410.
[21] Li Xiwen, Yang Yang, Henry R J, et al. Plant DNA barcoding: from gene to genome [J].Biological Reviews,2015,90(1):157-166.
(责任编辑: 杨明丽)
TaxonomiccircumscriptionofAmaranthuspalmeri,A.rudisandA.tuberculatus(Amaranthaceae)basedonITSsequencesandSNPanalysis
Xu Han1,2, Zhao Caiyun1, Liu Yongbo1, Chen Pengcheng3, Li Junsheng1
(1.ChineseAcademyofEnvironmentalSciences,Beijing100012,China;2.ChineseAcademyofInspectionandQuarantine,Beijing100176,China;3.ShaoxingEntry-ExitInspectionandQuarantineBureau,Zhejiang312000,China)
Alien invasive weedsAmaranthuspalmeri,A.rudisandA.tuberculatusare difficult to distinguish from each other, and taxonomical identification only depends on seed morphologies. In this study,A.palmeri,A.rudisandA.tuberculatuscould be identified quickly and precisely through PCR-RFLP method, based on ITS and 26S rDNA analyses, and specific primers designed by SNP. The results show that there is no intraspecific variation withinA.palmeripopulations, but interspecific variation is significant.A.palmerican be differentiated from other congeneric species by ITS.However, differences of ITS sequences betweenA.rudisandA.tuberculatusare small, they should be defined further by SNP analysis.
ITS; subgen.Acnida;Amaranthuspalmeri;Amaranthusrudis;Amaranthustuberculatus; 26S rDNA; SNP; PCR-RFLP

实验方法与技术ExperimentalMethod&Technology
S 451; S41-30
: ADOI: 10.3969/j.issn.0529-1542.2017.05.021
2016-12-13
: 2017-01-30
国家重点研发计划(2016YFC1201105);中国检验检疫科学研究院基本科研业务费项目(2014JK010, 2017JK038)
致谢: 向为本研究提供试验材料和热心帮助的舟山出入境检验检疫局李筱筱老师、泉州出入境检验检疫局曾思海老师、广东出入境检验检疫局技术中心吴海荣老师致以衷心的感谢!
* 通信作者 E-mail: lijsh@craes.org.cn;xuhanin@gmail.com

