南海北部冷泉平端深海偏顶蛤的主要生化成分及其与热液和近岸种的对比研究
郭欣雨, 李超伦
南海北部冷泉平端深海偏顶蛤的主要生化成分及其与热液和近岸种的对比研究
郭欣雨1, 2, 李超伦1, 2
(1. 中国科学院海洋生态与环境科学重点实验室, 中国科学院海洋研究所, 山东青岛 266071; 2. 中国科学院大学北京 100049)
属贻贝是广泛分布于全球深海冷泉和热液生态系统的优势种, 在深海化能生态系统的物质循环和能量流动中起着重要作用。本文以我国南海北部冷泉的主要优势种平端深海偏顶蛤()为研究对象, 采用常规生化测定方法, 研究了其主要生化成分和氨基酸组成的特征, 并就特定组织中主要生化成分的含量与生活在热液区的平端深海偏顶蛤和近岸的远东偏顶蛤()进行了对比。结果表明, 南海冷泉平端深海偏顶蛤软体部含水量84.28%, 粗蛋白含量7.18%, 粗脂肪含量1.23%, 糖类含量2.75%, 与已报道的深海贝类组成相近。虽然主要生化成分含量在3种贻贝的鳃、外套膜、闭壳肌和消化腺4个组织中总体差异不大, 但是冷泉平端深海偏顶蛤和热液平端深海偏顶蛤的外套膜糖类含量(25.20%、30.66%)显著高于远东偏顶蛤(6.97%,<0.05), 这表明平端深海偏顶蛤的主要储存物质为外套膜中的糖类。在氨基酸组成上, 冷泉平端深海偏顶蛤鳃中氨基酸总量为44.55%(干质量), 外套膜中为34.83%(干质量), 其中必需氨基酸分别占比41.73%和40.52%, 总体与其他贝类相似。然而, 在平端深海偏顶蛤中, 与渗透压调节相关的甘氨酸和与硫代谢相关的牛磺酸含量较高, 这与其适应深海高盐度高硫化氢浓度的环境相关。综上所述, 南海冷泉平端深海偏顶蛤在常规生化组分和氨基酸组成上与近岸常见双壳类具有一定差异, 这些差异与其特殊生境的关系还需要更加深入的研究。
平端深海偏顶蛤, 生化成分, 冷泉, 南海
冷泉是指在一系列地质活动引起的压力下, 从沉积物中喷出的富含甲烷等烃类的流体[1]。因此, 冷泉流体中含有高浓度甲烷、硫化氢和二氧化碳等[2]。所有现代冷泉聚集地深度都超过550m[3], 在这里光线不能到达。虽然光合作用产生的有机物不再是冷泉生物的主要食物来源, 但是冷泉生态系统中的化能自养微生物利用氧化还原性物质释放的能量合成有机物, 为消费者提供食物来源, 形成了高生产力和巨大的生物量[4-5]。
冷泉生物群落具有相对较低的生物多样性, 但通常存在1~2个高密度、高生物量的优势种[3]。属贻贝就是许多深海冷泉化能生态系统的优势种[1], 它们的鳃细胞中包含化能自养细菌, 这些细菌利用冷泉释放的硫化氢或甲烷等化能合成有机物为宿主提供物质和能量[6-7]。这与近海双壳类通常通过鳃滤水的方式截取水体中的浮游植物和悬浮颗粒物等光合作用产物来获取营养完全不同[8]。这种摄食方式及营养来源的改变是否会对深海贻贝的生化组成产生影响以及产生何种影响仍是未知的, 而对于这些问题的认知有助于深化人们对深海化能生态系统特殊生命过程的认识。此外, 冷泉生态系统的环境参数与热液生态系统也具有差异, 热液流体具有更高的硫化氢和金属离子浓度[9-10]。这种环境的差异是否会对深海贻贝的生化组成造成影响也是未知的。因此, 对平端深海偏顶蛤生化组成的研究是十分必要的。
目前对属贻贝生化成分的研究主要集中于脂肪酸组成的研究。因为特定脂肪酸能够作为一种指示特定微生物的生物标志物, 并且可以揭示冷泉生物群落之间的营养关系[11-13]。但对糖类、蛋白质、氨基酸等生化组分的研究则相对少见。在已有的报道中, Pranal等对南太平洋五个热液的2种属贻贝的氨基酸组成进行了研究[14], Pruski等则研究了墨西哥湾一处冷泉与细菌共生的5种双壳类和2种管状蠕虫的自由氨基酸组成[15]。在南海冷泉区域更是未见报道。因此, 本研究希望通过对南海冷泉平端深海偏顶蛤()的生化组分进行研究, 了解其在特殊的生存环境和共生作用下是否具有生化组成上的特殊性, 另外也希望为之后更深入的研究提供背景资料。
1 材料与方法
1.1 材料
平端深海偏顶蛤()样品来自2015年和2016年“科学号”热液冷泉航次, 由“发现号”水下缆控机器人(ROV)采集。样品采集至甲板后, 迅速用超纯水冲洗掉表面的杂质, 放置于–80℃保存。海底冷泉和热液采样站位的温度、盐度等参数均由ROV携带的SBE 25plus Sealogger CTD测得。近海的远东偏顶蛤()样品采自大连小平岛附近海域, 温度和深度由英国OSIL公司自容式水温仪/水深仪探头在原位测得, 盐度由盐度计测量Niskin采水器在原位采集的水样得到。各样品采集地的环境参数如表1所示。

表1 样品采集地环境参数
冷泉平端深海偏顶蛤样品的壳长为80~110 mm; 热液平端深海偏顶蛤样品稍小, 壳长为65~95 mm; 远东偏顶蛤样品壳长为80~100 mm。将平端深海偏顶蛤和远东偏顶蛤样品解剖, 分别取鳃、外套膜、闭壳肌和消化腺4个组织, 用超纯水冲洗两次, 冷冻干燥, 研磨成粉末备用。另将10只冷泉平端深海偏顶蛤样品去壳, 取软体部整体冷冻干燥, 研磨成粉末备用。
1.2 测定方法
1.2.1 一般生化成分测定
分别测定了平端深海偏顶蛤和远东偏顶蛤鳃、外套膜、闭壳肌、消化腺4个组织及软体部整体的糖类、粗脂肪和粗蛋白含量, 并测定了软体部整体的含水量。使用蒽酮硫酸法测定糖类物质含量, 向50 mg冷冻干燥的样品粉末中加入3 mL 30% KOH溶液, 沸水浴40 min后取出冷却, 加入5 mL 0.2%蒽酮硫酸溶液沸水浴15 min, 然后冰浴10 min, 在波长625 nm处测量吸光值, 根据葡萄糖标准溶液做出的标准曲线推出糖类含量。采用改进的Kattner和Fricke的方法[16]测定样品的粗脂肪含量, 20 mg样品使用体积比为2︰1︰0.75的二氯甲烷: 甲醇: 水体系提取粗脂肪, 得到的粗脂肪在氮气下吹干后称重。粗蛋白含量参照GBT 5009.5-2010食品中蛋白质的测定第二法, 50 mg样品中加入5 mL浓硫酸、0.1 g硫酸铜和1 g硫酸钾消解, 所得试样溶液加入乙酸-乙酸钠缓冲液和显色剂后沸水浴15 min, 冷却后在波长400 nm处测量吸光值, 由氨氮标准溶液所做的标准曲线算出样品中含氮值, 再乘以氮换算成蛋白质的系数, 此处取6.25, 即得出粗蛋白含量。显色剂由15 mL甲醛与7.8 mL乙酰丙酮混合, 加水稀释至100 mL配制而成。软体部含水量由冷冻干燥前质量减去冷冻干燥后质量得出。每组5个重复。所有测定结果以占干质量的百分比表示。
1.2.2 氨基酸组成测定
将冷泉平端深海偏顶蛤冷冻干燥后的鳃和外套膜样品粉末加6 mol/L盐酸溶液于安培瓶中, 充高纯氮气后封管, 放置于110℃烘箱水解24 h, 后过滤除酸, 用0.02 mol/L盐酸定容, 使用德国塞卡姆公司的S-433D型全自动氨基酸分析仪分析测定17种氨基酸。由于盐酸水解破坏了样品中的色氨酸, 因此本实验结果中不涉及色氨酸含量。每组10个重复。
1.3 数据处理
使用SPSS 21.0软件对实验结果进行统计学分析, 用独立样本-检验处理3组贝类之间的对比, 统计值以平均值±标准差的形式表示, 取<0.05为具有显著差异。
2 结果
2.1 一般生化成分特征
冷泉平端深海偏顶蛤软体部含水量84.28%, 粗蛋白含量7.18%, 粗脂肪含量1.23%, 糖类含量2.75%。冷泉、热液平端深海偏顶蛤和远东偏顶蛤各组织的粗脂肪、糖类和粗蛋白等生化成分的含量比较如图1。由图1可以看出, 消化腺的粗脂肪含量在4个组织中最高, 冷泉、热液平端深海偏顶蛤和远东偏顶蛤的消化腺粗脂肪含量分别为干质量的12.30%、10.53%、11.94%; 闭壳肌中粗蛋白的含量最高, 冷泉、热液平端深海偏顶蛤和远东偏顶蛤的闭壳肌粗蛋白含量分别为干质量的42.36%、49.96%、48.08%; 糖类的含量在平端深海偏顶蛤和远东偏顶蛤中则有较大差异(图2), 冷泉和热液平端深海偏顶蛤的外套膜中糖类含量很高, 分别为干质量的25.20%和30.66%, 而远东偏顶蛤外套膜中的糖类含量则较低, 为干质量的6.97%, 并与前两者有显著差异(<0.05)。
a, b, c, d分别为消化腺、鳃、外套膜、闭壳肌; CSB代表冷泉平端深海偏顶蛤、HVB代表热液平端深海偏顶蛤, MK代表近岸远东偏顶蛤
Biochemical components of different tissues of seep mussels, vent mussels, and offshore mussels: (a) digestive gland; (b) gill; (c) mantle; (d) adductor. CSB is cold seep; HVB is hydrothermal vent; MK is; black is crude lipid; densely crossed line is glycogen; sparse bias is protein.
2.2 氨基酸组成特征
在双壳类中, 鳃承担呼吸和滤食的功能, 此外在深海贻贝中鳃也是共生菌的共生场所, 而外套膜是贻贝属的主要储存组织, 因此本文对这两种组织的氨基酸组成进行了研究(表2)。由表2可知, 17种氨基酸在平端深海偏顶蛤中均检测出, 氨基酸总含量在鳃组织中为干质量的44.55%, 在外套膜组织中为干质量的34.83%。在鳃和外套膜中含量较高的氨基酸均为谷氨酸、甘氨酸和天冬氨酸, 分别占氨基酸总量的15.53%~15.69%、13.45%~14.51%、9.42%~ 11.07%, 并且这3种氨基酸的含量在两个组织间无显著差异。必需氨基酸(Thr, Val, Met, Ile, Leu, Phe, Lys, His, Arg)在鳃和外套膜中的含量分别为185.93 mg/g和141.13 mg/g(干质量), 分别占氨基酸总量的41.73%和40.52%。必需氨基酸中精氨酸、赖氨酸和亮氨酸的含量最多, 分别占氨基酸总量的6.47%~7.84%、6.23%~ 6.42%和6.10%~6.35%。非必需氨基酸在鳃和外套膜中的质量比分别为259.60mg/g和207.15mg/g(干质量),其中谷氨酸、甘氨酸和天冬氨酸的含量最多。牛磺酸在鳃和外套膜中的含量分别为17.65mg/g和18.23mg/g。统计分析结果表明, 缬氨酸、酪氨酸、苯丙氨酸、组氨酸和赖氨酸在鳃和外套膜中的含量有显著差异(<0.05), 且这些氨基酸在鳃中的含量均高于外套膜中的含量。
数据柱标注相同字母表示无显著差异, 不同字母表示有显著差异(<0.05)
Value columns with same-letter superscripts indicate no significant difference; columns with different-letter superscripts indicate significant difference (< 0.05)
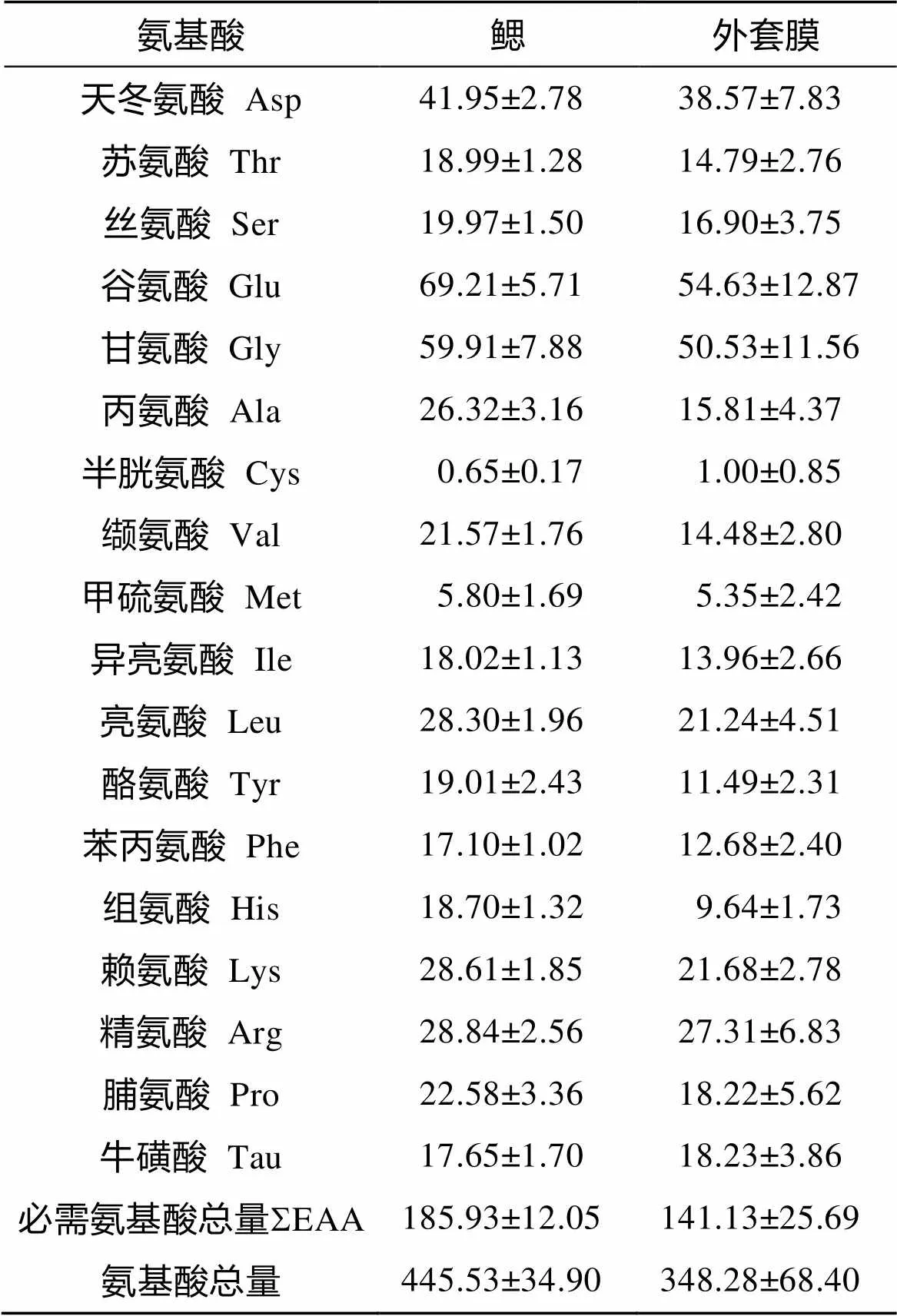
表2 南海冷泉平端深海偏顶蛤鳃和外套膜氨基酸质量比(mg/g, 干质量, n=10)
3 讨论
3.1 基本生化成分
海洋双壳类在全球占据了巨大的渔业产量, 具有很高的经济和营养价值, 因此对于海洋双壳类生化成分的研究已有大量报道(表3)。从整体生化成分来看, 南海冷泉平端深海偏顶蛤与同样生活在深海的加拉帕戈斯裂谷热液的在水分含量上相近, 而南海冷泉平端深海偏顶蛤有相对较高的粗脂肪和糖类含量, 粗蛋白含量则低于。与近岸的紫贻贝()、翡翠贻贝()、文蛤()和菲律宾蛤仔()等常见双壳类相比, 两种深海贻贝具有更高的水分含量, 但其粗蛋白含量和糖类含量则低于上述双壳类。
在4个组织中, 冷泉、热液平端深海偏顶蛤和远东偏顶蛤相同组织的粗脂肪含量两两之间没有显著性差异。粗脂肪含量在3种偏顶蛤各组织中的分布具有一致性, 由高到低依次为消化腺、鳃、外套膜、闭壳肌, 表明在平端深海偏顶蛤和远东偏顶蛤中脂类物质主要集中在消化腺中。
粗蛋白含量在3种偏顶蛤的闭壳肌中均最高, 但平端深海偏顶蛤闭壳肌的粗蛋白含量与其他组织具有显著性差异, 而远东偏顶蛤闭壳肌的粗蛋白含量与其他组织无显著性差异(<0.05)。闭壳肌的主要功能是运动, 这可能表明了平端深海偏顶蛤在氮匮乏的深海环境中对蛋白质的一种利用策略, 即将有限的蛋白质作为功能物质而不是作为营养物质消耗。
平端深海偏顶蛤外套膜的糖类含量显著高于其他组织, 并且显著高于远东偏顶蛤外套膜的糖类含量(<0.05)。本研究中冷泉和热液平端深海偏顶蛤的外套膜中糖类含量还高于厚壳纵帘蛤()[23]、紫石房蛤()[24], 与紫贻贝()在六月份外套膜的糖类含量相近(~30%)[25-26]。但是, 冷泉与热液平端深海偏顶蛤外套膜的糖类含量没有显著性差异。这说明平端深海偏顶蛤与贻贝()属类似, 以外套膜为主要储存组织, 储存的主要营养物质为糖类。Smith等对墨西哥湾冷泉贻贝的研究发现, 在甲烷浓度更高的地方, 冷泉贻贝具有更好的生长状态和糖类含量[27]。不同环境下深海贻贝中糖类含量的变动也反映了深海贻贝主要的储存物质为糖类。
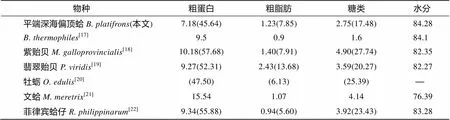
表3 不同双壳类间基本生化成分的比较(%)
注: 括号内数值为占干质量百分比, “-”为引文未给出数据
3.2 氨基酸组成
南海冷泉平端深海偏顶蛤的氨基酸种类齐全, 组成与其他深海热液属贻贝和紫贻贝等近海常见贝类相似, 必需氨基酸占氨基酸总量的比例都在40%左右[14, 28-30]。这表明即使在极端的生存环境和化能合成细菌的共生作用影响下, 平端深海偏顶蛤依然具有普通的氨基酸组成和基本氮需求[14]。
本研究中, 平端深海偏顶蛤鳃中的缬氨酸、苯丙氨酸、组氨酸和赖氨酸含量显著高于外套膜中, 这4种氨基酸都属于必需氨基酸, 平端深海偏顶蛤自身不能合成。平端深海偏顶蛤具有滤食海水中颗粒物的能力, 其鳃丝可以过滤拦截海水中的颗粒物[31]。而其鳃中共生的甲烷氧化细菌也可以利用贻贝吸收的氨合成氨基酸。因此, 鳃中缬氨酸、苯丙氨酸、组氨酸和甲硫氨酸的含量高于外套膜中, 表明它们可能来自环境或共生甲烷氧化细菌。
甘氨酸在氨基酸总量中所占的比例要高于其他研究。游离形式的甘氨酸在细胞中主要作为一种渗透调节物质存在, 细胞内有多种途径对甘氨酸进行合成或分解, 因此其能够快速响应细胞内渗透压的变化[32]。组学结果显示(未发表), 与近岸贻贝相比, 平端深海偏顶蛤没有明显的氨基酸偏好性, 说明其二者构成蛋白质的氨基酸组成基本一致, 而较高的甘氨酸比例可能反映了较高的游离氨基酸含量, 可能是深海相对于近岸较高的盐度造成的。
牛磺酸不参与形成蛋白质, 在细胞中主要参与渗透调节过程。在平端深海偏顶蛤中, 牛磺酸的代谢中间产物亚牛磺酸还是合成硫代牛磺酸的前体。牛磺酸、亚牛磺酸和硫代牛磺酸这3种含硫氨基酸在深海贻贝的硫代谢中起重要作用[33]。本研究中牛磺酸的含量高于翡翠贻贝(3.6%)[19], 可能与环境中硫化物的存在有关。但这一推论需要对其他两种含硫氨基酸进行进一步研究验证。
本文研究了南海冷泉平端深海偏顶蛤主要生化组分的组成特征, 为了解深海冷泉这种特殊环境中贻贝的生物学特征提供了基础资料。但是, 生物的生化组成特点与其发育阶段、生存状态及周边环境等都密切相关, 而特殊的生化组分变化也是其适应特殊环境的一个表征。因此, 未来系统地开展对深海贻贝生化组成及其变化的研究、剖析这些变化的生态功能及其调控机制, 有助于更好地理解深海贻贝的生物学特征、特殊生命过程及其环境适应机制, 提升人类对深海化能生态系统的科学认知。
[1] Myriam S, Karine O. Biogeography, biodiversity and fluid dependence of deep-sea cold-seep communities at active and passive margins[J]. Deep-Sea Research Part II: Topical Studies in Oceanography, 1998, 45(1-3): 517-567.
[2] Brooks J M, Kennicutt M C, Fay RR, et al. Thermogenic gas hydrates in the gulf of Mexico[J]. Science, 1984, 225(4660): 409-411.
[3] Russell C W, Powell E N. Why did ancient chemosynthetic seep and vent assemblages occur in shallower water than they do today?[J]. Int Journ Earth Sciences, 1999, 88(3): 377-391.
[4] James J C, Fisher C R, Brooks J M, et al. A methanotrophicmarine molluscan (bivalvia, mytilidae) symbiosis: mussels fueled by gas[J]. Science, 1986, 233(4770): 1306-1308.
[5] Kochevar R E, Childress J J, Fisher C R, et al. The methane mussel: roles of symbiont and host in the metabolic utilization of methane[J].Marine Biology, 1992, 112: 389-401.
[6] James M B, Kennicutt II M C, Fisher C R, et al. Deep-sea hydrocarbon seep communities: evidence for energy and nutritional carbon sources[J]. Science, 1987, 238(4830): 1138-1142.
[7] Fisher C R, Childress J J, OremLand R S, et al. The importance of methane and thiosulfate in the metabolism of the bacterial symbionts of two deep-sea mussels[J].Marine Biology, 1987, 96: 59-71.
[8] Jørgensen C B. Bivalve filter feeding: hydrodynamics, bioenergetics, physiology and ecology[M]. Olsen & Olsen, 1990.
[9] Kathleen M S, Chalers R F. Physiological ecology of sulfide metabolism in hydrothermal vent and cold seep vesicomyid clams and vestimentiferan tube worms[J].American Zoologist, 1995, 35(2): 102-111.
[10] Von Damm K L, Buttermore L G, Oosting S E, et al. Direct observation of the evolution of a seafloor ‘black smoker’ from vapor to brine[J].Earth and Planetary Science Letters, 1997, 149: 101-111.
[11] Hiroaki S. Unusual novel n-4 polyunsaturated fatty acids in cold-seep mussels (and), originating from symbiotic methanotrophic bacteria[J].Journal of Chromatography A, 2008, 1200(2): 242-254.
[12] Hiroaki S, Kazufumi O. Confirmation of a new food chain utilizing geothermal energy: Unusual fatty acids of a deep-sea bivalve,[J]. Limnology and Oceanography, 2007, 52(5): 1910-1918.
[13] Hiroaki S, Masakazu M, Jun H. Lipid characteristics of a seep clam,: Comparison with those of two coastal clams,and[J].Deep-Sea Research Part I: Oceanographic Research Papers, 2014, 94: 150-158.
[14] Pranal V, Fiala-Médioni A, Colomines J C. Amino acid and related compound composition in two symbiotic mytilid species from hydrothermal vents[J]. Marine Ecology Progress Series, 1995, 119(1-3): 155-166.
[15] Pruski A M, Fiala-Médioni A, Fisher C R, et al. Composition of free amino acids and related compounds in invertebrates with symbiotic bacteria at hydrocarbon seeps in the Gulf of Mexico[J]. Marine Biology, 2000, 136(3): 411-420.
[16] Gerhard K, Holger S G F. Simple gas-liquid chromatographic method for the simultaneous determination of fatty acids and alcohols in wax esters of marine organisms[J]. Journal of Chromatography, 1986, 361(1986): 263-268.
[17] Smith K L. Deep-sea hydrothermal vent mussels: nutritional state and distribution at the Galapagos Rift[J]. Ecology, 1985, 66(3): 1067-1080.
[18] Sedat K, Meryem Y Ç, İsmihan K, et al. Effects of stocking density on survival, growth and biochemical composition of cultured mussels (, Lamarck 1819) from an offshore submerged longline system[J]. Aquaculture Research, 2015, 46(6): 1369-1383.
[19] 庆宁, 林岳光, 金启增. 翡翠贻贝软体部营养成分的研究[J]. 热带海洋, 2000, 19(1): 81-84. Qing Ning, Lin Yue-guang, Jin Qi-zeng. Studies on nutritive compositions of soft part in mussel[J]. Tropic Oceanology, 2000, 19(1): 81-84.
[20] Sefa A, Aynur L, Ali K, et al. Seasonal variation in reproductive activity and biochemical composition of flat oyster () in the Homa Lagoon , Izmir Bay, Turkey[J]. Scientia Marina, 2015, 79(4): 487-495.
[21] 李晓英, 董志国, 阎斌伦, 等. 青蛤与文蛤的营养成分分析与评价. 食品科学, 2010, 31(23): 366-370.Li Xiao-ying, Dong Zhi-guo, Yan Bin-lun, et al. Analysis and evaluation of nutritional components inand[J]. Food Science, 2010, 31(23): 366-370.
[22] MeryemY C, Saniye T Ç, Mehmet Ç, et al. Comparative study on biochemical composition of some edible marine molluscs at Canakkale coasts, Turkey[J]. Indian Journal of Geo-Marine Sciences, 2014, 43(4): 601-606.
[23] Babu A, Venkatesan V, Rajagopal S. Biochemical composition of different body parts of(Roding, 1798) from Mandapam, South East Coast of India[J].African Journal of Biotechnology, 2012, 11(7): 1700-1704.
[24] Bi J H, Li Q, Zhang X J, et al. Seasonal variation of biochemical components in clam (Sowerby 1852) in relation to its reproductive cycle and the environmental condition of Sanggou Bay, China[J]. Journal of Ocean University of China, 2016, 15(2): 341-350.
[25] de Zwaan A, Zandee D I. Body distribution and seasonal changes in the glycogen content of the common sea mussel[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1972, 43(1): 53-58.
[26] Zandee D I, Kluytmans J H, Zurburg W. Seasonal variations in biochemical composition ofwith reference to energy metabolism and gametogenesis[J]. Netherlands Journal of Sea Research, 1980, 14(1): 1- 29.
[27] Emily B S, Kathleen M St, Erica R N, et al. Growth and condition of seep mussels () at a gulf of Mexico Brine Pool[J]. Ecology, 2000, 81(9): 2392-2403.
[28] Tabakaeva O V, Tabakaev A V. Amino-acid profile of a mactridae bivalve mollusk from the Sea of Japan[J]. Chemistry of Natural Compounds, 2016, 52(5): 966- 968.
[29] Tabakaeva O V, Tabakaev A V. Amino-acid composition of soft tissues of the Far-East bivalve mollusk[J]. Chemistry of Natural Compounds, 2016, 52(3): 468-471.
[30] Chen D W, Su J, Liu X L, et al. Amino acid profiles of bvalve mollusks from Beibu Gulf, China[J]. Journal of Aquatic Food Product Technology, 2012, 21(4): 369-379.
[31] Page H M, Fisher C R, Childress J J. Role of filter-feeding in the nutritional biology of a deep-sea mussel with methanotrophic symbionts[J]. Marine Biology, 1990, 104: 251-257.
[32] Lehman L E, James M B, Kennedy T P, et al. Amino acid metabolism in euryhaline bivalves: regulation of glycine accumulation in ribbed mussel gills[J]. The Journal of Experimental Zoology, 1985, 233(3): 347-358.
[33] Audrey M P, Aline F M, Jean-Charles C. High amounts of sulphur-amino acids in three symbiotic mytilid bivalves from deep benthic communities[J]. Animal biology and pathology, 1997, 320(10): 791-796.
Biochemical components of cold seep musselfrom South China Sea and comparison with hydrothermal vent and offshore mussels
GUO Xin-yu1, 2, LI Chao-lun1, 2
(1. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Bathymodiolin mussels are a key species in cold seep and hydrothermal vent ecosystems where they are widely distributed and play an important role in the material cycle and energy flow of deep-sea chemotrophic ecosystems. In this paper, conventional biochemical determination methods are used to determine the fundamental biochemical components ofin a South China Sea cold seep. Differences between mussels found at cold seeps, hydrothermal vents, and the offshore musselare also discussed. Proportions of water, crude protein, lipids, and glycogen inare 84.28, 7.18, 1.23, and 2.75%, respectively, which are similar to those reported in deep-sea mussels. The glycogen content in the mantle of cold seep(25.20%) is significantly higher than that of(6.97%) (< 0.05), but is close to that of hydrothermal vent(30.66%), indicating that glycogen stored in the mantle is the energy reserve of. The total amino acid content in the gill and mantle of seepis 44.55 and 34.83% of dry weight, in which the essential amino acid content accounts for 41.73 and 40.52%, respectively. However, the contents of glycine and taurine are higher than in offshore bivalves. These compounds are related to osmoregulation and sulfur metabolism and may thus indicate environmental adaption. Results show certain differences between the biochemical component content of the SCS cold seepand offshore mussels; however, the relationship with special habitats needs further research.
; biochemical composition; cold seep; the South China Sea
(本文编辑: 梁德海)
Dec., 24, 2016
[Strategic Priority Research Program of the Chinese Academy of Sciences, No.XDA11030202; International Partnership for Innovative Team Program, No.20140491526; National Basic Resources Investigation Projects, No.2017FY100803]
P735
A
1000-3096(2017)06-0065-07
10.11759/hykx20170310001
2016-12-24;
2017-03-11
中国科学院战略性先导科技专项(XDA11030202); 中国科学院国际创新团队项目(20140491526); 科技基础资源调查专项(2017FY100803)
郭欣雨(1992-), 女, 河北邢台人, 硕士研究生, 主要从事深海生物代谢研究, E-mail: guoxinyu14@mails.ucas.ac.cn; 李超伦, 通信作者, 研究员, E-mail: lcl@qdio.ac.cn

