中华猕猴桃品种‘Hort16A’的果实发育特征
张计育, 潘德林, 王 涛, 王 刚, 翟 敏, 郭忠仁
〔江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
中华猕猴桃品种‘Hort16A’的果实发育特征
张计育①, 潘德林①, 王 涛, 王 刚, 翟 敏, 郭忠仁②
〔江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014〕
Abstract: To explore the fruit development characteristics ofActinidiachinensis‘Hort16A’, fruit shape indexes during 2-154 d after anthesis, contents of soluble sugar and titratable acid in fruit during 30-154 d after anthesis, and contents of organic acid components in fruit during 44-147 d after anthesis were analyzed. The results show that fruit of ‘Hort16A’ grows rapidly during 30-44 and 58-72 d after anthesis. Content of soluble solid in fruit during 100-140 d after anthesis is slightly higher than that during 2-93 d after anthesis, and increases rapidly during 147-154 d after anthesis. Fruit firmness decreases rapidly during 147-154 d after anthesis. In general, during 30-154 d after anthesis, content of soluble sugar in fruit increases gradually, while content of titratable acid decreases firstly, then increases, and decreases again. In the fruit, tartaric acid is not detected, content of quininic acid is the highest, contents of malic acid and citric acid are higher, and contents of succinic acid and fumaric acid are very low. Total content of organic acids increases firstly and then decreases, and reaches the highest value at 140 d after anthesis. It is suggested that in order to improve fruit quality of ‘Hort16A’, its cultivation and management plans will be set up based on fruit development characteristics.
中华猕猴桃品种‘Hort16A’; 果实发育特征; 有机酸
猕猴桃(Actinidiaspp.)约54种21变种,中国有52种(包括44个特有种)[1],其果实风味独特,营养价值较高[2],果肉颜色多样[3-6]。近年来,中国猕猴桃产业发展迅速,栽培面积和产量均居世界第一位[7]。与陕西、四川等省份相比,江苏省猕猴桃产业发展迟缓。中华猕猴桃(ActinidiachinensisPlanch.)品种‘Hort16A’为目前世界主栽品种之一[8],然而,种植于江苏省的‘Hort16A’的果实发育特征尚不清楚,不利于其在江苏省的推广种植。鉴于此,作者对种植于南京六合的‘Hort16A’果实发育特征进行了分析,以期为制定‘Hort16A’优质果品的生产技术提供参考。
1 材料和方法
1.1材料
以江苏省中国科学院植物研究所南京六合基地内株龄5 a的中华猕猴桃品种‘Hort16A’的健康植株为研究对象,采取棚架栽培方式,株距和行距均为3 m,雌株与雄株的比例为8∶1,采用电动干粉法[9]进行人工辅助授粉。
1.2方法
1.2.1 果实采集 随机选取10株样株,在2016年4月22日(花后2 d)至9月7日(花后140 d)期间,约每7 d采集1次果实;在9月7日采收样株的所有果实,置于(23±2) ℃恒温箱中保存,继续每7 d取1次果实,直至果实腐烂为止。每次至少采集或取20个果实。
1.2.2 果型指标测定 每批样品随机选10个果实,使用数显游标卡尺(精度0.01 mm)测量其纵径、横径和侧径;使用千分之一电子天平称量单果质量。将3个果实的汁液混合,使用WZ-112手持数显糖度计(北京万成北增精密仪器有限公司)测定可溶性固形物含量,重复取样测定3次。在果实赤道部削去果皮,使用GY-1果实硬度计(西安唯信机电设备有限公司)测定果实硬度,重复取样测定3次。
1.2.3 可溶性糖和可滴定酸含量测定 由于这2个指标主要在果实发育后期改变且变化较慢,因此,仅对花后30、44、58、72、86、100、114、128、140、147和154 d的果实进行检测。将果实去皮,果肉置于液氮中速冻后,于-80 ℃冰箱中保存、备用。称取果肉约0.5 g,采用苯酚法[10]测定可溶性糖含量,按照GB/T 12293—90中的方法测定可滴定酸含量,重复取样测定3次。
1.2.4 有机酸成分含量测定 根据果实中可滴定酸含量的测定结果,选择花后44、86、128、140和147 d的果实进行检测。称取果肉约5 g,采用高效液相色谱法[11]测定有机酸成分含量,重复取样测定3次。使用的KH2PO4为分析纯,甲醇为色谱纯,各有机酸标准品均购自美国Sigma-Aldrich公司。
1.3数据处理和统计分析
采用EXCEL 2010软件对数据进行统计分析。
2 结果和分析
2.1果实果型指标的变化分析
中华猕猴桃品种‘Hort16A’果实果型指标的变化见表1。

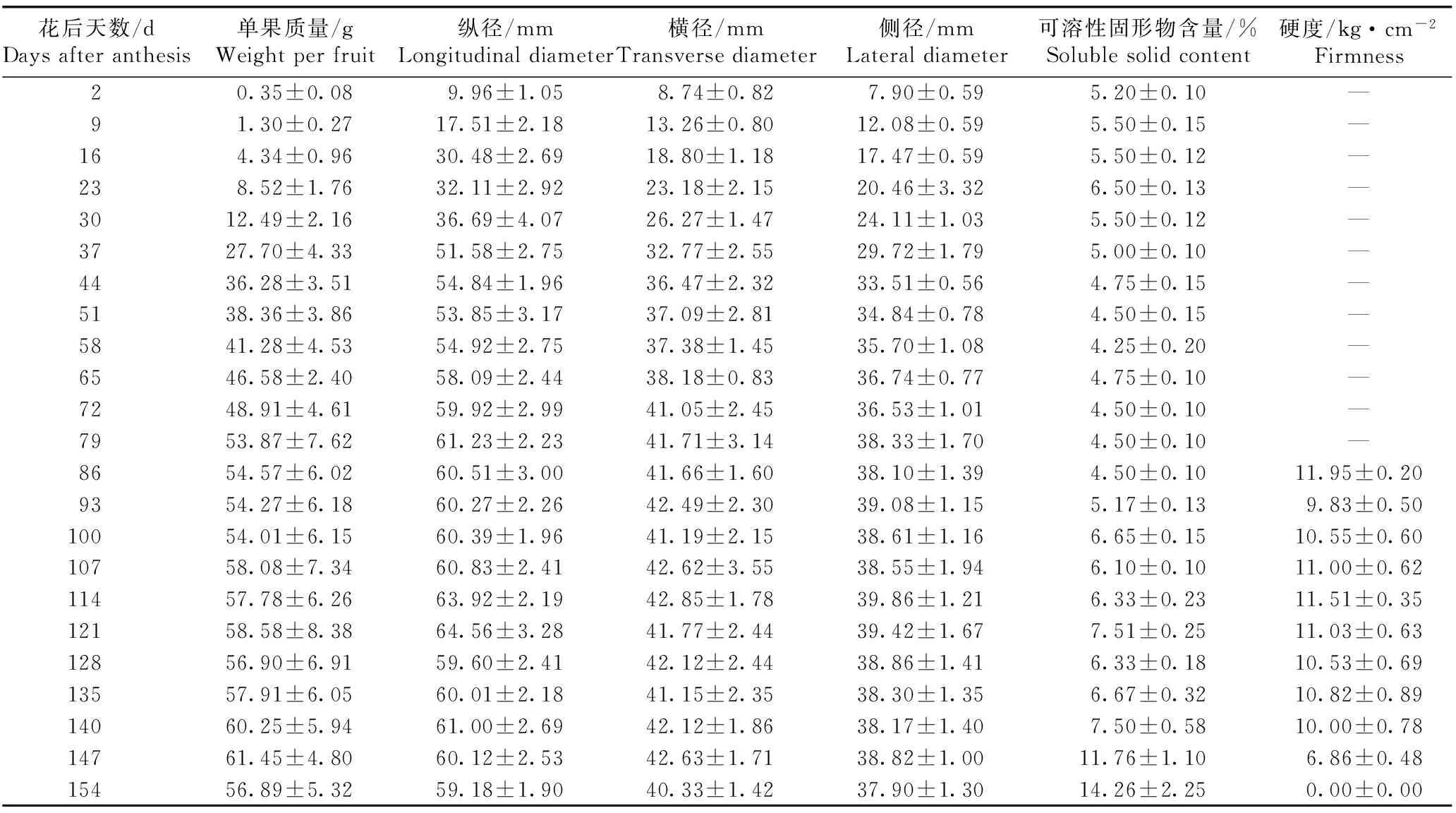
花后天数/dDaysafteranthesis单果质量/gWeightperfruit纵径/mmLongitudinaldiameter横径/mmTransversediameter侧径/mmLateraldiameter可溶性固形物含量/%Solublesolidcontent硬度/kg·cm-2Firmness20.35±0.089.96±1.058.74±0.827.90±0.595.20±0.10—91.30±0.2717.51±2.1813.26±0.8012.08±0.595.50±0.15—164.34±0.9630.48±2.6918.80±1.1817.47±0.595.50±0.12—238.52±1.7632.11±2.9223.18±2.1520.46±3.326.50±0.13—3012.49±2.1636.69±4.0726.27±1.4724.11±1.035.50±0.12—3727.70±4.3351.58±2.7532.77±2.5529.72±1.795.00±0.10—4436.28±3.5154.84±1.9636.47±2.3233.51±0.564.75±0.15—5138.36±3.8653.85±3.1737.09±2.8134.84±0.784.50±0.15—5841.28±4.5354.92±2.7537.38±1.4535.70±1.084.25±0.20—6546.58±2.4058.09±2.4438.18±0.8336.74±0.774.75±0.10—7248.91±4.6159.92±2.9941.05±2.4536.53±1.014.50±0.10—7953.87±7.6261.23±2.2341.71±3.1438.33±1.704.50±0.10—8654.57±6.0260.51±3.0041.66±1.6038.10±1.394.50±0.1011.95±0.209354.27±6.1860.27±2.2642.49±2.3039.08±1.155.17±0.139.83±0.5010054.01±6.1560.39±1.9641.19±2.1538.61±1.166.65±0.1510.55±0.6010758.08±7.3460.83±2.4142.62±3.5538.55±1.946.10±0.1011.00±0.6211457.78±6.2663.92±2.1942.85±1.7839.86±1.216.33±0.2311.51±0.3512158.58±8.3864.56±3.2841.77±2.4439.42±1.677.51±0.2511.03±0.6312856.90±6.9159.60±2.4142.12±2.4438.86±1.416.33±0.1810.53±0.6913557.91±6.0560.01±2.1841.15±2.3538.30±1.356.67±0.3210.82±0.8914060.25±5.9461.00±2.6942.12±1.8638.17±1.407.50±0.5810.00±0.7814761.45±4.8060.12±2.5342.63±1.7138.82±1.0011.76±1.106.86±0.4815456.89±5.3259.18±1.9040.33±1.4237.90±1.3014.26±2.250.00±0.00
1)—: 果实硬度太大,无法检测 Fruit firmness is too large to detect.
由表1可见:在果实发育过程中,中华猕猴桃品种‘Hort16A’的单果质量有2个生长高峰期,分别为花后30~44和58~72 d;纵径生长呈“快—慢—快—慢”的变化规律;横径和侧径在花后2~44 d持续增大,之后变化较小;可溶性固形物含量在花后2~93 d较低,在花后100~140 d略升高,在花后147~154 d迅速升高。由于花后2~79 d果实硬度太大,超出仪器的检测范围,因此,无相应数据;果实硬度在花后86~140 d总体为10~12 kg·cm-2,并在花后147~154 d迅速降低,最终降为0 kg·cm-2。
2.2果实可溶性糖和可滴定酸含量的变化分析
检测结果(表2)表明:中华猕猴桃品种‘Hort16A’果实的可溶性糖含量在花后30~154 d总体上逐渐升高,在花后72 d开始迅速升高,并在花后154 d最高;可滴定酸含量先降低后升高再降低,并在花后44 d最低,在花后128 d最高。
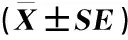


花后天数/dDaysafteranthesis可溶性糖含量/%Solublesugarcontent可滴定酸含量/%Titratableacidcontent302.00±0.6212.47±0.91442.09±0.639.35±0.86582.70±0.1210.96±0.72725.10±0.2314.58±0.93865.18±0.2614.69±0.871006.45±0.3118.16±1.111146.26±0.3818.12±1.101287.40±0.3320.12±1.181406.79±0.5517.73±0.951476.84±0.4518.66±0.851547.99±0.6418.56±0.93
2.3果实有机酸含量的变化分析
检测结果(表3)表明:在中华猕猴桃品种‘Hort16A’果实中未检测到酒石酸,并且,奎宁酸含量最高,苹果酸和柠檬酸含量次之,琥珀酸和富马酸含量最低。奎宁酸和乙酸含量总体上逐渐降低;柠檬酸和乳酸含量在花后86 d迅速升高,在花后140 d最高,并在花后147 d降低;莽草酸含量在花后44~140 d逐渐降低,但在花后147 d迅速升高;苹果酸含量在花后140 d最高。果实的总有机酸含量在花后44~147 d先升高后降低,并在花后140 d最高。
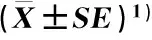

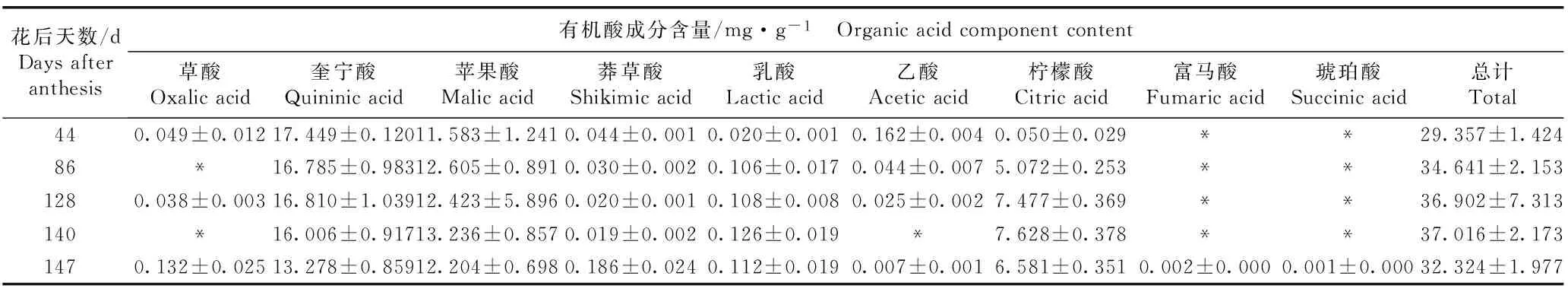
花后天数/dDaysafteranthesis有机酸成分含量/mg·g-1 Organicacidcomponentcontent草酸Oxalicacid奎宁酸Quininicacid苹果酸Malicacid莽草酸Shikimicacid乳酸Lacticacid乙酸Aceticacid柠檬酸Citricacid富马酸Fumaricacid琥珀酸Succinicacid总计Total440.049±0.01217.449±0.12011.583±1.2410.044±0.0010.020±0.0010.162±0.0040.050±0.029**29.357±1.42486*16.785±0.98312.605±0.8910.030±0.0020.106±0.0170.044±0.0075.072±0.253**34.641±2.1531280.038±0.00316.810±1.03912.423±5.8960.020±0.0010.108±0.0080.025±0.0027.477±0.369**36.902±7.313140*16.006±0.91713.236±0.8570.019±0.0020.126±0.019*7.628±0.378**37.016±2.1731470.132±0.02513.278±0.85912.204±0.6980.186±0.0240.112±0.0190.007±0.0016.581±0.3510.002±0.0000.001±0.00032.324±1.977
1)*: 数值很低 The value is very low.
3 讨 论
中华猕猴桃品种‘金艳’(‘Jinyan’)[12]和‘Hort16A’果实发育均有2个生长高峰期,但二者的高峰期不一致,说明不同品种猕猴桃果实发育存在差异,应根据各品种的果实发育特征制定相应的栽培管理方案,从而提高果实品质。总体来看,‘Hort16A’果实的可溶性固形物含量在花后2~93 d较低,在花后100~140 d略升高,在花后147~154 d迅速升高;可溶性糖含量在花后72 d开始迅速升高;可滴定酸含量在花后30~154 d先降低后升高再降低,2个下降期分别为花后30~44和128~140 d,这可能是因为随果实成熟,一部分有机酸转化为糖,另一部分有机酸则作为呼吸作用底物被消耗。
本研究中,‘Hort16A’果实的总有机酸含量在花后140 d以前不断升高,但在花后140 d以后却降低;果实中未检测到酒石酸,奎宁酸含量最高,苹果酸和柠檬酸含量较高,琥珀酸和富马酸含量非常低,这与周元等[13]的研究结果有较大差异,说明不同品种猕猴桃果实的有机酸成分和含量差异明显。
[1] 张慧琴, 谢 鸣, 肖金平, 等. 毛花猕猴桃‘华特’果实发育特性研究[J]. 果树学报, 2015, 32(2): 238-246.
[2] HENARE S J. The nutritional composition of kiwifruit (Actinidiaspp.)[M]∥SIMMONDS M S J, PREEDY V R. Nutritional Composition of Fruit Cultivars. London: Academic Press, 2016: 337-370.
[3] 张计育, 莫正海, 宣继萍, 等. 猕猴桃果肉颜色相关色素代谢研究进展[J]. 中国农学通报, 2013, 29(13): 77-85.
[4] PILKINGTON S M, MONTEFIORI M, JAMESON P E, et al. The control of chlorophyll levels in maturing kiwifruit[J]. Planta, 2012, 236(5): 1615-1628.
[5] MONTEFIORI M, MCGHIE T K, HALLETT I C, et al. Changes in pigments and plastid ultrastructure during ripening of green-fleshed and yellow-fleshed kiwifruit[J]. Scientia Horticulturae, 2009, 119(4): 377-387.
[6] AMPOMAH-DWAMENA C, MCGHIE T, WIBISONO R, et al. The kiwifruit lycopene beta-cyclase plays a significant role in carotenoid accumulation in fruit[J]. Journal of Experimental Botany, 2009, 60(13): 3765-3779.
[7] 张计育, 莫正海, 黄胜男, 等. 21 世纪以来世界猕猴桃产业发展以及中国猕猴桃贸易与国际竞争力分析[J]. 中国农学通报, 2014, 30(23): 48-55.
[8] HUANG H. Kiwifruit: the Genus ACTINIDIA[M]. Beijing: Science Press, 2016: 239-263.
[9] 潘德林, 张计育, 程竞卉, 等. 不同授粉方式对猕猴桃着果率的影响[J]. 中国南方果树, 2017, 46(1): 120-122.
[10] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 199.
[11] SHA S F, LI J C, WU J, et al. Changes in the organic acid content and related metabolic enzyme activities in developing ‘Xinping’ pear fruit[J]. African Journal of Agricultural Research, 2011, 6(15): 3560-3567.
[12] 钟彩虹, 张 鹏, 韩 飞, 等. 猕猴桃种间杂交新品种‘金艳’的果实发育特征[J]. 果树学报, 2015, 32(6): 1152-1160.
[13] 周 元, 傅虹飞. 猕猴桃中的有机酸高效液相色谱法分析[J]. 食品研究与开发, 2013, 34(19): 85-87.
(责任编辑: 佟金凤)
FruitdevelopmentcharacteristicsofActinidiachinensis‘Hort16A’
ZHANG Jiyu①, PAN Delin①, WANG Tao, WANG Gang, ZHAI Min, GUO Zhongren②
(Institute of Botany, Jiangsu Province and Chinese Academy of Sciences, Nanjing 210014, China),J.PlantResour. &Environ., 2017,26(3): 109-111
Q945.49; S663.4
A
1674-7895(2017)03-0109-03
10.3969/j.issn.1674-7895.2017.03.14
2017-03-16
国家自然科学基金资助项目(31401854); 江苏省科技计划项目(BE2015350); 泰州市科技支撑计划(农业)项目(TN201511)
张计育(1982—),男,山西沁县人,博士,副研究员,主要从事猕猴桃种质资源收集和抗逆分子生物学研究。 潘德林(1992—),女,江苏南通人,硕士研究生,主要从事猕猴桃种质资源收集和利用研究。
①共同第一作者
②通信作者E-mail: zhongrenguo@cnbg.net
KeywordsActinidiachinensis‘Hort16A’; fruit development characteristics; organic acid

