不同作物品种耐铝毒基因型筛选试验
邢承华+刘仲书+蒋红英


摘要 采用营养液培养的方法,对水稻23个品种、大豆14个品种和苜蓿12个品种进行了耐铝性筛选试验,并对各品种的耐铝性进行了评价和对各个品种根部和株高生长状况进行了比较,得出耐铝性和铝敏感性品种。结果表明,耐铝基因型具有植株相对生物量较高、种子根相对伸长率、苏木精着色程度较低的共同特点。种子根相对伸长率、苏木精染色指数与植株的耐铝性具有显著的相关性。铝胁迫下耐铝性不同的典型植物的根系形态具有明显差异,耐铝基因型明显优于铝敏感基因型。
关键词 水稻;苜蓿;大豆;品种;耐铝性评价;根系形态
中图分类号 S511;S557.1;S565.1 文献标识码 A 文章编号 1007-5739(2017)17-0034-05
Al-tolerance Genotype Screening About Different Plants
XING Cheng-hua 1 LIU Zhong-shu 2 JIANG Hong-ying 1
(1 Agricultural and Bioengineering Institute,Jinhua Polytechnic,Jinhua Zhejiang 321007; 2 College of Chemistry and Life Sciences,
Zhejiang Normal University)
Abstract Using nutrition training methods,Al-tolerance test of 23 rice varieties,14 soybean varieties and 12 alfalfa varieties were did to evaluate the various species of Al-tolerance and contraste their root growth and plant height.The results showed that the Al-tolerant lines had lower hexnatoxylin dye index,higher RSRL and higher relative biomass in comparison with Al-sensitive lines.There were significant correlations between the relative seminal root length(RSRL),hematoxylin dye index,aril the Al-tolerance of the plant. There were significant difference of morphological and anatomical characteristics different patterns typical of the root system,Al-tolerant genotypes were distinctly better than Al-sensitive ones.
Key words rice;alfalfa;soybean;varieties;Al-tolerance estimation;root morphological
據估计,酸性土壤占世界可耕地的40%,主要分布在发展中国家集中的热带和亚热带。我国酸性土壤遍及南方15个省(区),总面积达2 030万km2。在酸性土壤上影响作物生长的因素包括金属阳离子浓度的降低和吸收的抑制(Mg、Ca、K的缺乏)、氢离子、铝毒、锰毒、磷和铝可溶性的降低、水分缺乏和淋溶作用增强(养分缺乏)。而铝毒被认为是限制酸性上壤上作物生长的主要因素。铝是地壳中含量最丰富的金属元素。在大多数情况下,土壤中的铝是无毒性的。然而,在酸性土壤条件下,对大多数植物都会产生毒害作用。铝对生物体显示出特殊的毒性是与铝存在的化学形态紧密相连的。一般认为,配合态铝和固定态的铝(称低活性铝)对植物和环境没有毒害,只有离子态的铝(仅需在微摩尔浓度下)才对环境和植物产生影响。其中,无机离子态铝如Al3+和Al(OH)2+(称高活性铝)对植物根系的毒害作用最大,有机和无机铝化复合物如Al(OH)3、Al(OH)4-、磷酸铝复合体、氧化铝复合体、有机酸铝等,其毒性较小。许多人也注意到,环境中铝的形态对植物根的吸收有很大影响。当含铝的溶液与强碱发生中和反应时溶液中会产生有剧毒的Al3+聚合物。因此,研究植物耐铝毒的机制已成为生物科学界一项重要而热门的问题。
目前有关植物耐铝毒的机理已有报道[1],其尤其在酸雨降沉频率较高、人们长期施用酸性化肥的地区,土壤中与氧和硅结合的铝易转变为有毒的离子态Al3+ [2],且Al3+很容易在土壤中发生迁移,造成大面积土壤酸化[3]。铝通常是以难溶性硅酸盐或氧化铝的形式存在,对植物没有毒害[4],但pH<5时,这些难溶性的物质溶解,可溶性的铝(主要是Al3+)对大多数植物都会产生毒害[5]。铝毒的最初症状是抑制根系伸长,影响植株的物质和能量代谢[6]。重复施用含铝量较高的等化学肥料,可以导致土壤铝积累,土壤被铝污染后可引起作物尤其是植物体内铝的积累。稻米、大豆作为人类食物的直接来源,是人体摄入铝的主要途径,高含铝量的稻米、大豆或者苜蓿通过食物链会严重危害人体健康,引起中毒或老年痴呆症等症状。随着我国经济的不断发展,污水灌溉、污泥、农药及肥料的施用等导致土壤重金属污染日趋严重,解决植物的污染问题迫在眉睫。铝的污染也不例外。铝的积累性很高,受铝毒害的人越来越多,摄入过多的铝会破坏某些酶的活性,引起消化功能紊乱,破坏正常钙磷比。在铝污染土壤上通过适当的方法限制铝从土壤进入植物根系、控制植物对铝的吸收是十分必要的。本课题主要研究同一植物种类不同品种间的耐铝能力存在明显的基因型差异。
本课题以苜蓿、大豆、水稻的多个品种为材料,研究其在生长过程中受铝的胁迫导致生理形态的变化情况,以及受铝胁迫后植物根尖铝的含量,并选出同类植物中耐铝能力较好的植物品种,为有效解决酸性土壤中的铝毒害提供有效途径,并为后续的通过转基因技术培育耐铝品种奠定基础。
1 材料与方法
1.1 供试作物品种及来源
试验中共筛选23个水稻品种、12个苜蓿品种、14个大豆品种。
供试水稻品种:Ⅱ优92、菲优多系1号、Ⅱ优838、德龙2000、Ⅱ优3027、富优1号、Ⅱ优2070、协优92、Ⅱ优6216、Ⅱ优8220、明优98、Ⅱ优46、协优9019、Ⅱ优63、协优982、协优9308、金优987、e富丰优11、红良优166、协优63、Ⅱ优8006、Ⅱ航优148、协优46。
供试苜蓿品种:阿尔冈金、巨人201、金皇后、WL-323HQ、WL-525HQ、周产紫花苜蓿、皇冠、飞马、驯虎、WL-232HQ、胖多、猎人河。
供试大豆品种:矮脚青8901、引豆9707、春丰早、台湾毛豆、日本青、科源1号、辽新1号、科源3号、028-289、浙秋2号、0290-236、029-15、029-238、029-290。水稻和大豆从金华种子公司购买,苜蓿从北京种子公司购买。
1.2 育苗培养与处理
种子用1%次氯酸钠浸泡消毒30 min后,蒸馏水清洗6次,每次清洗5 min,以除去漂浮、膨胀、软化和被污染的种子,然后在蒸馏水中浸泡(苜蓿24 h、大豆4 h、水稻24 h),将种子转入培养皿内,倒掉蒸馏水,但要使种子保持湿润,让种子继续催芽。待种子根长长到1 cm左右时,继续使种子生长,待种子根长长到2 cm左右时,可以将其移入盆中对照培养。本试验是在浙江师范大学的实验室培养箱中培养,水稻、苜蓿、大豆的培养条件都有所不同。其中水稻的培养条件为白天14 h、30 ℃,夜间10 h、25 ℃,湿度为70%,苜蓿的培养条件为白天14 h、25 ℃,夜间10 h、20 ℃,湿度为70%,而大豆的培养条件为黑夜24 h、25 ℃,湿度为70%。选取根长相近的幼苗在外面包有2层黑色塑料薄膜的盆中进行隔离培养处理,盆内培养24株幼苗,溶液体积为1 L,在盆上放一泡沫,在每个泡沫上打24个洞,每个洞内移植1株幼苗。对照组的溶液氯化钙的浓度为0.5 mmol/L,而试验组的溶液氯化铝的浓度和氯化钙的浓度分别为0.05 mmol/L和0.5 mmol/L。所有溶液的pH值用HCl调到4.5(由于苜蓿本身营养不是很丰富,故苜蓿用营养液培养,其中试验组要另外加氯化铝,营养液中氯化铝的含量为0.05 mmol/L)。营养液配制如表1、2所示。
1.3 测定内容与方法
1.3.1 植株生长量测定。植株生长2 d后测定对照组和Al处理的试验组植株的株高和根长度变化,以及株高、根长的增加量。并计算相对根伸长量和相对株高伸长量。根系相对伸长量可用于估计耐铝的基因型差异。计算方法如下:
根相对伸长量(%)=试验组的根伸长量/对照组的根伸长量×100;
株高相对伸长量(%)=试验组的株高伸长量/对照组得株高伸长量×100;
相对Al含量(%)=试验组的OD值/对照组OD值×100。
1.3.2 根尖相对铝含量的测定。经过培养48 h后,试验组用氯化钙溶液冲洗,去除植物根部表面上的Al,再用蒸馏水清洗,对照组直接清洗,洗后切下2 cm的根尖,用0.5 mmol/L 0.2%的苏木精和0.02%的KIO3混合液染色15 min,用蒸馏水洗脱15 min,对照组和试验组的根各分3组(每组8根),经3 mL 1 mol/L的HCl脱色1 h后,用UV-7504紫外可见分光光度计在490 nm下测植物根尖的分光光度值(这步非常重要,也是估计耐铝的基因型差异的关键一步)。
2 结果与分析
2.1 对水稻幼苗根长和株高及根尖相对铝含量的影响
水稻幼苗经50 μmol/L的铝处理后,铝对水稻株高、根长的影响不同。在Al浓度为50 μmol/L时,对水稻幼苗株高和根长都有影响。对根长的抑制作用则更大(图1)。孔繁翔等[7]、郝鲁宁等[8]认为,铝对植物毒害作用最明显的特征是抑制了根尖细胞伸长和细胞分裂,根比地上部分对铝更敏感。本试验也反映低浓度铝处理时,水稻幼苗受铝的影响,根较植株受铝的影响要更显著,铝对根有较大的抑制。然而有极少数品种在低浓度下,株高呈现刺激植物的生长。秦瑞君等[9]指出,少量铝的存在可刺激植物的生长。本试验也证实了这一观点(图2)。
由图1可知,富优1号、Ⅱ优63、协优9308和红良优166这几个品种的根相对伸长率比较低,说明这几个品种受Al的影响比较大,受Al毒的抑制造成的,而根相对伸长率比较高的品种则是菲优多系1号和Ⅱ优838,说明这2个品种受Al毒的影响比较小,这也正是本试验筛选所要的品种。通过Spass分析可知,水稻各品种的根相对伸长率存在显著性差异。
由图2可知,株高相对的伸长率基本都在60%以上波动,只有Ⅱ优3027、富优1号品种的株高受Al毒的影响比较大,而Ⅱ优8220、明优98和Ⅱ优8006的株高相对伸长率则出现大于100%,可能是由于低浓度的Al反而刺激了株高的伸长。结合图1和图2可知,富优1号受Al毒的影响很大,对其株高和根的抑制都很大,该水稻品种则不适于在酸性土壤种植,且该水稻品种中的Al含量可能大于其他品种的水稻。
试验对23个水稻品种的根部染色,测得它们的相对Al含量,如图3所示。菲优多系1号、Ⅱ优838、协优92、Ⅱ优6216、明优98、协优9019这5个品种的相对Al含量最小,说明它们根尖的铝含量较低,是比较耐铝的品种,而富优1号、Ⅱ优46、协优9308和e富丰优11的相对Al含量较大,则说明试验的较对照的易吸收铝,试验较对照根尖的铝含量多,因此它们是不耐铝的品种,即不是所要选择的品种。富优1号、Ⅱ优46、协优9308和e富丰优11的相对Al含量都是Ⅱ优838的4倍左右,因此这2个品种水稻不适于种植在酸性的土壤中,农民尽量不要種这种水稻,因为这种水稻含有很多的铝,对人的身体有害,长时间食用铝导致其在人身体内积累,也许会破坏人体的内分泌系统,损伤神经,甚至会导致老年痴呆症。结合图1、图2和图3所得出的结论,可知菲优多系1号、Ⅱ优838是所有筛选品种中耐铝性最好的,这为广大的农民种植何种水稻提供了有效的参考。通过Spass分析可知,水稻各品种的株高相对伸长率和根尖的相对Al含量存在显著性差异。
2.2 对苜蓿幼苗根长和株高及根尖相对铝含量的影响
苜蓿幼苗经过处理后各个品种对照和试验的根长都有一定的抑制作用,但抑制作用不是很大且这种影响相比水稻来说要小一点,这说明Al毒对苜蓿的影响不太强,表明苜蓿是一种耐铝性较强的植物。因此,应该大力推广这种植物作为动物的饲料。由图4可知,12个苜蓿品种除了阿尔冈金和巨人201之外,其他品种的根相对伸长率都在60%以上,其中金皇后、WL-323HQ、驯虎、WL-232HQ、胖多、猎人河这几个品种根相对伸长率都在80%以上,受Al毒的影响比较小,而阿尔冈金和巨人201受Al毒的影响比较大都在50%以下,这2个品种在酸性土壤中则根部含有的Al含量较多,对动物来说食用这种植物对它们的身体是有害的,另外通过食物链的作用对人类也是有一定影响的。因此,应该大力发展金皇后、WL-323HQ、驯虎、WL-232HQ、胖多、猎人河等这些耐铝的苜蓿品种。通过分析可知,苜蓿各品种的根相对伸长率存在显著性差异。
苜蓿的株高受Al毒的影响相比根受Al毒的影响来说还要小,一方面说明苜蓿是耐铝的,另一方面更说明Al毒对植物的作用主要体现在植物的根部,而不是地上部分,对地上部分的影响很小。由图5可知,所有苜蓿品种的株高相对伸长率都在70%以上,WL-323HQ、皇冠和猎人河3个品种株高相对伸长率都接近100%,说明Al对这3个品种的株高几乎没有影响,此外金皇后的株高相对伸长率也在90%以上,受Al的影响也十分小。结合图4和图5可知,金皇后、WL-323HQ和猎人河这3个品种最优,一是因为它们的相对根伸长率都比较高,受铝的影响小;二是因为它们的株高相对伸长率也都在90%以上,受铝的影响十分小,再加上因为株高的大小就是这种植物提供给动物食物的多少,结合这几点可认为金皇后、WL-323HQ和猎人河这3个品种是最优的,是耐铝性品种。另外,通过对相对Al含量的测定来进一步确认耐铝性苜蓿品种。通过分析可知,苜蓿各品种的株高相对伸长率存在显著性差异。
苜蓿的株高受Al毒的影响相比根受Al毒的影响来说还要小,一方面说明苜蓿是耐铝的,另一方面说明Al毒对植物的作用主要体现在植物根部,而不是地上部分,对地上部分的影响很小(图5)。
由图6可知,金皇后的相对Al含量最小,接近100%,也就是说对照和试验的金皇后根尖吸收的铝含量相差不多,WL-323HQ次之,相对Al含量最大的是巨人201,为330%左右,是金皇后的3倍多、WL-323HQ的2倍多。大部分品种的相对Al含量范围在150%左右。由图4、图5、图6可知,最耐铝的苜蓿品种是金皇后和WL-323HQ,敏感性品种是巨人201。通过分析可知,苜蓿各品种的相对Al含量存在显著性差异。
2.3 对大豆幼苗根长和株高及根尖相对铝含量的影响
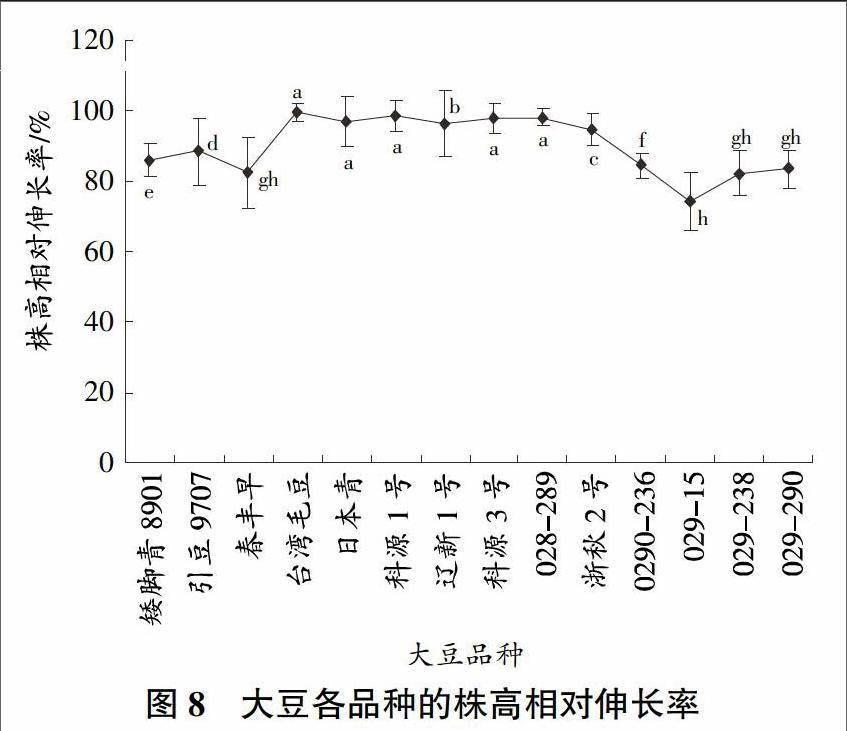
本试验结果表明,经过铝处理的大豆的根长要明显矮于未经过铝处理的大豆,而且经过铝处理后的大豆的根部都呈现一定的红色,可见铝毒能够抑制大豆根部的生长,影响大豆植株对营养成分的吸收。大豆的根相对伸长率基本分布在70%以下,这说明铝毒对大豆根部的影响还是比较大的,根部受影响最大的品种是辽新1号,根相对伸长率在40%以下,相对影响最小的品种是029-236,它的根相对伸长率在75%左右,大约是辽新1号根相对伸长率的2倍,其次是029-15、029-238、029-290和矮脚青,它们的根相对伸长率也都在65%左右。因此,在这些大豆品种中根部比较耐铝的品种是029-236、029-15、029-238、029-290和矮脚青(图7)。大豆根系迅速吸收和积累A1但地上部分铝累积并没有明显的变化,受铝毒的影响和地上部分相差很大,它们的相对株高伸长率基本上都在80%以上(图8),其中台湾毛豆、科源1号、科源3号和029-289的株高相对伸长率都接近100%,几乎不受任何影响,日本青和辽新1号也都在90%以上,影响最大的是春丰早、029-15、029-238和029-290,也都在75%以上。大豆株高相对伸长率都比较接近,相差不多,差距最大的是台湾毛豆和029-15,相差25%以上,株高相对伸长率相对根长的伸长率的波动要小得多,可见铝毒对株高的影响相比根要小得多。大豆的根部是吸收铝毒的主要部位。从植物的株高来看,台湾毛豆、科源1号、科源3号和029-289这4个品种最好,日本青和辽新1号2个品种次之,株高相对伸长率较好的是029-15、029-238和029-290。在综合考虑中要把大豆根相对伸长率因素放在第1位。通过分析,大豆各品种的根相对伸长率和株高相对伸长率存在显著性差异。
大豆品种受铝毒的影响和水稻、苜蓿基本相同,都是根部的铝含量明显大于地上部分。根部是植物吸收营养最主要的部位,植物根部的铝含量多少对植物的影响很大。在筛选的大豆品种中,相对Al含量最少的品种是辽新1号,仅为130%左右,较大的品种是引豆9701和春丰早,分别为500%和400%以上,分别是辽新1号的4倍、3倍左右。除辽新1号外,029-289、浙秋2号和029-15也都在250%以下,029-238和029-290较大,它们的相对Al含量在350%左右,相对Al含量越大,说明根部铝含量越大,越不耐铝,反之则越耐铝。引豆9701和春丰早的根部相对Al含量最大,029-289、浙秋2号、029-15和029-290较小,辽新1号最小(图9)。综上考虑,结合图7和图8可知,029-15是耐铝品种,是试验最终所要的品种。敏感性品种是春丰早。通过Spass分析,大豆各品种的相对Al含量存在显著性差异。
3 结论与讨论
本试验结果表明,在50 μmol/L的铝溶液处理下,铝毒被植物根部吸收明显大于地上部分的吸收,根据各个品种对铝毒的吸收情况,来筛选出耐铝性好的品种,对提高它们的质量起到了非常重要的参考价值。铝离子是酸性土壤上作物生长最主要的限制因子[10]。不同的作物、同一作物的不同品种间,其耐铝性可能存在差异。在玉米、大豆、水稻、大麦、小麦、苜蓿、马铃薯、番茄等作物中都观察到耐铝性的基因型差异[11-12],在本试验中也发现,不同品种的水稻、苜蓿和大豆对铝的耐性具有基因型差异[13-14]。肉眼可见的铝毒症状包括根伸长生长的抑制[15]、根尖膨大[16]、表皮脱落[17]等。由于根尖比成熟的根部组织积累更多的铝,因此根尖被認为是铝毒的最初作用部位[18-19]。在含铝营养液中。种子根净增长度和种子根相对伸长长率可用于玉米耐铝性的早期鉴定[20-11]。苏木精染色广泛用于细胞遗传研究,也可用少水稻、苜蓿和大豆早期无损伤性的耐铝性鉴定[21-22]。本文研究结果显示,所用筛选材料对铝胁迫的反应具有基因型差异。耐铝基因型具有植株相对生物量较高、根系生长受抑制程度相对较低和的苏木精着色程度较低等共同特点。
根部性状作为耐铝性的评价指标为大量研究所采用。测定溶液培养中根长(主根)对Al3+的反应已成为植物耐铝性鉴定的通用方法。Magnavaca研究认为,在营养液培养中,采用根长法评价玉米自交系耐铝性的最佳铝浓度为6 mg/L,目前已发展成为热带玉米种质耐铝性筛选的有效方法,且与其他筛选技术具有很好的相关性[11]。在本试验中0.05 mmol/L Al3+为适宜的铝处理浓度。在这种胁迫条件下,种子根净增长度(NSRL)和相对伸长率(RSRL)变幅较大。本文将水稻、苜蓿和大豆种子根相对伸长率(RSRL)定义为铝胁迫与对照的种子根净增长之比,由于考虑了各品种根系生长的自身特性,因此较种子根净增长度(RSRL)更适宜于耐铝性的评价。在本研究中RSRL与植株地上部及整株相對生物量之间相关显著,各品种的耐铝性评价结果与以前土培试验中的耐酸性筛选结果[13]基木一致。而RSRL与植株相对生物量相关不显著,这与Magnavaca等的研究结果一致,他们的分析表明,在铝(0.185 mmol/L,Al3+)处理条件下,最初(铝处理前)种子根长(RSRL)与NSRL存在极显著的相关关系,但与RSRL相关不显著[19]。因此,测定RSRL可作为一种快速简便、准确可靠的耐铝性鉴定方法。关于高等植物铝毒的机理目前知之甚少,许多方面尚停留在假说阶段[23-24]。一般认为,铝毒症状是由于Al3+与根尖的相互作用导致根的发育被抑制所引起的。Morinmla等[19]用1 mol/L AlCl3处理洋葱根尖,2 h后即可观察到细胞分裂受阻,8 h后细胞分裂完全停止。本研究结果显示,铝处理2 d后,根尖明显膨大,根系表皮脱落,而耐铝基因型根系受抑制程度则明显较轻。李德华、贺立源等研究发现,耐铝品种在铝处理3 d后的根尖有胶状物质,估计这是植物耐铝的机制之一。也许附着在植物根尖上胶状物质可与上壤中的铝结合,减少根尖对铝的接触机会[25]。研究发现,有胶状物质附着的根经过铝处理后分别测定保留和除去胶状物质的根尖含铝量,结果前者大于后者。这说明根系分泌的胶状物质可以和铝结合[26]。
根际环境中铝的生态化学行为、根系分泌物和微生物的生态毒理效应受多种因素影响,且这此因素之间又相互影响、相互制约。本试验没有对这些进行深入研究。随着学科的发展以及研究技术手段的进步,可望从宏观向微观乃至分子、基因水平在以下几方面开展深入研究:一是完善根系分泌物的收集、分离和鉴定技术,建立根系分泌物原位收集方法。二是运用生物工程技术,揭开铝胁迫对植物根细胞膜酶活性的变化规律,耐铝酶活性与根系分泌物种类和浓度之间的关系,根尖释放的分泌物与根尖细胞膜选择透性之间的关系,酶在根系分泌物与铝络合反应中的催化机理等。三是运用基因工程技术,加强植物抗铝基因反应机制以及植物遭受铝毒时基因组变化的研究,积极运用抗铝基因的定位克隆和转基因等技术选育抗铝性强的植物新品种。
4 参考文献
[1] WANGATSUMA T,YAMASAKN K.Relationship between differential aluminum tolerance and plant induced pH change of medium among barley cultivars[J].Soil Science Plant Nutrition,1987,31(4):521-535.
[2] 杨志敏,汪瑾.植物耐铝的生物化学与分子机理[J].植物生理与分子生物学学报,2003,29(5):361-366.
[3] 肖凤娟,张欣杰.铝、镁、锌、锰等金属离子与钙调素相互作用研究进展[J].河北省科学院学报,2003,20(2):163-167.
[4] 应小鹏,刘鹏,徐根娣.土壤中的铝及其植物效应的研究进展[J].生态环境,2003,12(2):237-239.
[5] LARSEN P B,STENZLER L M,TAI CY,et a1.Molecular and physiological analysis of Ambidopsis uzutnuts exhibiting altered sensitivities to aluminum[J].Plant and Soil,1997,192:3-7.
[6] LAZOF D B,GOLDSM IN JG,RUFTH T W.Rapid up-take of aluminum into cells of intact soybean root tips Amicroanalytical study using sceondary in mass species-toxicity[J].Plant Physiology,1994,106(3):1107-1114.
[7] 孔繁翔,桑伟莲,蒋新,等.铝对植物毒害及植物抗铝作用机理[J].生态学报,2000,20(5):855-861.
[8] 赫鲁宁,刘泞田.铝对水稻幼苗的生理影响[J].植物学报,1989,27(11):847-853.
[9] 秦瑞君,陈福兴.湘南红壤作物苗期铝中毒的研究[J].植物营养与肥料学报,1999,5(1):50-55.
[10] MA J F,RYAN P R,DELHAIZE E.Aluminum tolerance in plants and the complexing role of organic acids[J].Trends in Plant Science,2001,6:273-278.
[11] CANCADO G M A,LOGUERCIO L L,MARTINS P R,et al.Hematoxylin staining as a phenotypic index for aluminum tolerance selection in tropical maize(Zea mays L.)[J].Theor Appl Genet,1999,99:747-754.
[12] 黄邦全,自景华,薛小桥.植物铝毒害及遗传育种研究进展[J].植物学通报,2001(18):385-395.
[13] 贺立源,徐尚忠,李建生.玉米自交系苗期耐酸的生物学和营养学特性[J].作物学报,2000(26):205-209.
[14] 李德华,贺立源,刘武定.耐铝的和对铝敏感的玉米自交系根系的有机酸分泌[J].植物生理与分子生物学学报,2003,29(2):114-120.
[15] DELHAIZ E,ROAN P R.Aluminum oxicity and tolerance in plants[J].Plant Physiol,1995,107:315-321.
[16] JONES D L,KOCHIAN L V.Aluminum inhibition of 1,4,5-trisphosphate signal transduction pathway in wheat roots:a role in aluminum[J].Toxicity Plant Cell,1995:1913-1922.
[17] LARSEN P B,DEGENHARDT J,TAI C Y,et al.ArabodopsisMut-ants with increased aluninum resistance exhibit altered patterns of aluminumaccumulation and organic:acid release from roots[J].Plant Phaysiol,1998,117:9-17.
[18] DELHAIZE E,RYAN P R.Aluminum toxicity and tolerance in plants[J].Plant,1995,107:315-321.
[19] MORINMLA S,TAKAHASHI E,MATSUMOTO H.Association of alum-inum with nuclei and inhibition of cell division in onion(Allium cepa)roots[J].Z. Pflarcenphysiol,1978,88:395-401.
[20] MAGNAVACA R.Genetics Aspects of Plant Mineral Nutrition[J].Martinus Nitrition off Publishers,1987,88:201-212.
[21] RYAN P R,DITOMASO J M,KOCHIAN L V.Aluminum toxicity in roots:an investigation of spatial sensitivity and role of the cap[J].J Exy Bot,1993,44:437-446.
[22] JORGE R A,ARRUDA P.Aluminum induced organic acids exudation by roots of an aluminum-tolerant tropical maize[J].Phytochenaistry,1997,45:675-681.
[23] TAYLOR G J,MCDONALD-STEPHENS J L,HUNTER D B.Direct Measure ment of aluminum uptake and distribution in single cell of Chara corallina[J].Plant Plysiol,2000,123:987-996.
[24] YAMAMOTO Y,KOHAYASHI Y,MATSUMOTO H. Lipid peroxidation is an early symptom triggered by aluminum,but not the primary cause of elongation inhibition in pea roots[J].Plant Physiol,2001,125:199-208.
[25] HENDERSON M,OWNBY J D.The role of root cap mucilage secration in aluminum tolerane in wheat[J].Curr Top Plant Biochem Plysiol,1991,10:134-141.
[26] 黎曉峰,马建锋,松木英明.玉米根冠粘胶和铝的结合及有机酸累积[J].植物生理与分子生物学学报,2002(28):121-126.

