鲢鱼鱼鳞胶原蛋白抗氧化钛的结构鉴定
陈日春,郑宝东
(1.福建赛福食品检测研究所有限公司,福建福州350000;2.福建农林大学食品科学学院,福建福州350002)
鲢鱼鱼鳞胶原蛋白抗氧化钛的结构鉴定
陈日春1,郑宝东2
(1.福建赛福食品检测研究所有限公司,福建福州350000;2.福建农林大学食品科学学院,福建福州350002)
为了对鲢鱼鱼鳞胶原蛋白抗氧化肽进行结构鉴定,连续采用DEAE-52阴离子交换层析、Sephadex G-15葡聚糖凝胶层析和RP-HPLC对相对分子量小于1kU的抗氧化肽(SCSCP)进行分离纯化,再通过SDS-PAGE、质谱、傅里叶红外光谱等方法进行抗氧化肽鉴定。本方法分离纯化的结果得到高纯度抗氧化肽,其相对分子量为576.9,由Glu、His、Pro和Tyr组成,4种氨基酸的摩尔比为n(Glu):n(His):n(Pro):n(T yr)=1:1:1:1;氨基酸序列为HPEY(His-Pro-Glu-Tyr)。经检索,此为一种新型抗氧化肽。
鲢鱼;胶原蛋白;抗氧化肽;结构鉴定
自从Marcuse[1]第一次报道蛋白肽的抗氧化作用以来,关于动植物蛋白水解物或肽的抗氧化特性的研究报道非常多,例如向日葵[2]、苜蓿叶[3]、鲭鱼肌肉蛋白[4]、牛皮明胶[5]、金枪鱼鱼骨[6]等。由于每年都有数量庞大的鱼类加工副产物(鱼皮、鱼骨、鱼鳞等)形成,这些副产物通常被认为是低值资源,其市场及潜在价值被忽略。此外,对这些鱼类加工副产物的不当处理还是造成环境污染的主要因素。胶原蛋白作为一种结构蛋白,在鱼类加工副产物(鱼鳞、鱼皮、鱼骨等)中含量非常丰富,充分利用这些胶原蛋白生产高附加值的活性肽,不仅能够变废为宝,还能一定程度上减少环境污染。采用生物酶解技术将这些副产物转化成市场可接受的高附加值产品,已经被广泛应用于食品领域。因此利用不同种类的鱼类加工副产物生产抗氧化水解物和肽引起了研究人员极大的关注,例如阿拉斯加鳕鱼[7]、军曹鱼[8]、巨型鱿鱼[9]等。
因此利用鲢鱼鱼鳞生产胶原蛋白,并进一步采用生物酶解技术制备胶原蛋白抗氧化活性肽,不仅可作为天然的抗氧化剂使用,提高鱼类加工副产物的市场及潜在价值,还可以增加就业和商业机会,具有广阔的市场前景与积极的现实意义。
然而,尽管上述的鲢鱼鱼鳞胶原蛋白抗氧化肽(SCSCP)已经过初步纯化,但毕竟还是以肽为主的含有蛋白质和氨基酸等物质的混合体系,而且由于肽分子的大小、组成和结构等方面的多样性和复杂性,要进一步了解鲢鱼鱼鳞胶原蛋白肽中抗氧化活性较好的肽链及其表现出抗氧化活性的机理,就需要利用各种分离技术对其进行进一步分离纯化而获得明确的活性肽的组成,并进行结构鉴定,从而找到肽段结构与活性之间的关系,为明确鲢鱼鱼鳞胶原蛋白抗氧化活性肽的作用机理做铺垫。
1、实验部分
1.1 主要试验材料与试剂

鲢鱼鱼鳞 收集于福州市华林路永辉超市EUE-52纤维素填料 南京都莱生物科技有限公司葡聚糖凝胶Sephadex G-15 南京都莱生物科技有限公司其它化学试剂均为分析纯或优级纯
1.2 主要试验仪器

旋转蒸发仪 上海亚荣生化仪器厂SPD-20A高效液相色谱 日本岛津公司Capell pack C18 UG120(ø20×250mm)色谱柱 日本资生堂Zorbax SB-C18(ø4.6×250 mm)色谱柱 美国安捷伦公司4700 ProteomicsAnslyzer 串联飞行时间质谱仪 Applied Biosystems, USA
1.3 试验方法
1.3.1 SCSCP的制备
鱼鳞→除杂→清洗→晾干(含水量17%)→EDTA溶液浸泡脱钙(料液比1:30,EDTA浓度0.17mol/L,浸泡时间30h)→清洗至中性→氢氧化钠溶液浸泡脱杂蛋白(料液比(w/v)1:8,氢氧化钠溶液浓度0.1mol/L,浸泡时间6 h)→酶法提取胶原蛋白(液料比(v/w)18.0,胃蛋白酶添加量25.51U·mg-1,提取时间61.9h)→300目滤布过滤→滤液→盐析(0.9mol/L氯化钠,盐析24h)→10ku透析袋中透析24h→冻干→胶原蛋白→酶解(底物浓度5.47%,酶解时间4.24h,酶添加量4200U·g-1)→依次采用5ku、3ku和1ku超滤膜过滤→滤液干燥→SCSCP。
1.3.2 离子交换层析分离纯化抗氧化肽
取适量SCSCP冻干样品,溶于Tris-HcL缓冲溶液(20mmol/L,pH8.0),配成20mg/mL的样品溶液备用。将EUE-52填料装入玻璃层析柱(2.5×60cm)中,采用Tris-HcL缓冲溶液(20mmol/L,pH 8.0)对层析柱进行平衡洗脱,取4mL样品溶液上柱,用0-2.0mol/L的氯化钠溶液进行线性梯度洗脱,流速1.0mL/min,采用自动部分收集器收集洗脱液,4mL/管,同时采用紫外检测器进行跟踪检测215nm处的吸光度,最后将属于同一峰的收集液混合,冻干后分析其对和·OH自由基的清除能力。
1.3.3 凝胶层析分离纯化抗氧化肽
将处理好的葡聚糖凝胶SephadexG-15装入玻璃层析柱(1.5×100cm),用蒸馏水平衡凝胶层析柱。将离子交换层析法分离所得的抗氧化活性最强的组分溶于蒸馏水配制成20mg/mL的溶液,取4mL上柱,用蒸馏水进行洗脱,流速1mL/min,用自动部分收集器收集洗脱液,4mL/管,同时采用紫外检测器跟踪检测215nm处的吸光度,最后将属于同一峰的收集液混合,冻干后分析其对和·OH自由基的清除能力。
1.3.4 反相高效液相色潽法(RP-HPLC)分离纯化抗氧化肽
采用RP-HPLC对凝胶层析法分离纯化所得抗氧化活性最强的肽段作进一步分离。RP-HPLC分离分两步进行,第一步采用半制备柱Capell pack C18 UG120(20×250mm)进行分离;流速2 mL/min;取浓度为10mg/mL样品1mL进样,采用含有0.1%三氟乙酸的乙腈溶液(0-40%v/v)进行线性梯度洗脱。于波长215nm下进行检测,最后将属于同一峰下的组分收集混合,冻干后分析其对和·OH自由基的清除能力。
第二步RP-HPLC,取第一步RP-HPLC分离所得的抗氧化活性最强的肽段50μL进样。检测条件:色谱柱:Zorbax SB-C18(4.6×250mm),流速1mL/min,采用含有0.1%三氟乙酸的乙腈溶液(0-20%v/v)进行线性梯度洗脱,检测波长215nm。最后将同一峰下的组分收集混合,冻干后分析其对和·OH自由基的清除能力。
1.3.5 抗氧化肽的氨基酸组成分析
取鲢鱼鱼鳞胶原蛋白样品(10-20mg)置于6mol/L盐酸溶液中,于110℃真空条件下酸水解24h,然后采用氨基酸分析仪测定水解液中氨基酸组成。
1.3.6 MALDI-TOF-TOF MS质谱分析抗氧化肽
质谱仪:4700proteomicsAnalyzer(TOF/TOF)串联飞行时间质谱仪;
分析软件:4700 Explorer;
点样方式:先点0.5μL的样品于MALDI不锈钢靶板上,自然干燥后,再点上0.5μL 0.5g/Lα-氰基-4-羟基肉桂酸(CCA)溶液(溶剂为0.1%三氟乙酸+50%的乙氰)中,在室温下自然晾干。另点0.5μL 0.5g/LCCA 溶液(不加样品)作为空白对照。
激光源为355nm波长的Nd:YAG激光器,加速电压20kV,采用正离子模式和自动获取数据的模式采集数据。仪器先用myoglobin酶解肽段进行外标校正。基质和样品的PMF质量扫描范围为相对分子质量为100-1000。经MS测定后,直接选择与对照基质的PMF图有差异的肽段离子进行MS/MS分析。
1.3.7 DPPH·自由基清除活性的测定
DPPH·自由基清除活性的测定参照Shimau等的方法略作修改。取2.5mL样品液置于试管中,加入2.5L溶于95%乙醇的DPPH溶液(0.1mmol/L),将混合物激烈振荡10s,然后置于室温下反应30min,反应结束后,于517nm下测量反应混合物吸光度,同时以2.5mL蒸馏水代替样品液做空白对照。样品液对DPPH·自由基清除活性按式(3-2)计算:

式中:B0为空白对照吸光度,B为样品吸光度。
自由基清除活性的测定参照Wang等的方法略作修改。取1mL样品溶液置于试管中,加入1mL氯化硝基四氮唑蓝(NBT,2.52mmol/L)和1mL烟酰胺腺嘌呤二核苷酸(624mmol/L),添加1mL吩嗪硫酸甲酯溶液(PMS,120μmol/L)启动反应,于25℃下反应5min后测量产物560nm处吸光度,同时以蒸馏水代替样品液做空白对照。样品液对自由基的清除活性按式(3-3)计算:
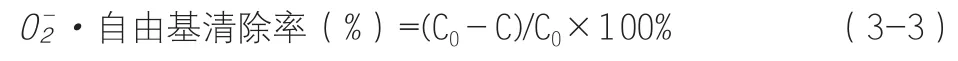
式中:C0为空白对照吸光度,C为样品吸光度。
1.3.9 ·OH自由基清除活性的测定
·OH自由基清除活性的测定参照Wang等的方法。在该方法中,·OH自由基通过Fenton反应形成。羟自由基能够将二价铁离子氧化成三价铁离子,并且只有二价铁离子能与1,10-菲啰啉结合生成红色化合物,该化合物在波长为536nm处有吸收。羟自由基的浓度反映了反应液的脱色程度。取1.0mL1,10-菲啰啉(1.865mmol/L)与2.0mL样品液于具塞试管中混合,加入1.0mLFeSO4·7H2O(1.865mmol/L),最后加入1.0mLH2O2溶液(0.03%,v/v)启动反应,将试管置于37℃水浴中反应60min,于536nm处测量反应混合液吸光度,并以蒸馏水代替样品液做阴性对照,以蒸馏水代替过氧化氢作为空白对照。样品对·OH自由基的清除活性按式(3-4)计算:
2018年丰盛控股的旅游业务布局已经初具规模,在直接或间接入股途牛和驴妈妈两大OTA平台的基础上,公司也先后与美团、同程、携程、八爪鱼等网站开展了合作。公司搭建旅游供应链平台不到一年时间,已和上百家旅行社达成业务合作,除了在业务上帮助出境游的旅行社在海外代采以外,丰盛控股已经实现为国内旅行社代为购买机票、酒店、门票、线路产品等业务。2019年,丰盛控股将加大文旅产业的投资布局,同时深耕旅游供应链平台的业务发展。
·OH自由基清除率(%)=(D-D0)/(D0-D1)×100% (3-4)
式中:D为样品吸光度,D1为阴性对照吸光度,D0为空白对照吸光度。
1.3.10 数理统计
采用DPS7.05软件进行单因素方差分析,组间比较采用Tukey法,P<0.05表示差异显著。实验结果以平均值±SD表示。
2、结果与分析
2.1 离子交换层析分离纯化抗氧化肽
如图1所示,SCSCP经DEAE-52纤维素离子交换层析分离后,依次收集到A、B、C、D、E五个组分。其中A-C为未结合组分,D和E为结合组分,由于DEAE-52纤维素为阴离子交换树脂,因此可初步判断A-C为碱性肽段,D和E为中性或弱酸性肽段。分别考察各组分对自由基的清除活性,结果如图2所示。组分E对自由基的清除活性最强(P<0.05),对DPPH·、O-·和·OH的清除率分别为83.83±0.58%、56.43±1.27%和65.47±0.75%。

图1 离子交换层析分离纯化组分SCSCPFig.1 Separation of fraction SCSCP-IV by ion-exchange chromatography.

图2 离子交换层析分离纯化组分SCSCP后各产物对自由基的清除活性Fig.2 Free radical scavenging activity of fractions obtained by ionexchange chromatography
2.2 凝胶层析分离纯化抗氧化肽
凝胶层析的原理是不同的溶质因不同程度进入分离介质而在液相中停留的时间不同,凝胶的孔径和溶质分子大小的关系决定了层析时该溶质在层析柱中的保留时间,不同的物质因保留时间不同而分离。
由于SCSCP是经截留分子量为1ku的超滤膜分离后的产物,因此采用Sephadex G-15葡聚糖凝胶层析对离子交换层析得到对自由基清除活性较强的组分E进一步纯化,结果如图3所示。收集到E1、E2和E3三个组分,其中E1的洗脱体积最小,分子量最大;E3洗脱体积最大,分子量最小。分别测定E1、E2和E3组分对自由基的清除率,结果如图6-4所示。组分E3的自由基清除活性最强(P<0.05),对DPPH·、O-·和·OH的清除率分别为90.70±0.70%、75.72±2.25%和80.63±选择E3组分作进一步纯化。

图 3 凝胶层析法分离纯化组分EFig.3 Separation of fraction E by gel filtration chromatography

图4 凝胶层析法分离组分E后所得各组分的自由基清除活性Fig.4 Free radical scavenging activity of fractions obtained by gelfiltration chromatography
2.3 反相高效液相色潽法(RP-HPLC)分离纯化抗氧化肽
反相层析(reversed phase chromatography,RPC)是根据溶质与固定相之间的疏水作用,在非极性固定相上,用极性相对较大的液体作为流动相,进行物质分离分析的一种液相层析方法,是目前高效液相层析分离中最广泛的一种分离模式。
如图5所示,E3组分经RP-HPLC分离纯化后,收集到9个组分,分别考察这9个组分对自由基的清除活性,结果如图6所示。组分E3-4对的活性最强(P<0.05),对DPPH·、O-·和·OH的清除率分别为91.80±1.08%、79.23±4.10%和82.17±2.35%。选择E3-4进行下一步的纯度鉴定。

图5 反相高效液相色谱法分离纯化组分E3Fig.5 Separation of fraction E3 by RP-HPLC

图6 反相高效液相色谱法分离组分E3后所得各组分的自由基清除活性Fig.6 Free radical scavenging activity of fractions obtained by RP-HPLC
2.4 抗氧化肽的纯度鉴定
2.5 抗氧化肽的氨基酸组成

图7 组分C3-4 的 RP-HPLC分析图谱Fig.7 Analytical RP-HPLC chromatography of Fraction C3-4
对组分E3-4进行氨基酸组成分析,为后面的测序工作提供一定的基础,结果如图8所示。组分E3-4中含有4种氨基酸,分别为谷氨酸、组氨酸、脯氨酸和酪氨酸,且4种氨基酸的摩尔比为n(gl u):n(his):n(pro):n(tyr)=1:1:1:1。
2.6 MALDI-TOF-TOF MS质谱分析抗氧化肽

图8 组分C3-4的氨基酸组成分析图谱Fig.8 Amino acid composition analysis chromatography of Fraction C3-4
MALDI-TOF是目前蛋白质鉴定中精确测定相对分子质量的手段,特别适合对混合蛋白多肽类物质的相对分子质量的测定,具有测定速度快、效率高、操作容易、灵敏度和分辨率高且样品用量少(pmol水平)等优点;同时结合液相色谱的联用技术可以高效率的鉴定多肽物质;特别是当各种原理的质谱技术串联应用时,不但可以得到多肽的相对分子质量信息,还可以测定它的序列结构。本章采用 MALDI-TOF/TOF MS 和 TOF-MS/MS来测定抗氧化肽段 E3-4的质量指纹图谱和氨基酸序列。实验结果如图9和图10所示。
图9是组分E3-4的一级质谱图,图中的横坐标为离子的质荷比(m/z),纵坐标为离子强度。在图6-8中577.9的峰是E3-4片段质子化后离子([M+H]+)的峰,所以减去一个H+质子后,得到的576.9就是E3-4片段的相对分子质量,这与氨基酸组成分析中估算的分子量相符。图谱中的其他质荷比是一些杂肽质子化后的离子峰,所有相对分子质量的计算结果均是使用Peptide Companion软件得到。
MALDI-TOF/TOF MS技术不仅能够准确测定肽段的相对分子质量,还可以直接预测肽段中的氨基酸排列顺序。将一级质谱中离子强度最高的母离子,进入二级质谱,使用惰性原子碰撞肽段使其肽键断裂,通过计算得到的各肽段相对分子质量数值上的差值就可以推断肽段的氨基酸序列。得到的质谱图谱数据可以通过手工计算分析,也可以使用质谱仪器上配制的软件自动分析。本实验中使用二级质谱预测肽段E3-4的氨基酸序列,其二级质谱图如图10所示。采用质谱分析软件 MassLynx 4.1对图谱数据进行解析,推测出E3-4的可能氨基酸组成为HPEY,即His-Pro-Glu-Tyr。在 NCBI数据库(http://www.ncbi.nlm.nih.gov/)和生物活性肽数据库(http://www.peptides.be/)中搜索,均未发现相同匹配,表明E3-4是一种新型的抗氧化肽。

图9 组分E3-4的MS图谱Fig.9 MS spectrum of Fraction E3-4

图10 组分E3-4的MS/MS图谱Fig.10 MS/MS spectrum of Fraction E3-4
2.7 鲢鱼鱼鳞胶原蛋白抗氧化肽作用机理的初步分析
蛋白肽的一级结构和分子量大小,直接决定了其抗氧化活性的强弱[10-11]。本章从鲢鱼鱼鳞胶原蛋白肽中分离出的目标抗氧化肽组成为四肽(His-Pro-Glu-Tyr),这进一步验证了2-10个短肽比其母蛋白和多肽具有更强的抗氧化性质[12]。早在20世纪70年代,就有研究发现含有芳香族氨基酸(Trp或Tyr)和含有Tyr、Pro或His的肽链具有较强的抗氧化活性[11,13]。从金枪鱼蒸煮液酶解物[14]、泥鳅蛋白酶解物[15]、蜂王浆蛋白酶解物[13]中也分离鉴定出多种结构中含有Tyr、Pro或 His的具有较强抗氧化活性的肽链。Chen等也发现采用Alcalase酶解马铃薯蛋白所得的抗氧化肽段中也多含有Tyr。而根据张苗的研究结果,Tyr在肽段中的具体位置对于活性肽潜在的抗氧化活性不是一个关键的影响因素[17]。但Saito等[18]认为在C末端含有Trp或Tyr的三肽具有较强的自由基清除活性,本章的研究结果也对这一论点进行了证实。
含有Tyr、Pro或His的肽链之所以具有较强的抗氧化活性,是因为芳香族氨基酸Tyr具有酚羟基结构,具有提供质子的作用,可以猝灭自由基[19];同时肽链(His-Pro-Glu-Tyr)中与Tyr邻近的Glu的羧酸根具有吸电子作用,可使Tyr 酚羟基上氧电子云密度减弱,从而更有利于质子的释放,增强了Tyr的质子供体效应;且由于Tyr苯环为共轭体系,也可使其去掉质子后形成的自由基中间体趋于更稳定[20]。 His对肽链的抗氧化活性同样具有重要的作用,它含有的咪唑环可以提供质子,起到螯合金属离子和清除自由基作用[20-24]。此外,本章所得肽链(His-Pro-Glu-Tyr)中酸性氨基酸Glu和碱性氨基酸His还能分别通过侧链的羰基和氨基螯合金属离子,从而起到抗氧化作用[11]。另有研究报道,疏水性氨基酸残基的存在能增强肽段的抗氧化能力[25]。本章分离纯化出的抗氧化肽段(His-Pro-Glu-Tyr)中疏水性氨基酸占75%,因而具有良好的抗氧化活性。另一方面,虽然单个的氨基酸(如Tyr、Met、His、Lys、Trp)也具有一定的抗氧化性,但其活性却远远低于由其所组成的抗氧化肽,这也是生物活性肽的一个显著特点,即整个肽的活性远大于其组成氨基酸的活性。因此,可以认为抗氧化肽的强抗氧化性在于肽链内部氨基酸间的相互作用,强化了酪氨酸和脯氨酸等作为质子供体的能力,增强了与体内自由基的相互作用[21,26-27]。
综合分析,本章所获得的新型抗氧化四肽(His-Pro-Glu-Tyr)的抗氧化活性是由Tyr提供质子的能力、His螯合金属离子能力、强疏水性能以及其自身结构的稳定性决定的。主要通过捕捉自由基反应过程中的过氧化自由基,从而阻止或减弱自由基链反应的进行。此外,当氢原子给予自由基后,其本身转化为自由基中间体,而此中间体越稳定越易形成,其前体就越易清除自由基,则抗氧化能力越强[21-22,28]。
3、结论
本文依次采用离子交换层析,凝胶层析和RP-HPLC对鲢鱼鱼鳞胶原蛋白酶解初肽进行分离纯化,得到组分单一的E3-4肽段,最后通过质谱技术对该肽段的氨基酸序列进行分析,并初步分析了其抗氧化作用机理。所得主要结论如下:
(1)采用DEAE-52阴离子交换树脂对SCSCP进行分离纯化,收集到A、B、C、D、E五个组分,其中组分E对自由基的清除活性最强(P<0.05),对DPPH·、O-·和·OH的清除率分别为83.83±0.58%、56.43±1.27%和65.47±0.75%。
(2)采用Sephadex G-15葡聚糖凝胶层析对组分E作进一步的分离纯化,收集到E1、E2和E3三个组分,其中组分E3的自由基清除活性最强(P<0.05),对DPPH·、O-·和·OH的清除率分别为90.70±0.70%、75.72±2.25%和80.63±1.31%。
(3)E3组分经RP-HPLC分离纯化后,收集到9个组分,其中组分E3-4对自由基的清除活性最强(P<0.05),对DPPH·、O-·和·OH的清除率分别为91.80±1.08%、79.23±4.10%和82.17±2.35%;组分E3-4经分析型RP-HPLC鉴定为纯度较高的单一组分。
(4)氨基酸分析表明,组分E3-4由Glu、His、Pro和Tyr组成,4种氨基酸的摩尔比为n(Glu):n(His):n(Pro):n(Tyr)=1:1:1:1。
(5)组分E3-4经MALDI-TOF/TOF MS 和 TOF-MS/MS分析,其相对分子量为576.9,氨基酸序列为HPEY(His-Pro-Glu-Tyr),经检索,为一种新型抗氧化肽。
(6)经分析,本章所获得的新型抗氧化四肽HPEY(His-Pro-Glu-Tyr)的抗氧化活性是由Tyr提供质子的能力、His螯合金属离子能力、强疏水性能以及其自身结构的稳定性决定的。

[1]Marcuse, R. Antioxidative effect of amino-acids [J].Nature,1960, 186(11):886-887.
[2]Megías C, Pedroche J, Yust M M, et al. Production of copper-chelating peptides after hydrolysis of sunflower proteins with pepsin and pancreatin [J]. LWT-Food Science and Technology, 2008,41(10):1973-1977.
[3]Xie Z, Huang J, Xu X, et al. Antioxidant activity of peptides isolated from alfalfa leaf protein hydrolysate [J]. Food Chemistry, 2008,111(2):370-376.
[4]Wu H C, Chen H M, Shiau C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J]. Food research international, 2003,36(9):949-957.
[5]Kim S K, Byun H G, Ito H. Articles:Purification and Characterization of Antioxidative Peptides from Bovine Skin [J].Biochemistry and Molecurar Biology Reports, 2001, 34(3):219-224.
[6]Je J Y, Qian Z J, Byun H G, et al. Purification and characterization of an antioxidant peptide obtained from tuna backbone protein by enzymatic hydrolysis [J]. Process Biochemistry, 2007,42(5):840-846.
[7]Kim S K, Kim Y T, Byun H G, et al. Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska pollack skin [J]. Journal of Agricultural and Food Chemistry,2001, 49(4):1984-1989.
[8]Yang J I, Ho H Y, Chu Y J, et al. Characteristic and antioxidant activity of retorted gelatin hydrolysates from cobia (Rachycentron canadum) skin [J]. Food Chemistry, 2008, 110(1):128-136.
[9]Giménez B, Alemán A, Montero P, et al. Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid [J]. Food Chemistry, 2009, 114(3):976-983.
[10]Jeon Y J, Byun H G, Kim S K. Improvement of functional properties of cod frame protein hydrolysates using ultrafiltration membranes [J]. Process Biochemistry, 1999, 35(5):471-478.
[11]Suetsuna K, Ukeu H, Ochi H. Isolation and characterization of free radical scavenging activities peptides derived from casein [J]. The Journal of nutritional biochemistry, 2000, 11(3):128-131.
[12]Ma Y, Xiong Y L, Zhai J, et al. Fractionation and evaluation of radical scavenging peptides from in vitro digests of buckwheat protein[J].Food chemistry, 2010, 118(3):582-588.
[13]Guo H, Kouzuma Y, Yonekura M. Structures and properties of antioxidative peptides derived from royal jelly protein [J]. Food Chemistry, 2009, 113(1):238-245.
[14]Hsu K C, Lu G H, Jao C L. Antioxidative properties of peptides prepared from tuna cooking juice hydrolysates with orientase(Bacillus subtilis) [J]. Food Research International, 2009, 42(5):647-652.
[15]You L, Zhao M, Regenstein J M, et al. Purification and identification of antioxidative peptides from loach (Misgurnus anguillicauutus) protein hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry [J]. Food Research International, 2010, 43(4):1167-1173.
[16]Cheng Y, Chen J, Xiong Y L. Chromatographic separation and tandem MS identification of active peptides in potato protein hydrolysate that inhibit autoxidation of soybean oil-in-water emulsions[J]. Journal of agricultural and food chemistry, 2010, 58(15):8825-8832.
[17]张苗.甘薯蛋白酶解肽的抗氧化及结肠癌活性研究[D].北京:中国农业科学院, 2012.
[18]Saito K, Jin D H, Ogawa T, et al. Antioxidative properties of tripeptide libraries prepared by the combinatorial chemistry [J]. Journal of Agricultural and Food Chemistry, 2003, 51(12):3668-3674.
[19]Zhang H Y. Structure-activity relationships and rational design strategies for adical-scavenging antioxidants [J]. Current Computer-Aided Drug Design, 2005, 1(3):257-273.
[20]Dávalos A, Miguel M, Bartolome B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9):1939-1944.
[21]Chen H M, Muramoto K, Yamauchi F, et al. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybean protein [J]. Journal of Agricultural and Food Chemistry, 1996, 44(9):2619-2623.
[22]Chen H M, Muramoto K, Yamauchi F, et al. Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digests of a soybean protein [J]. Journal of Agricultural and Food Chemistry, 1998, 46(1):49-53.
[23]Park P J, Jung W K, Nam K S, et al. Purification and characterization of antioxidative peptides from protein hydrolysate of lecithin-free egg yolk [J]. Journal of the American Oil Chemists'Society, 2001, 78(6):651-656.
[24]Pena-Ramos E A, Xiong Y L, Arteaga G E. Fractionation and characterisation for antioxidant activity of hydrolysed whey protein[J]. Journal of the Science of Food and Agriculture, 2004, 84(14):1908-1918.
[25]孙月梅. 大豆抗氧化肽酶法制备及其活性保护技术研究[D]. 哈尔滨:东北农业大学, 2008.
[26]Hernández-Ledesma B, Dávalos A, Bartolomé B, et al.Preparation of antioxidant enzymatic hydrolysates from α-lactalbumin and β-lactoglobulin. Identification of active peptides by HPLC-MS/MS [J]. Journal of Agricultural and Food Chemistry, 2005, 53(3):588-593.
[27]Saiga A I, Tanabe S, Nishimura T. Antioxidant activity of peptides obtained from porcine myofibrillar proteins by protease treatment [J]. Journal of Agricultural and Food Chemistry, 2003,51(12):3661-3667.
[28]Rajapakse N, Mendis E, Jung W K, et al. Purification of a radical scavenging peptide from fermented mussel sauce and its antioxidant properties [J]. Food Research International, 2005,38(2):175-182.
Structure Identification of Silver Carp Fish Scale Collagen Antioxidant Peptide
CHEN Ri-chun1,ZHENG Bao-dong2
(1 Fujian Saifu Food Inspection Institute Co.,Ltd;2 College of Food Science, Fujian Agriculture and Forestry University)
In order to identify silver carp fish scale structure of collagen antioxidant peptides, it continuously used the DEAE-52 anion exchange chromatography, Sephadex G-15 glucan gel chromatography and RP-HPLC for relative molecular weight of less than 1 ku antioxidant peptide (SCSCP) for separation and purification, and then by sds-page, mass spectrometry, Fourier infrared spectrum method such as antioxidant peptide identification. The result of the method separation and purification is that getting high purity antioxidant peptide. Its relative molecular weight is 576.9 and consists of Glu, His, Pro and Tyr, four kinds of amino acids of the molar ratio of n (Glu):n (His):n (Pro):n (Tyr) =1:1:1:1;Amino acid sequence of HPEY (His-Pro-Glu-Tyr). This is a new type of antioxidant peptides by retrieval.
Silver carp; Collagen protein; Antioxidant peptides; Structure identification

