发现控制昼夜节律的分子机制的科学背景
卡洛斯·伊巴涅斯
2017年度诺贝尔生理学或医学奖授予了杰弗里·霍尔、迈克尔·罗斯巴什和迈克尔·杨,以奖励他们发现的控制昼夜节律的分子机制。昼夜节律由内部生物钟驱动,这个微生物钟能预期昼夜循环以优化生物体的生理和行为。
生物体能够在生理和行为上适应昼夜节律的时间,这一发现已经很久了,但内生昼夜节律钟的存在一直到20世纪之后才最终确定下来。1971年,西摩·本泽尔和罗纳德·科诺普卡辨认出果蝇突变体表现出24小时正常周期的蛹孵化和自主活动的变化。实验表明,突变涉及相同的基因,后来被命名为周期(per)。
10年之后,在布兰迪斯大学展开合作的霍尔和罗斯巴什以及洛克菲勒大学的杨分离出该周期基因并对其进行了分子表征,但其结构和序列并没有立即表明昼夜节律钟的分子机制。霍尔、罗斯巴什和杨的一系列突破,最终得出了转录翻译反馈回路(TTFL)的概念。在这种机制中,per 及其伴侣基因永恒(tim)的转录被其自身的基因产物——周期(PER)和永恒(TIM)——蛋白质压制,产生自主振荡。当时的转录机制并不明显,自发维持的昼夜TTFL的发现是一个新的范式。
之后,三位科学家进一步的研究揭示了一系列互锁的TTFL,以及复杂的反应网络。这些研究成果涉及蛋白磷酸化的调节和TTFL 组分降解、蛋白复合物装配、核易位以及其他翻译后修饰,会产生约24小时一个周期的振荡。单个细胞中的昼夜节律振荡器对携带信号的反应不同,并控制各种生理输出,例如睡眠模式、体温、激素释放、血压和代谢。霍尔、罗斯巴什和杨的创新发现揭示了解释昼夜节律适应的重要生理机制,对人类健康和疾病的研究具有重要意义。
是什么让我们产生时间概念?
地球上生命的一个重要特征就是适应环境的能力。不同的地理位置具有不同的环境,生物体会逐渐适应不同的环境条件以增强其生存力。然而,在任何一个位置,由于地球在其轴上的旋转,每天都会发生光和温度的重大变化。为了适应这种变化,大多数生物体已经发展出一种内部的生物钟,可以预测昼夜的周期,并帮助它们优化其生理和行为。这种内在的日常节奏被称为“昼夜节律”。昼夜节律在生命的整个进化过程中是一直存在的。我们知道,无论是单细胞的蓝藻细
菌和原生动物生命形式,还是所有多细胞生物体,包括真菌、植物、昆虫、啮齿动物和人类,这些生命形式中都存在昼夜节律。昼夜节律系统的构建块由自维持24小时节律发生器或振荡器组成,确定内部振荡器与外部刺激(被称为授时因子,即计时器)的连接或夹带一定机制(如光线)使其连接,并输出允许及时调度生理过程的机制。
从节奏到时钟
有关生物调整其生理和行为,以适应昼夜节律的时间这方面的观察记录已经有很长的历史了,而且最早观察的是植物中的叶和花的运动。例如,含羞草的叶子晚上合拢白天展开。1729年, 法国天文学家让·雅克·多尔都·德·麦朗将含羞草置于黑暗中,观察到叶片在一天的适当时间有节奏地展开、合拢,表明其昼夜节律的内源性来源。大约200年后,德国植物生理学家和昼夜节律研究先驱欧文·邦宁将一种豆类植物的叶子精心连接到一台波动曲线记录仪上,分别记录了
正常昼夜周期和恒定的光照条件下叶子的运动。他观察到叶子的运动节律持续存在。在这之前,有关植物和动物的昼夜节律行为是由内生时钟控制还是仅仅是对昼夜节律外部刺激的反应的问题,在科学界一直都有激烈的争论。最终,内生昼夜节律钟的存在终于在20世纪后建立起来。
昼夜节律和时钟基因的遗传性
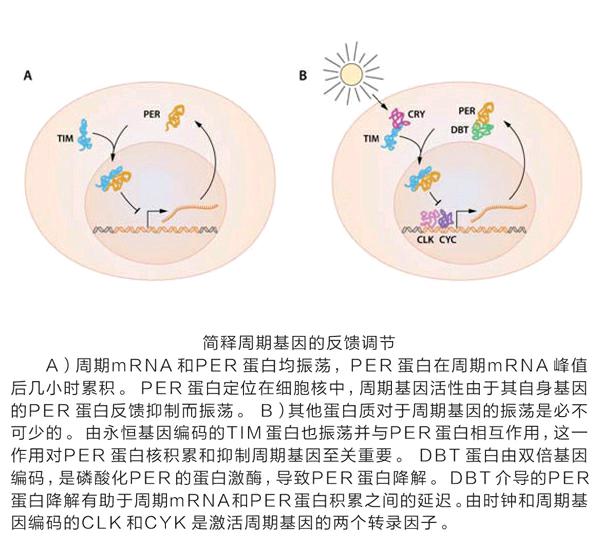
随着时间的推移,除了周期性叶片运动之外,许多相关的生理特性都被发现受生物钟控制,昼夜节律的遗传开始被认为是自然选择的产物。20世纪30年代,欧文·邦宁的经典研究表明,尽管亲本植物暴露于非昼夜节律光照期,但是植物的昼夜节律仍然可以遗传,并且在不同时期的杂种之间杂交,从而产生具有中等周期的植物。到20世纪60年代中期,研究生物钟的生物学研究团体已经得到稳定确立,并且开始考虑时钟基因的概念。
正是在这个时候,在加州理工学院工作的西摩·本泽尔和他的学生罗纳德·科诺普卡开始研究改变了昼夜节律表型的突变果蝇。本泽尔与当时的几位遗传学家和行为科学家不同,他坚信具体行为可能受到单一基因作用的影响,并且有可能通过分离携带突变个体基因的生物进行证明。本泽尔和科诺普卡使用经典的化学诱变策略,分离出三种不同的突变体株,显示蛹羽化及自主活动正常24小时循环的变化。其中一个突变体无规则,另一个突变体具有较短的19小时周期,第三个时间更长,为28小时。映射实验使用当时已知的遗传标记,将所有三个突变体大致定位于果蝇X染色体的相同区域。重要的是,互补性测试表明,这三个突变涉及相同的基因,后来被命名为周期。在此基础上,本泽尔和科诺普卡推断,不规则的突变体将携带无效突变,使基因失活,并且具有较长和较短周期的突变体将携带错义突变,莫名其妙地以相反的方式改变基因产物的功能。后来的研究显示,这两个推断都是正确的。然而,尽管本泽尔继续致力这一课题,科诺普卡继
续研究该周期位点,更精确地绘制其染色体位置,但直到20世纪80年代中期,在布兰迪斯大学合作的杰弗里·霍尔和迈克尔·罗斯巴什以及洛克菲勒大学的迈克尔·杨才将该周期基因进行了分子克隆并测序。至此,第一个生物钟基因被分离,其结构被分子表征,但时间的原始遗传识别和其cDNA的克隆和测序都没有指出昼夜节律钟的分子机制。
转录翻译反馈回路
在per被克隆后的几年里,杰弗里·霍尔和迈克尔·罗斯巴什开始研究其蛋白质产物(PER)如何发挥昼夜节律的作用,提出了一个“膜梯度”模型,其中PER被设想为像泵一样在膜上形成梯度,达到阈值后,通过光敏通道消散。另一个模型提出PER蛋白是将细胞聚集在一起的蛋白多糖,從而促进通过间隙连接形成细胞间连接。有了可靠的PER抗体,这一方面的研究终于实现了一系列突破。首先,霍尔和罗斯巴什的实验室发现果蝇大脑神经元中丰富的PER 蛋白呈现24小时循环,夜间出现峰值。由per基因编码的mRNA显示出果蝇脑中丰度的昼夜循环,表明PER蛋白的循环由周期mRNA的循环产生,周期mRNA水平的峰值在PER蛋白丰度峰值前几小时发生。重要的是,一个无意义的突变体不能产生周期mRNA的振荡水平,但野生型PER蛋白可以挽救环状mRNA的表达。基于这些观察,霍尔和罗斯巴什提出负自动调节反馈模型的观点,认为PER 蛋白的积累导致周期mRNA表达的减弱。因此,PER蛋白被发现是核蛋白,并以时间调节的方式在细胞核和细胞质之间穿梭,为PER蛋白是某种转录调节因子的观点提供了支持。
与此同时,杨通过一个新的前瞻性研究,发现了永恒(tim)这个影响昼夜节律钟的另一基因。杨的实验室发现,永恒mRNA的水平也在24小时内循环,TIM可以直接结合PER,通过阻断PER降解来影响其核定位和丰度。重要的是,per表达的循环在tim的突变体蝇中被消除,相反,永久性表达的昼夜循环在周期突变体蝇中丧失。这些进展巩固了TTFL的基本概念框架,成为促进时钟基因自动调节中昼夜循环的机制。
如上所述,当时的转录机制并不明显,科学界正在考虑不同的替代方案。因此,发现自我维持的昼夜TTFL代表了一种新的范式。
PER和TIM的转录的激活机制仍然未知。这个问题是通过发现时钟(Clk)和per基因来解决的。Clk基因是约瑟夫·高桥首先在小鼠身上鉴定到的。基因产物、时钟(CLK)和循环(CYCLE)相互作用,含有基本的螺旋—环—螺旋(bHLH)基序,并结合PER 中的特定元素和TIM,从而积极调节其转录。后来的研究显示,TIM和PER可作为CLK活性的负调节因子。由此,昼夜反馈循环被关闭。
昼夜分子时钟装置的工作模式非常复杂,包括许多附加的组成部分,它们共同促进其昼夜周期。重要的是,由于转录和翻译反应通常是快速的,所以必须对核心TTFL机制施加显著的延迟以产生24小时振荡。这是通过涉及调节蛋白磷酸化和TTFL组分降解,蛋白质复合组装,核易位和其他翻译后修饰的复杂网络实现的。一项重要的观察表明,这种延迟的基本机制来自杨发现的双倍基因(DBT)。额外的蛋白质整合了可以夹带时钟的环境输入,例如隐花色素基因(cry)的蛋白质产物,并促进其与TIM的结合,导致其在蛋白酶体中的降解。当早晨到达时,TIM被降解,使得PER更容易受到DBT的磷酸化和随后的降解。
其他生物体的昼夜节律钟
TTFL机制也是包括人在内的其他多细胞生物体昼夜节律钟的基本原理。果蝇中核心时钟蛋白的几个同源物,包括CLK和PER,在哺乳动物昼夜节律计时中起着相似的作用。虽然植物主要使用与果蝇昼夜节律钟不同的转录因子,但TTFL是统一的主要原则。然而,在蓝细菌中,已经发现依赖于顺序蛋白磷酸化事件的不同类型的转录非依赖性昼夜节律振荡子。值得注意的是,使用纯化的蓝细菌CLK蛋白和ATP可以在体外重建昼夜节律。由过氧化物氧化蛋白的高氧化反应引起的与
转录无关的振荡也在真核生物中得到描述,包括人类红细胞。这种TTFL独立振荡的生理相关性是未知的。然而,这些结果表明,在哺乳动物细胞中也可能存在用于产生昼夜节律振荡的其他机制。
生物钟的夹带和同步
昼夜节律程序在中央和外围水平都受到管制。在哺乳动物中,中心起搏点位于下丘脑的视交叉上核(SCN),并且是昼夜主节律钟。视网膜接收光输入并将该信息中继到SCN,并同步其自身的神经元细胞时钟。中央时钟通过体液因子和外周自主神经系统调节整个体内的昼夜节律。当然,昼夜节律基因表达的能力在整个生物体内是普遍的,并且大多数外周器官和组织都可以分离地表达昼夜节律振荡。因此,动物的昼夜节律系统类似时钟店而非单个时钟。这就提出了如何有效地同步这么多时钟的问题。
外部时钟可以通过SCN和环境线索同步,包括取食、身体活动和温度。不同组织的外部时钟控制相关生理输出,如葡萄糖生产、脂肪储存和激素释放;这些反过来又作为整个身体组织中时钟的保持线索,最终反馈给SCN。因此,生物体的昼夜节律系统是互连振荡器和反馈回路网络。中央和周边时钟之间的关系,以及本地和外部线索影响它们的多种方式,是通向新发现的一个活跃的研究领域。
昼夜节律生物学与人类健康
时间生物学对我们生理学的许多方面都产生着影响。例如,昼夜节律钟有助于调节睡眠模式、取食行为、激素释放、血压和体温,分子钟也在许多组织中起局部关键作用。在动物模型中,消除Clk 基因可导致激素的心律失常产生,如皮质酮和胰岛素。Clk基因也通过控制糖异生、胰岛素敏感性和血糖全身振荡对代谢产生深远的影响。睡眠对正常的脑功能至关重要,昼夜节律障碍与睡眠障碍以及抑郁、双相情感障碍、认知功能、记忆形成和一些神经系统疾病有关。在罕见的情况下,睡眠障碍是由于昼夜节律基因的突变导致的。研究表明,我们的生活方式与我们内生的昼夜节律规定的节奏之间的慢性不对准可能与各种疾病(包括癌癥、神经变性疾病、代谢紊乱和炎症)的风险增加有关。目前,科学界正在努力研究计时生物学和药理学方法来修改昼夜时钟的周期、相位或幅度,以改善人体健康。
综上所述,自我维持的转录/ 翻译反馈回路的发现是昼夜节律基因控制细胞和组织中昼夜节律振荡的分子机制的核心组成部分。这一发现提供了一种新范式,使我们能够理解生物体如何预期和适应日常环境的提示,例如光。这三位获奖者的重要发现阐明了基本的生理机制,使得昼夜节律生物学已经发展成一个广泛而高度动态的研究领域,对我们的健康和幸福有着重要的影响。

