衰老和运动诱导细胞外基质变化对骨骼肌重塑的研究进展
金 晶,冯祎中,杨 洲,冯 燕,陈彩珍,卢 健
(1.华东师范大学 体育与健康学院,上海 200241;2.浙江农林大学 体育军训部,浙江 临安 311300)
·运动人体科学·
衰老和运动诱导细胞外基质变化对骨骼肌重塑的研究进展
金 晶1、2,冯祎中2,杨 洲1,冯 燕1,陈彩珍1,卢 健1
(1.华东师范大学 体育与健康学院,上海 200241;2.浙江农林大学 体育军训部,浙江 临安 311300)
我国“人口老龄化”问题日渐突出,衰老导致骨骼肌衰减综合征的发生严重影响老年人自理生活能力。骨骼肌卫星细胞是骨骼肌干细胞,对肌肉修复和骨骼肌重塑过程起到重要作用。骨骼肌细胞外基质为卫星细胞提供结构支撑和信号传递,衰老诱导的细胞外基质的恶性变化直接影响卫星细胞的激活、增殖、分化等骨骼肌重塑功能的正常发挥。通过文献综述的形式,总结细胞外基质概况、细胞外基质对骨骼肌重塑调控、衰老对细胞外基质的影响、运动对衰老诱导的恶性方向逆转等方面,为延缓骨骼肌衰减寻找新的治疗靶点,以期实现“健康老年化”战略。
衰老;抗阻训练;细胞外基质;卫星细胞;骨骼肌衰减综合征;骨骼肌重塑
0 前 言
至2050年,我国将面临较长时期的经济、社会难题——“人口老龄化”问题。衰老导致骨骼肌质量持续减少和骨骼肌重塑能力的下降,即骨骼肌衰减综合征(Sarcopenia)的出现严重影响老年人自理生活能力,因而实现“健康老年化”战略的重要突破口是如何有效延缓骨骼肌衰减的发生发展[1]。
骨骼肌卫星细胞(Muscle Satellite Cell,MuSCs)是一种具有自我更新能力和特异性分化能力的专能干细胞,亦称之为骨骼肌干细胞(Muscle Stem Cell),对于骨骼肌损伤(Injury/damage)后的修复和骨骼肌重塑,预防骨骼肌衰减症等生理和病理过程有重要应用价值[2,3]。卫星细胞包裹在微环境niche中,其成分的变化直接影响卫星细胞的激活、增殖、分化和融合等功能,所以骨骼肌重塑与niche息息相关[4,5]。尽管衰老小鼠骨骼肌卫星细胞会产生钝化激活的作用,但将衰老鼠的卫星细胞移植进入年轻鼠的niche中,无论是离体实验还是活体实验均发现外界环境对细胞状态有重要影响,引起衰老与对照组小鼠卫星细胞激活所发生的骨骼肌重塑能力的不同,是由于衰老导致细胞外基质发生改变而造成的[6]。
衰老促进骨骼肌细胞外基质的结构、生化、组织成分和功能等发生不利变化[7]。衰老是如何引起细胞外基质恶化的具体机制还不清楚。本文拟通过衰老所造成细胞外基质的变化、卫星细胞的改变和运动干预改善衰老细胞外基质的现状等方面进行综述,以期为延缓骨骼肌发生发展提供新的靶点和方向。
1 细胞外基质(ECM)概况
细胞外基质(Extracellular matrix,ECM)是由动物细胞合成并分泌到胞外的由细胞表面和细胞之间的多糖、蛋白质或蛋白聚糖等物质所构成。这些物质不属于任何细胞,但可为细胞生存提供重要的结构支架和组织连接,并通过信号传导系统影响细胞的形态、增殖、分化、迁移、代谢等功能[8]。骨骼肌ECM根据物理位置可以分为三个相互作用的薄层:肌外膜、肌束膜和肌内膜,它们主要是由胶原蛋白结构构成的,通过分子间的相互作用,聚集大量的其他结缔组织蛋白如弹性纤维、蛋白聚糖和其他细胞[7]。
根据结构与功能的不同,ECM分为两大类:细胞间隙的疏松结缔组织和基底膜的薄片状组织。前者形成疏松的网状结构,作用是连接间充质细胞或成纤维细胞,由形成纤维的胶原蛋白(Collagens)如I、II、III、V、XI型胶原蛋白和非胶原蛋白的糖蛋白如细胞粘合素(Tenascin)、纤维连接蛋白(Fibronectin)、玻璃体结合蛋白(Vitronectin)、等蛋白多糖(Proteoglycans)组成,各种组分协同使基质具有一定的弹性和抗拉强度,同时还调节其他基质分子、生长因子和细胞因子的相互作用。后者基底膜是一层连接紧密的糖蛋白网络,其成分主要是IV型胶原蛋白形成的支架结构,通过乙酰肝素蛋白多糖(Heparan sulfate proteoglycan)、基底膜聚糖(Perlecan)、巢蛋白(Nidogens)等与层粘连蛋白(Laminins)相互连接,将组织细胞隔开[9]。
肌卫星细胞是未分化、单能性肌肉干细胞依附于基底膜与肌纤维膜之间的空隙中。ECM表面肌纤维由胶原蛋白、层粘连蛋白、纤连蛋白和葡糖氨基葡聚糖(Glycosaminoglycans,GAGs),短的多糖链结合于蛋白中心形成蛋白聚糖组成。基质的基膜(Basement membrane,BM)有两层结构分为:基底膜(Basalt lamina,BL)和网状膜(Reticular lamina),各成分之间的具体交联关系如图1所示[4]。

图1 卫星细胞niche的示意图[31]
2 骨骼肌重塑过程及其骨骼肌ECM调控
骨骼肌重塑是一个复杂的过程,包括肌纤维、肌卫星细胞和各种其他邻近细胞的参与,可以分为静息、激活、增殖、自我更新、分化和融合等阶段构成。骨骼肌卫星细胞内部与外部通过niche(微环境)实现各种信号分子进行交流[3,10]。
2.1卫星细胞的开关调节:静息与激活
通常情况下,卫星细胞是沉默的,机体受到外界的刺激(包括低氧条件、氧化应激、炎症反应、肌肉损伤、运动训练及衰老等)后,引起肌卫星细胞重编程进而激活肌卫星细胞导致其增殖、分化和自我更新的发生[11]。成熟骨骼肌中,卫星细胞处于一个长期休眠的状态,称为静息状态或者可逆的G0期,正常生理状态下卫星细胞始终保持静息的状态,维护细胞池数量,静息状态以表达Pax7+和Myf5为特征[12]。静息状态是一个预备状态,可以为细胞激活作充分的准备,静息状态与激活状态是是可逆的,但当进入分化阶段,则不可逆。当骨骼肌损伤时肌卫星细胞进入增殖状态[2,3]。激活的肌卫星细胞不仅仍然表达Pax7+和Myf5,而且还表达MyoD[12],最重要的是代谢方式从氧化磷酸化向无氧糖酵解转变。
2.2肌卫星细胞的命运选择:自我更新与分化、肌纤维融合
肌卫星细胞作为骨骼肌的干细胞,具有自我更新和特异性分化的能力。干细胞的极性与纺锤丝方向都关系到子细胞的命运:对称分裂与不对称分裂[13]。当肌卫星细胞进行横向的对称分裂产生两个相同的子细胞,填补干细胞池为之后进入细胞周期作准备;相反的,当细胞进行纵向的分裂即不对称分裂,一个子细胞与肌膜接触返回细胞池,另一个子细胞靠近基底膜进行分化和肌纤维融合[13]。近期研究[4]认为所处的niche中细胞外基质对卫星细胞分裂方式起到决定性作用。顶端的子细胞表达m-cadherin(粘蛋白)受体,它允许细胞与肌纤维相互作用,进而促进细胞的定向分化和细胞融合,而底部的子细胞表达层粘连蛋白受体整合素α7β1,回补细胞池。
2.3邻近细胞与骨骼肌重塑
大量研究证明邻近细胞(损伤相关/恢复性的巨噬细胞、纤维生脂祖细胞、内皮细胞及周边内皮细胞等)对肌卫星细胞参与骨骼肌重塑过程有促进作用[3]。
利用心脏毒素诱导小鼠胫骨前肌重塑的实验中可以观察到。损伤后的第1天,肌纤维受到一定程度的破坏,与损伤相关的巨噬细胞进入到受伤区域。第2天,大量的免疫细胞产生特别是与损伤相关的巨噬细胞,吞并坏死的残留物和受损的肌纤维,与此同时肌卫星细胞和纤维生脂祖细胞被激活和增殖。第4天后,卫星细胞进行分化和融合形成新的肌纤维,大量的巨噬细胞可以在重塑的肌纤维周边观察到,这些与吞噬作用相关的巨噬细胞转变为恢复性巨噬细胞。损伤7天后,脂肪生脂祖细胞和巨噬细胞数量开始下降,重塑形成肌纤维。实验1个月后,骨骼肌恢复到正常的表型而肌细胞核处于肌纤维的正中,成熟的肌核是在肌纤维的周边,两个月后骨骼肌功能回复至损伤前状态[3]。
损伤相关的巨噬细胞和纤维生脂祖细胞参与卫星细胞的激活状态[5],恢复性巨噬细胞和内皮细胞参与卫星细胞的分化阶段[14],恢复性巨噬细胞参与肌纤维融合阶段[15],各种细胞均参与骨骼肌重塑过程。
2.4细胞外基质对重塑的调控
ECM的主要作用是为肌卫星细胞提供一个结构完整的niche环境,物理的将肌卫星细胞与其他组织细胞和间隙基质分开[4]。改变ECM亦改变了卫星细胞的niche,进而影响了卫星细胞的静息、激活、分化、融合和自我更新[16]。
干细胞的niche在维持细胞静息状态和激活状态的平衡上有重要作用,一方面,当卫星细胞增殖受到抑制重塑过程严重受阻,另一方面,肌卫星细胞增值过度,导致niche中细胞泛滥甚至导致瘤变扩增。为了更好地在可控环境下研究细胞基质的作用,自行设计特殊成分或已知成分的培养基来做实验进行验证,结果发现添加天然胶原蛋白VI的人工基底膜上卫星细胞表达Pax7显著高于对照组,所以ECM直接调控着卫星细胞的状态[17,18]。
在各种人工基底膜作为底物的培养下,卫星细胞分化过程陆续开启转录因子表达,有Myf-5、MyoD、desmin(结蛋白)和肌细胞生成素,随后与成肌细胞融合或融入相邻的肌管中[19]。为了更好地寻找类似于活体ECM成分的理想SC培养体外模型,鼠类SC培养在ECL底物,胶原蛋白IV,多聚赖氨酸(poly-D-lysine)和层粘连蛋白中,结果发现在多聚赖氨酸或层粘连蛋白底物上发现有很高的肌管融入率[20]。
3 衰老对卫星细胞的激活:是钝化还是耗尽?
动物实验证实卫星细胞的数量及其重塑能力有增龄性衰弱现象发生[8, 21, 22]。
相关文献对衰老卫星细胞功能和数量的下降没有达成共识有以下两种不同的猜想:①认为衰老的肌卫星细胞发生钝化激活作用[22]。针对老年人和青年人经过同等强度急性抗阻运动训练,结果发现老年组卫星细胞的数量没有有效的提高[23]。将实验动物的卫星细胞分为青年组、老年组、更老组,通过移植各组卫星细胞生长在年轻的niche环境中观察生长情况,研究结果显示老年组卫星细胞进行激活参与骨骼肌重塑,而更老组的卫星细胞无法进行激活态的转变[22]。以上实验显示卫星细胞存在衰老发生,导致卫星细胞激活现象的受阻,进而产生钝化激活的作用。
②认为卫星细胞存在耗尽理论,增龄性的变化会诱发静息状态卫星细胞的耗尽,促使卫星细胞向增殖、分化方向转化[4, 24]。衰老小鼠与正常对照组(24月龄vs4月龄)肌纤维中卫星细胞的含量进行比较衰老组显著低于对照组。对照组卫星细胞的静息状态始终保持在95%左右,而衰老组为77%左右,同时还发现衰老卫星细胞进行分化状态相比显著高于对照组[24],与卫星细胞池大量耗尽相一致[4]。有趣的是,损伤后衰老小鼠和对照鼠骨骼肌重塑的对比实验发现,衰老组与对照组的静息状态占15%±2% vs 8%±1%、增殖状态比例为29%±2% vs 59%±2%、分化的比例为55%±3% vs 33%±2%。在受到外界刺激的情况下,两组卫星细胞均发生大量的激活,对照组进行大量的增殖反补细胞池,而衰老组卫星细胞增殖比例较低,反而扩大分化、融合的比例。衰老导致肌肉力量的下降更容易损伤,由于衰老所诱导卫星细胞大量的分化,耗尽细胞池中的原材料,最终形成无法进行骨骼肌修复和重塑的恶性循环。
总体而言,衰老对卫星细胞的影响不仅仅发生在数量上的降低,还对其功能的发挥有强相关性。
4 衰老导致骨骼肌ECM的改变
卫星细胞所处的微环境niche不单单是一个解剖学位置,而且还有物理传递和化学信号传播的重要作用,衰老所造成ECM的增龄性变化会负调控卫星细胞的正常功能。将衰老小鼠卫星细胞移植进入年轻鼠的niche环境中,无论是离体实验还是活体实验都发现外界环境是影响卫星细胞功能的主要条件[6, 22]。另有实验选取衰老鼠和对照鼠的骨骼肌纤维放入培养基进行培养,在外界环境相同的情况下,没有在两种肌纤维间观察到任何增值潜能的差异。下一步还测定了骨骼肌融合成肌纤维融合指数和分化蛋白等指标,都没有差异性[22]。实证性的实验证明了卫星细胞的功能发挥主要是受限于细胞外基质的影响,在骨骼肌中ECM的结构、生化指标、细胞组成和功能都随着年龄的增加而发生恶性改变[7]。
骨骼肌ECM并非是一成不变的,各组成要素之间相互交叉形成信号传递和交流的动态平衡网络,包括ECM的沉积、重构和降解[7]。骨骼肌ECM的沉积物决定其刚性,驾驭卫星细胞的命运[25]。利用(Young’s modulus)测定成年鼠和衰老鼠,研究显示衰老骨骼肌有3倍的刚性增加,衰老鼠的ECM中总体胶原蛋白和晚期糖基化终产物明显升高[26]。有研究通过原子显微镜测定对照组和衰老组卫星细胞的刚性分别为(0.4±0.1 vs1.9±0.3 kPa)现取的卫星细胞成年鼠与衰老鼠比较为(2.3±0.4 vs 10.4±1.6 kPa),损伤的细胞模型为(2.0±0.2 vs 16.2±1.2 kPa)[24]。衰老引起的骨骼肌细胞外基质结构改变将增加骨架的刚性和减弱力学传导。
除了ECM的刚性增加意外,检测出衰老骨骼肌的基底膜有明显的增厚片层结构,变得不规则和不定型[27]。衰老小鼠实验显示基底膜中胶原蛋白IV型和集聚蛋白显著增加,其他哺乳动物实验也进行分析发现ECM上胶原蛋白总体上升,而且胶原蛋白I/III型的比率升高[8]。在衰老的条件下,肌生成的TGF-β的通路和Wnt通路受到负向调控,抑制骨骼肌重塑的进行[28]。近期两篇Nature Medicine文章显示衰老的卫星细胞中,细胞表面受体β1-整合素和ECM蛋白纤连蛋白失调,抑制卫星细胞的再生能力[8]。衰老导致基质金属蛋白(Matrix Metalloproteinases,MMPs)的活性显著下降,对蛋白质降解的能力大大减弱[29]。综上所述,衰老对细胞外基质造成胶原蛋白、纤连蛋白等网状结构增多增厚,下调MMPs的表达阻碍其他信号高效传递和卫星细胞的迁徙[29],导致ECM的刚性升高,使得卫星细胞孤立在网状结构中抑制卫星细胞参与骨骼肌重塑过程(图2)。
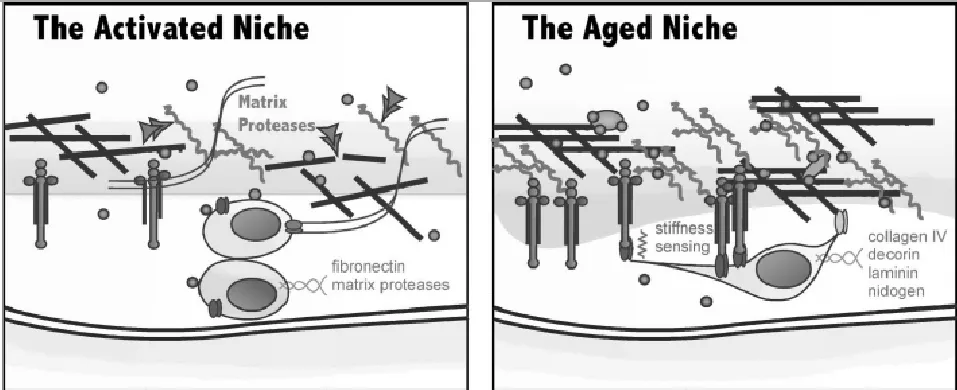
图2 激活态卫星细胞与衰老卫星细胞细胞外基质的比较[31]
5 运动改善衰老对ECM的改变
抗阻训练一直被认为是刺激骨骼肌蛋白质合成,促进卫星细胞池的扩增、增殖和分化最终导致肌纤维肥大的经典方法[30]。机械负荷和运动训练对骨骼肌提供强刺激引起ECM的合成和退变[21]。
抗阻运动后基底膜上胶原蛋白I型、IV型显著下调,而去粘附着蛋白上调,细胞刚性的下降整体向改善衰老引起的ECM进行正向转变[31]。Ogasawara[32]等证实抗阻训练能提升MMP-9,促进Akt/mTOR信号通路和骨骼肌肥大的上调,Deus[33]等发现pro-MMP-2和MMP-2活性经过8周的抗阻训练后显著提升。基底膜中的MMP-2和MMP-9,分别依赖锌和钙蛋白水解酶,目标是胶原蛋白IV和层黏连蛋白,抗阻训练后MMPs的上调正好加速降解衰老所引起的胶原蛋白[21]。抗阻训练和力量练习大大减弱了衰老所引起的ECM的变化,因而可以有效地阻止衰老促使骨骼肌细胞外基质的改变。
6 总结与展望
人口老龄化伴随着肌肉衰减症的发生发展,引起生活自理能力下降,造成严重的经济、社会问题,是我国将要面临的巨大挑战。因此,近年来骨骼肌卫星细胞的研究也逐渐成为体育科学、康复医学以及再生医学等学科的研究热点。
骨骼肌ECM的变化决定卫星细胞的状态和骨骼肌重塑过程。现阶段我们只知道氧化应激、低氧、损伤、运动训练和衰老能激活卫星细胞,但是具体的机制还不清楚。衰老的过程是错综复杂和循序渐进的,衰老造成ECM改变与卫星细胞功能缺失之间存在疑问,是衰老改变ECM进而引起卫星细胞功能的恶性变化,还是衰老诱导卫星细胞的混乱表达导致结构修饰的错误?从实验角度,卫星细胞在骨骼肌中含量较少,对实验技术要求较高。并且当前对卫星细胞的研究都是从哺乳动物中证实证明,后续需要大量的人体实验进行补充加以佐证。
衰老是人生的重要阶段和必经之路,如何让个体在老年生活中享受自我、健康生活实现“健康老年化”战略是体育科学、运动医学工作者的义务和责任。
[1] Reginster J Y, Cooper C, Rizzoli R, et al. Recommendations for the conduct of clinical trials for drugs to treat or prevent sarcopenia[J].Aging Clin Exp Res, 2016,28(1):47-58.
[2] Yin H, Price F, Rudnicki M A. Satellite cells and the muscle stem cell niche[J].Physiol Rev, 2013,93(1):23-67.
[3] Le Moal E, Pialoux V, Juban G, et al. Redox Control of Skeletal Muscle Regeneration[J].Antioxid Redox Signal, 2017.
[4] Thomas K, Engler A J, Meyer G A. Extracellular matrix regulation in the muscle satellite cell niche[J].Connect Tissue Res, 2015,56(1):1-8.
[5] Dumont N A, Wang Y X, Rudnicki M A. Intrinsic and extrinsic mechanisms regulating satellite cell function[J].Development, 2015,142(9):1572-1581.
[6] Conboy I M, Conboy M J, Wagers A J, et al. Rejuvenation of aged progenitor cells by exposure to a young systemic environment[J].Nature, 2005,433(7027):760-764.
[7] Kragstrup T W, Kjaer M, Mackey A L. Structural, biochemical, cellular, and functional changes in skeletal muscle extracellular matrix with aging[J].Scand J Med Sci Sports, 2011,21(6):749-757.
[8] Tierney M T, Sacco A. The role of muscle stem cell-niche interactions during aging[J].Nat Med, 2016,22(8):837-838.
[9] Lokmic Z, Lammermann T, Sixt M, et al. The extracellular matrix of the spleen as a potential organizer of immune cell compartments[J].Semin Immunol, 2008,20(1):4-13.
[10] Dinulovic I, Furrer R, Beer M, et al. Muscle PGC-1alpha modulates satellite cell number and proliferation by remodeling the stem cell niche[J].Skelet Muscle, 2016,6(1):39.
[11] Diaz-Ruiz A, Gonzalez-Freire M, Ferrucci L, et al. SIRT1 synchs satellite cell metabolism with stem cell fate[J].Cell Stem Cell, 2015,16(2):103-104.
[12] Chenette D M, Cadwallader A B, Antwine T L, et al. Targeted mRNA Decay by RNA Binding Protein AUF1 Regulates Adult Muscle Stem Cell Fate, Promoting Skeletal Muscle Integrity[J]. Cell Rep, 2016,16(5):1379-1390.
[13] Kuang S, Kuroda K, Le Grand F, et al. Asymmetric self-renewal and commitment of satellite stem cells in muscle[J].Cell, 2007,129(5):999-1010.
[14] Chazaud B. Inflammation during skeletal muscle regeneration and tissue remodeling: application to exercise-induced muscle damage management[J].Immunol Cell Biol, 2016,94(2):140-145.
[15] Chazaud B. Macrophages: supportive cells for tissue repair and regeneration[J].Immunobiology, 2014,219(3):172-178.
[16] Calve S, Odelberg S J, Simon H G. A transitional extracellular matrix instructs cell behavior during muscle regeneration[J].Dev Biol,2010,344(1):259-271.
[17] Wilschut K J, Haagsman H P, Roelen B A. Extracellular matrix components direct porcine muscle stem cell behavior[J]. Exp Cell Res, 2010,316(3):341-352.
[18] Urciuolo A, Quarta M, Morbidoni V, et al. Collagen VI regulates satellite cell self-renewal and muscle regeneration[J]. Nat Commun, 2013,4:1964.
[19] Grefte S, Vullinghs S, Kuijpers-Jagtman A M, et al. Matrigel, but not collagen I, maintains the differentiation capacity of muscle derived cells in vitro[J].Biomed Mater, 2012,7(5):55004.
[20] Ronning S B, Pedersen M E, Andersen P V, et al. The combination of glycosaminoglycans and fibrous proteins improves cell proliferation and early differentiation of bovine primary skeletal muscle cells[J]. Differentiation, 2013,86(1-2):13-22.
[21] Garg K, Boppart M D. Influence of exercise and aging on extracellular matrix composition in the skeletal muscle stem cell niche[J].J Appl Physiol (1985), 2016,121(5):1053-1058.
[22] Sousa-Victor P, Gutarra S, Garcia-Prat L, et al. Geriatric muscle stem cells switch reversible quiescence into senescence[J].Nature, 2014,506(7488):316-321.
[23] Snijders T, Verdijk L B, Smeets J S, et al. The skeletal muscle satellite cell response to a single bout of resistance-type exercise is delayed with aging in men[J].Age (Dordr), 2014,36(4):9699.
[24] Lacraz G, Rouleau A J, Couture V, et al. Increased Stiffness in Aged Skeletal Muscle Impairs Muscle Progenitor Cell Proliferative Activity[J].PLoS One, 2015,10(8):e136217.
[25] Gilbert P M, Havenstrite K L, Magnusson K E, et al. Substrate elasticity regulates skeletal muscle stem cell self-renewal in culture[J].Science, 2010,329(5995):1078-1081.
[26] Wood L K, Kayupov E, Gumucio J P, et al. Intrinsic stiffness of extracellular matrix increases with age in skeletal muscles of mice[J].J Appl Physiol (1985), 2014,117(4):363-369.
[27] Candiello J, Cole G J, Halfter W. Age-dependent changes in the structure, composition and biophysical properties of a human basement membrane[J]. Matrix Biol, 2010,29(5):402-410.
[28] Brack A S, Conboy M J, Roy S, et al. Increased Wnt signaling during aging alters muscle stem cell fate and increases fibrosis[J].Science, 2007,317(5839):807-810.
[29] Dennis R A, Przybyla B, Gurley C, et al. Aging alters gene expression of growth and remodeling factors in human skeletal muscle both at rest and in response to acute resistance exercise[J]. Physiol Genomics, 2008,32(3):393-400.
[30] Qaisar R, Bhaskaran S, Van Remmen H. Muscle fiber type diversification during exercise and regeneration[J].Free Radic Biol Med, 2016,98:56-67.
[31] Hyldahl R D, Nelson B, Xin L, et al. Extracellular matrix remodeling and its contribution to protective adaptation following lengthening contractions in human muscle[J].FASEB J, 2015,29(7):2894-2904.
[32] Ogasawara R, Nakazato K, Sato K, et al. Resistance exercise increases active MMP and beta1-integrin protein expression in skeletal muscle[J].Physiol Rep, 2014,2(11).
[33] Deus A P, Bassi D, Simoes R P, et al. MMP(-2) expression in skeletal muscle after strength training[J].Int J Sports Med, 2012,33(2):137-141.
AdvanceofAging&Exercise-InducedExtracellularMatrixChangesonSkeletalMuscleRegenerationStudy
JIN Jing1、2,FENG Yi-zhong2,YANG Zhou1,FENG Yan1,CHEN Cai-zhen1,LU Jian1
(1.School of Sports and Health, East China Normal University, Shanghai 200241, China;2.Sports and Military Training Department, Zhejiang A&F University, Linan 311300, China)
Population Aging problem increasingly prominent in our country, the aging causeattenuation syndrome of skeletal muscle occurred seriously affect the elderly life self-care ability. Skeletal muscle satellite cells also called skeletal muscle stem cells, for muscle repair and skeletal muscle regeneration process play an important role.Extracellular matrix of the skeletal muscle provides structural support and signal transmission, the aging-induced of the extracellular matrix by malignant changes directly affect the activation, proliferation and differentiation of skeletal muscle satellite cells to restore function of normal play.In this article, through the form of a literature review, summarizes the extracellular matrix, extracellular matrix in skeletal muscle regeneration regulation, the influence of the aging of the extracellular matrix, exercise-induced malignant direction reverse by aging, etc., looking for new therapeutic targets for slow attenuation of the skeletal muscle, in order to implement the strategy of healthy aging.
aging;resistance;extracellular matrix;satellite cells;sarcopenia;regeneration
2017-06-20
金 晶(1987-),男,讲师,在读博士,主要研究方向:运动与衰老.
卢 健
1004-3624(2017)06-0091-06
G804.21
A

