替莫唑胺载药凝胶的制备与表征
张 宁,陈明宇,杨李影,徐 健,钟 平,戎宗明
(1.华东理工大学 化学与分子工程学院,上海 200237;2.复旦大学附属华山医院,上海 200040)
替莫唑胺载药凝胶的制备与表征
张 宁1,陈明宇2,杨李影1,徐 健2,钟 平2,戎宗明1
(1.华东理工大学 化学与分子工程学院,上海 200237;2.复旦大学附属华山医院,上海 200040)
本文采用明胶,聚乙烯醇等生物可降解的高分子材料为基质制备替莫唑胺载药凝胶,采用扫描电镜、接触角测量仪对替莫唑胺载药凝胶的理化性能进行了表征,并通过紫外分光光度计研究了药物的释放规律.结果显示:在明胶海绵中分别加入聚乙烯醇、聚乙二醇和聚谷氨酸等高分子材料能有效降低海绵的空隙率,使其符合载药的要求,所制备的替莫唑胺载药混合海绵的包封率在60%以上,但缓释时间较短,且受所加入高分子材料的亲水性的影响;而以聚乙烯醇为主体制备的替莫唑胺载药凝胶,其包封率可达90%以上,缓释时间最高可达130h,而加入适量的明胶可调控载药凝胶的亲水性和缓释速度.
明胶;聚乙烯醇;体外药物释放;替莫唑胺
生物可降解的明胶海绵和水凝胶已经在医学、手术中得到广泛的应用,如作为介入止血和栓塞材料[1-2];由海藻酸钠或聚乳酸制成的水凝胶作为术后防粘连剂和填充剂[3-5];或将其制作成药物载体[6-9].以明胶为基质制备的吸收性明胶海绵已经成功的用于手术止血等方面,且可留置在体腔内等.由于在明胶海绵和水凝胶的制备中,常采用戊二醛等作为交联剂,并在交联后水洗去除剩余物[10-11],以及孔隙率较大等原因,在药物载体的应用中受到一定的限制.
替莫唑胺(3,4-dihydro-3-methyl-4-oxoimidazo[5,1-d]-as-tetrazine-8-carboxamide,TMZ)是至今为止治疗恶性胶质瘤最有效的抗癌化疗制剂[12],但目前该药主要以口服形式进入人体,长期服用会有一系列副作用[13].调查显示,对于脑胶质瘤患者,采用口服TMZ联合化疗的治疗方式,2年的生存率是26.5%[14].因此,设想若能将替莫唑胺制备成生物可降解的缓释载体,在胶质瘤切除手术后直接留置在肿瘤发生部位,从而能够起到直接和长期的化疗作用.本文先从已在脑部手术运用的止血明胶海绵出发,分别采用生物可降解的高分子材料(聚乙烯醇、聚乙二醇和聚谷氨酸)与明胶混合,以低毒性的碳化二亚胺盐酸盐或可食用香料香兰素为交联剂,通过降低明胶海绵的孔隙率和毒性,分别制备了载TMZ药物的明胶/聚合物混合海绵;为了进一步延长明胶海绵的缓释时间,尝试了以在生物医学工程方面被广泛应用的聚乙烯醇[15-17]为主体,并加入适量的明胶进行性能调控,制备TMZ载药凝胶,考察了其性能随聚合物组成的变化关系.同时对所制备的两种TMZ载药材料的体外缓释行为进行了研究.
1 实验部分
1.1原料与仪器
原料:替莫唑胺(TMZ),天津天士力制药股份有限公司;明胶(医用级),罗赛洛明胶有限公司;聚乙二醇(PEG,AR),上海凌峰化学试剂有限公司;聚谷氨酸(PGA,AR)、聚乙烯醇(PVA,医用级)和1-乙基-3-(3-3甲氨丙基)碳二亚胺盐酸盐(EDC·HCL),上海紫一试剂有限公司;香兰素,阿拉丁试剂有限公司;吸收性明胶海绵(SP明胶海绵),金陵药业股份有限公司南京金陵制药厂.
仪器:扫描电子显微镜(S-3400N),日立公司;紫外分光光度计(UV765),上海精科仪器有限公司,接触角测量仪(JC2000D1),上海中晨数字技术设备有限公司.
1.2载药凝胶的制备方法
1.2.1 TMZ载药明胶/聚合物混合海绵的制备
室温条件下,将1%的明胶溶液和1%的PVA水溶液或1%的PEG水溶液或1%的PGA水溶液以一定的比例混合均匀,然后加入TMZ水溶液,使得TMZ的最终浓度为0.99mg/mL,搅拌混合均匀,低温(4℃)24h形成凝胶,冷冻干燥后,0.05% EDC·HCL无水乙醇溶液交联24h,醇洗,再次冷冻干燥.同时以不加入药物的样品为对照组.
1.2.2 TMZ载药聚乙烯醇/明胶凝胶的制备
60℃条件下,取20%的PVA水溶液,加入明胶(明胶∶PVA=0∶100~30∶70),混合均匀,冷却到室温,加入0.33g/mL的香兰素甲醇溶液(香兰素的最终浓度为0.04g/mL),混合均匀,再加入2%的醋酸溶液(醋酸的最终浓度为0.01%),混合均匀,升温到60℃,反应17h,然后降温到30℃条件下与TMZ溶液混合,使得TMZ的最终浓度为0.99mg/mL,搅拌均匀,30℃条件下继续反应,形成凝胶后室温干燥.同时以不加入药物的样品为对照组.
1.3载药凝胶的性质表征
1.3.1 溶胀率的测定方法
制作面积为10mm×10mm、厚度为5mm或1mm的样品,称重W0,在37℃的PBS缓冲溶液中浸泡;滤纸吸去表面水分,称重至恒重Wt,则样品的溶胀率Q为:
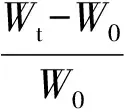
(1)
1.3.2 孔隙率的测定方法
采用乙醇溶液置换法进行测定.制作面积为10mm×10mm、厚度为5mm或1mm的样品,天平测定重量W0,千分尺测定样品的长、宽、厚度,计算样品体积V0,浸入无水乙醇溶液24h,称重Wf,无水乙醇的密度记为ρ,则样品的孔隙率P为:
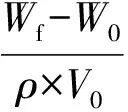
(2)
1.3.3 溶解性的测定方法
制作面积为10mm×10mm、厚度为5mm或1mm的样品,浸入37℃ PBS缓冲溶液中,观察并记录样品在PBS溶液中的溶解情况,并分别记录样品完全溶解的时间.
1.3.4 载药量和包封率的测定
由于TMZ在37℃和pH=7.4条件下,极易转化为其活性化合物5-(3-甲基3氮烯-1-基)咪唑-4-酰胺(MTIC),故参照文献报道的方法[18],在波长为268nm处建立了以MTIC在标准PBS磷酸缓冲溶液(pH=7.4)中的浓度与紫外吸收峰强度间的标准曲线,c=(28.867Abs+0.054)g/L-1,相关系数R=0.999,浓度范围在1.75~4.25mg/mL.
载药量(DL)和包封率(ER)的测定是:称取定量的载药凝胶海绵或凝胶样品,将其在PBS缓冲液中完全溶解并在37℃水浴中放置6h以上待其转化成MTIC后,在268nm处测定其紫外吸光度,按标准曲线计算MTIC的量.载药量和包封率的计算公式为:

(3)
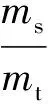
(4)
式中ms为包裹进凝胶的药物量,m0为总的共聚物投入量,mt为总的药物投入量.
1.3.5 药物缓释速度的测定
将定量载药凝胶样品置于透析袋中,放置于含有80mL的PBS溶液烧杯中,37℃条件下恒温并搅拌.每隔一段时间取2.0mL的释放介质,同时加入2.0mL新鲜的释放介质.在一定的时间点取样,同时观察并记录样品的外观状态.将取出的释放介质在37℃的水浴中放置6h以上后,紫外分光光度计测定MTIC在268nm的吸光度,按标准曲线计算TMZ浓度而得到缓释曲线.
2 结果与讨论
2.1TMZ载药明胶/聚合物混合海绵的性能
2.1.1 明胶/聚合物混合海绵的孔隙率和溶胀率研究
为了改善明胶海绵的孔隙率,延长明胶海绵的降解时间,使其能达到载药的可能,满足临床应用的需求,故采用明胶与其它生物可降解高分子混合制备混合海绵.分别考察了明胶与PVA、PEG和PGA 3种高分子混合制得的明胶/聚合物混合海绵的孔隙率、溶胀率和分解速度与所添加的聚合物比例的变化关系.
图1是明胶/聚合物混合海绵的孔隙率和溶胀率随所添加的高分子质量分数的变化关系.从图中可以看到,孔隙率和溶胀率都随着所添加的高分子含量的增加,有一个先减小后增大的变化趋势,这是由于线性状的高分子分散在明胶骨架中,减少了明胶骨架中的空间,同时也使得其吸水膨胀的能力降低;而当这些水溶性高分子浓度进一步增加时,其与明胶间的相容性也会改变,反而使孔隙率和溶胀率增加.

图1 不同配比的明胶/聚合物混合海绵性质的比较Fig.1 Characterization of gelatin-polymer sponges with different ratio of polymer
重点考虑明胶/聚合物混合海绵载药的要求,特别是高分子添加物对孔隙率的影响,可以确定PVA、PEG和PGA与明胶混合的最佳质量分数分别是0.2、0.05和0.05.表1给出了在这3个配比时制备的明胶/聚合物混合海绵与商品化样品SP海绵性质的比较:除了溶胀率高于SP海绵外,孔隙率却大为下降,而且明胶/聚合物混合海绵的最长完全溶解时间(tsolubility)也较SP海绵增加了近一倍的时间.
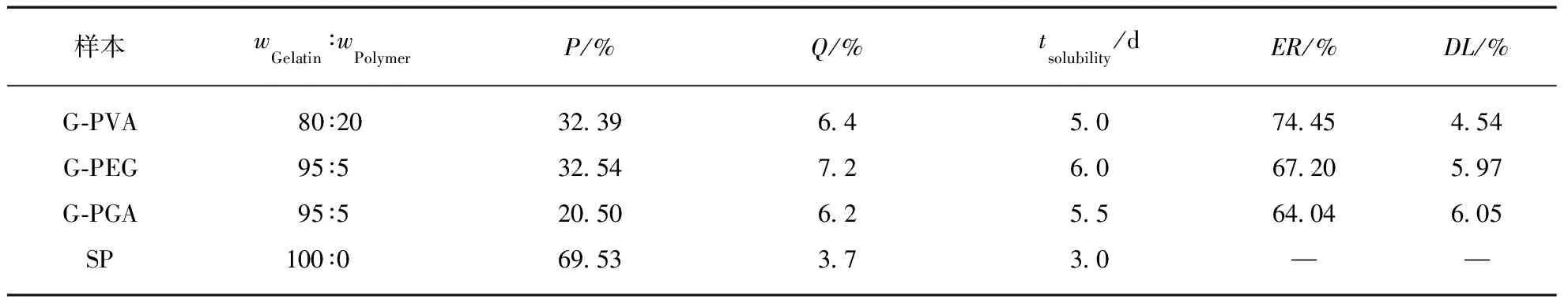
表1 明胶/聚合物混合海绵与SP的性能比较Tab.1 The characterization of different gelatin-polymer sponges
2.1.2 TMZ载药明胶/聚合物混合海绵的外观和微观结构
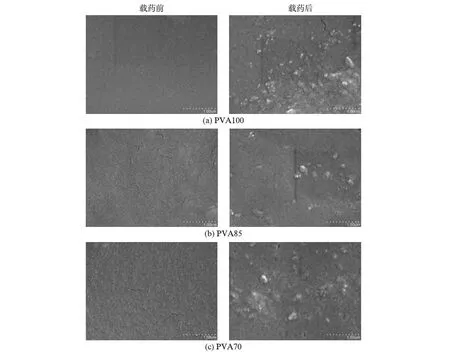
图2是根据表1所列的配比制备的TMZ载药明胶/聚合物混合海绵与SP明胶海绵的外观和微观比较:4个样品均为白色海绵状,b,c,d 3组TMZ载药明胶/聚合物混合海绵的表面比SP海绵的外观更加致密,与表1中的孔隙率数据一致,即样品SP的孔隙率最高;从SEM图来看,虽然4组明胶海绵的孔隙直径相差不大,但SP海绵形成的是贯通的孔洞,而b,c,d 3组TMZ载药明胶/聚合物混合海绵,由于高分子材料的加入,形成的是不规则的不完全贯通的孔洞.而且b,c,d 3组TMZ载药明胶/聚合物混合海绵的孔隙率较低,故可以加载一定量的TMZ药物.
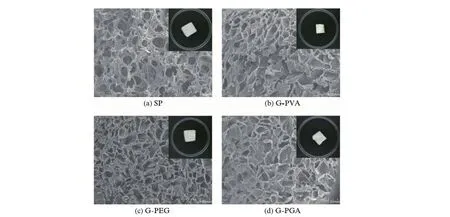
图2 SP明胶海绵与载药明胶/聚合物混合海绵的SEM图(放大倍率为50k),插图为各个海绵的外观照片Fig.2 SEM images of SP gelatin sponges and drug-loaded gelatin-polymer sponges at 50k magnification,inset:photographs of different sponges
图3是明胶/聚合物混合海绵加载TMZ药物前后放大30k倍率时的SEM图对比.可以看到没有加载药物的明胶/聚合物混合海绵的截面光滑,无颗粒物的存在;而在载药的明胶/聚合物混合海绵上能明显地观察到颗粒物的存在,说明药物确实已载入于其中.
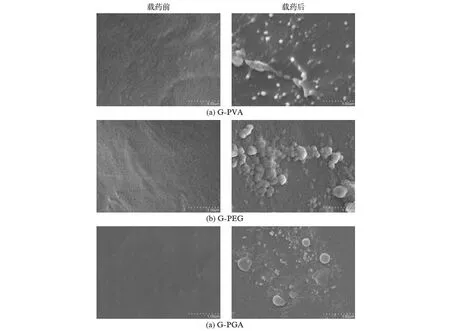
图3 各种载药明胶/聚合物混合海绵载药前后的SEM图对比(放大倍率为30k)Fig.3 SEM images of gelatin-polymer sponges before and after drug loading at 30k magnification
2.1.3 TMZ载药明胶/聚合物混合海绵的包封率与体外释放速率
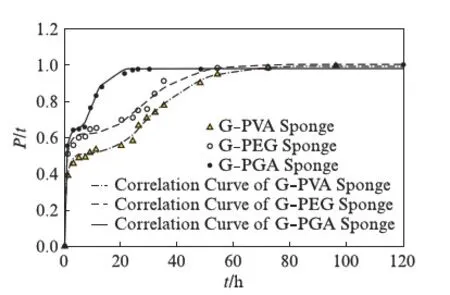
图4 3种载药明胶/聚合物混合海绵的释放曲线Fig.4 Release profiles of TMZ from drug-loaded gelatin-polymer sponges in PBS
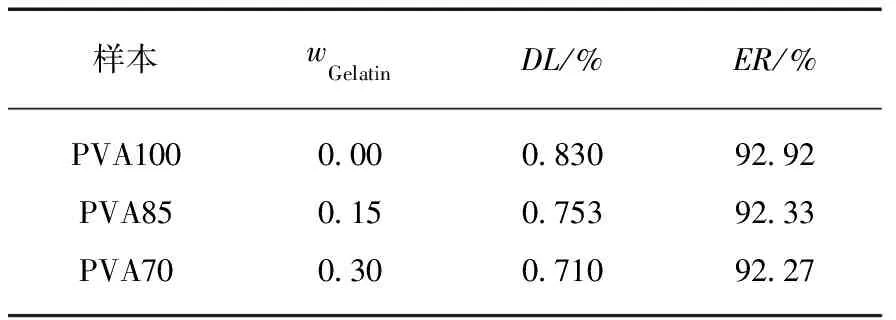
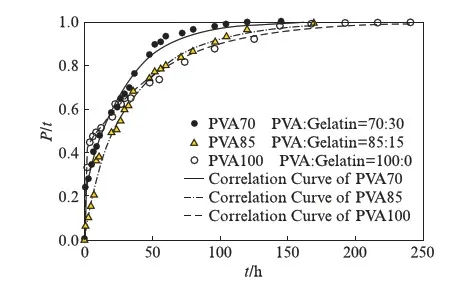
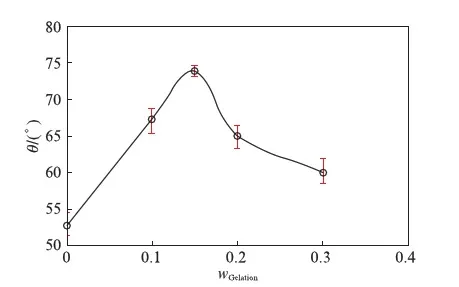
表1同时给出了3种TMZ载药明胶/聚合物混合海绵的包封率和载药量.虽然高分子材料的加入,降低了混合海绵的孔隙率,但TMZ药物分子很小,在冷冻干燥等制备过程中易造成损失,所以包封率在60%~75%之间;另外TMZ微溶于水,也是载药率偏低的一个影响因素.3种载药明胶/聚合物混合海绵在PBS缓冲溶液中的药物释放曲线见图4.从图中可以看到,载药明胶/聚合物混合海绵的释放速度依次为:G-PVA 文献报道一般载药明胶海绵的药物释放时间为30h左右[20],本文所制备的载药明胶/聚合物混合海绵的释放时间可长达60h以上,说明采用合适的高分子混合形成明胶/聚合物混合海绵,在保持明胶海绵本身的止血效果外,还能降低其孔隙率而使其能加载其他的小分子药物,同时还可延长药物缓释时间. 2.2TMZ载药聚乙烯醇/明胶凝胶的性能 载药明胶/聚合物混合海绵虽然延长了药物的缓释时间,但对于缓释时间还有进一步增加的空间.为增加载药体的药物缓释时间,采用良好的药物缓释基质材料聚乙烯醇[15-17],制备了聚乙烯醇/明胶载TMZ凝胶,考察明胶含量的变化对载药凝胶的性能和药物缓释的影响. 2.2.1 聚乙烯醇/明胶凝胶的孔隙率和溶胀率研究 聚乙烯醇/明胶凝胶的孔隙率随所添加的明胶质量分数的变化曲线见图5(a).纯聚乙烯醇凝胶的孔隙率仅为4.48%,随着添加的明胶量增加,虽然孔隙率也相应增加,但是当明胶的质量分数达0.3时,孔隙率也仅增加到9.5%,只是明胶/聚合物混合海绵的1/3不到.图5(b)给出的是不同明胶含量的聚乙烯醇/明胶凝胶的溶胀率随时间的变化曲线,图中可以看出,在PBS缓冲溶液浸泡7h之内,凝胶的溶胀率有较快地增加,随后趋于平缓,纯聚乙烯醇凝胶浸泡80h后,其溶胀率仍在1%以下;随着凝胶中明胶含量的增加,聚乙烯醇/明胶凝胶的溶胀量和速度也相应地提高,但仍处于5%以下的范围. 图5 聚乙烯醇/明胶混合凝胶的性质随明胶的质量分数的变化关系Fig.5 Characterization of gels with different ratio of gelatin 2.2.2 TMZ载药聚乙烯醇/明胶凝胶的外观和微观结构 TMZ载药聚乙烯醇/明胶凝胶的外观见图6,均为透明、柔软的弹性体,随着明胶含量的增加,凝胶的颜色逐渐变黄,但其柔软性、弹性、韧性基本不变,均可360°弯曲折叠.SEM图显示凝胶内无明显孔隙存在. 图6 TMZ载药聚乙烯醇/明胶凝胶的外观及SEM图Fig.6 Photographs and SEM images of Drug-loaded PVA-gelatin gels with different ratios of PVA 图7为所制备凝胶载药前后的SEM图,载药前凝胶的质地均较均匀,无明显的颗粒物存在,而载药后则可明显地看到有药物颗粒的存在. 图7 聚乙烯醇/明胶凝胶载药前后的SEM图(放大倍率为30k)Fig.7 SEM images of PVA-gelatin gels with different ratio of PVA before and after drug loading at 30k magnification 2.2.3 TMZ载药聚乙烯醇/明胶凝胶的包封率和体外释放速率 表2给出了实验所制备的3组TMZ载药聚乙烯醇/明胶凝胶的载药量和包封率.与载药明胶/聚合物凝胶海绵相比,虽然药物不变,仍是微溶于水的TMZ,但由于聚乙烯醇/明胶凝胶的孔隙率很低,小分子药物不易泄漏,所以包封率都达到了90%以上;但由于TMZ在水中的溶解度较低且聚乙烯醇溶液的粘度较高,使得TMZ难以溶解和分散,增加了实验在操作方面的难度,从而使TMZ载药聚乙烯醇/明胶凝胶的载药量均比较低. 表2 TMZ载药聚乙烯醇/明胶凝胶的载药量和包封率Tab.2 DL and ER of drug-loaded gels 采用透析法观察TMZ载药聚乙烯醇/明胶凝胶的药物释放,同时以空白的聚乙烯醇/明胶凝胶作为对照组,实验测得的药物释放速率P与时间τ的变化关系见图8.图8中的释放曲线反映了药物释放过程经历了两个阶段[21]:突释阶段和扩散阶段.突释阶段,一般是吸附在载体表面的药物快速溶出过程,因此,载药凝胶表面的亲水性越好,其药物溶出的速度也会越快.实验测得了水在载药凝胶表面的接触角随明胶含量的变化关系(见图9),其中水在PVA100上的接触角最小,说明其亲水性最好,故表面药物最易溶出,释放的初始速度也最大;而PVA85的亲水性最差,药物释放的初始速度也最慢.而扩散阶段的速率与药物在凝胶中的扩散速度和凝胶的降解速率有关[22].虽然交联后的聚乙烯醇凝胶的降解速度很慢,但混合在凝胶中的明胶在PBS缓冲溶液中的溶出加速了药物的释放,因此,在TMZ载药聚乙烯醇/明胶凝胶中,明胶的含量越高,药物释放速率也越快.以药物释放率为95%所需时间为例,含30%明胶的载药凝胶所需时间为72h,含15%明胶的载药凝胶的释放时间约为115h,而纯聚乙烯醇载药凝胶可达130h以上,超过了某些载TMZ高分子微球的缓释时间[23]. 与载药明胶/聚合物混合海绵相比,TMZ载药聚乙烯醇/明胶凝胶具有良好的致密性,弹性,柔软性,更高的包封率,更长的缓释时间,且可以通过控制明胶含量来调控药物的缓释速率,更有利于临床应用. 图8 聚乙烯醇/明胶载TMZ凝胶的释放曲线Fig.8 Release profiles of TMZ from drug-loaded gels in PBS 图9 聚乙烯醇/明胶载TMZ凝胶的接触角Fig.9 Contact angle of TMZ from drug-loaded gels in PBS 2.3药物释放曲线的关联 载药明胶/聚合物混合海绵的药物体外释放动力学速率可采用两个不同的Compertz模型[24-25]来分别描述两个阶段的累积释放量,其方程的形式为: (5) 而TMZ载药聚乙烯醇/明胶凝胶的突释阶段和扩散阶段的释放速率可分别由Compertz二级释放模型和一级释放速率模型的线性组合来描述,方程形式为: (6) 两式中的αi,βi,γi(i=1,2)和x为关联参数,由实验数据拟合得到. 表3给出了关联得到的参数、似然比指数(LRI)、平均绝对误差(AAE)和平均相对误差(ARE),LRI与相关系数R相当,越接近于1,表明关联效果越好.关联曲线与实验值的比较可见图4和图8,两者很好地相符,说明此两方程能反映所研究的两类载药凝胶的药物释放行为. 表3 方程(5)和(6)的关联结果Tab.3 The fitting data for Equations (5) and (6) 本文所制备的两种TMZ载体,均具有缓释作用,且生物相容好、可降解的性能.其中以明胶与生物可降解的高分子所制备的载TMZ混合海绵,其包封率最高为74.45%,缓释时间60h以上,在保持明胶海绵原有的临床止血功能外,同时具备了治疗脑部胶质瘤的可能性,更贴近于临床应用;而载TMZ的聚乙烯醇/明胶凝胶,具有更高的包封率和缓释时间,其包封率可达90%以上,缓释时间最高可达130h,且可通过明胶含量来调控其亲水性和药物释放速率,同时具有良好的致密性、弹性和柔软性,但要临床应用还需进一步探讨. [1] HUO L,RUAN W H,DING Z L,etal.Clinical hemostasis effect of a novel hemostatic material SURGICELTMversus gelatin sponge in neurosurgery [J].ChineseJournalofTissueEngineeringResearch,2012,16(3):551-553. [2] 季文斌,王卫珍,陈进,等.平阳霉素碘化油乳剂加明胶海绵颗粒栓塞法在肝血管瘤介入治疗中的疗效研究 [J].解放军医学杂志,2015,40(6):513-514. [3] CHATURVEDI A A,LOMME R M,THENDRIKS T,etal.Ultrapure alginate anti-adhesion gel does not impair colon anastomotic strength [J].JournalofSurgicalResearch,2014,192(2):432-439. [4] CHATURVEDI A A,BUYNE O R,LOMME R M,etal.Efficacy and safety of ultrapure alginate-based anti-adhesion gel in experimental peritonitis [J].SurgicalInfections,2015,16(4):410-414. [5] POVERDA S,RODRIGO A,GAMBOA T C,etal.Injectable composites of loose microfibers and gelatin with improved interfacial interaction for soft tissue engineering [J].Polymer,2015,74:224-234. [6] VANDELLI M A,RIVASI F,GUERRA P,etal.Gelatin microspheres crosslinked with D.L-glyceraldehyde as a potential drug delivery system:Preparation,characterisation in vitro and in vivo studies [J].InternationalJournalofPharmaceutics,2001,215(2):175-184. [7] PISAL P B,PATIL S S,POKHARKAR V B.Rheological investigation and its correlation with permeability coefficient of drug loaded carbopol gel:Influence of absorption enhancers [J].DrugDevelopment&IndustrialPharmacy,2013,39(4):593-599. [8] WEI L,CAI C H,LIN J P,etal.Dual-drug delivery system based on hydrogel/micelle composites [J].Biomaterials,2009,30(13):2606-2613. [9] 楚立凯,岳凌,杨占山,等.壳聚糖温敏性水凝胶蛋白载体的制备及其性能研究 [J].复旦学报(自然科学版),2015,54(5):609-615. [10] TIHAN G T,UNGUREANU C,BARBARESSO R C,etal.Chloramphenicol collagen sponges for local drug delivery in dentistry [J].ComptesRendusChimie,2015,18(9):986-992. [11] IMANI R,RAFIENIA M,EMAMI S H.Synthesis and characterization of glutaraldehyde-based crosslinked gelatin as a local hemostat sponge in surgery:an in vitro study [J].BiomedicalMaterialsandEngineering,2013,23(3):211-224. [12] QIAO H Z,LI Y,WANG Y,etal.Synthesis and Characterization of Multi-Functional Linear-Dendritic Block Copolymer for Intracellular Delivery of Antitumor Drugs [J].InternationalJournalofPharmaceutics,2013,452(1-2):363-373. [13] NANJWADE B K,BECHRA H M,DERKAR G K,etal.Dendrimers:Emerging Polymers for Drug-Delivery Systems [J].EuropeanJournalofPharmaceuticalSciences,2009,38(3):185-196. [14] STUPP R,MASON W P,VAN DEN BENT M J,etal.Radiotherapy plus Concomitant and Adjuvant Temozolomide for Glioblastoma [J].NewEnglandJournalofMedicine,2005,352(10):987-996. [15] BODUGOZ H,CHOI J,ORAL E,etal.The effect of polyethylene glycol on the stability of pores in polyvinyl alcohol hydrogels during annealing [J].Biomaterials,2008,29(2):141-149. [16] LIN W C,YU D G,YANG M C.Blood compatibility of novel poly(γ-glutamic acid)/po1yvinyl alcohol hydrogels [J].ColloidsandSurfacesB:Biointerfaces,2006,47(1):43-49. [17] DINI L,PANZARINI E,MICCOLI MA,etal.Invitrostudy of the interaction of polyalkilimide and polyvinyl alcohol hydrogels with cells [J].TissueandCell,2005,37(6):479-487. [18] 曹小毅,朱宏.微球中替莫唑胺含量测定方法的研究 [J].化工之友,2007(11):38-39. [19] ISLAM A,YASIN T.Controlled delivery of drug from pH sensitive chitosan/poly(vinyl alcohol) blend [J].CarbohydratePolymers,2012,88(3):1055-1060. [20] KUIJPERS A J,VAN WACHEM P B,VAN LUYN M J,etal.Invivoandinvitrorelease of lysozyme from cross-linked gelatin hydrogels:A model system for the delivery of antibacterial proteins from prosthetic heart valves [J].JournalofControlledRelease,2000,67(2/3):323-336. [21] 肖玲,万冬,李洁,等.聚乙烯醇-壳聚糖-明胶不对称海绵的制备及其性能 [J].武汉大学学报(理学版),2005,51(4):443-447. [22] KONISHI M,TABATA Y,KARIYA M,etal.Invivoanti-tumor effect through the controlled release of cisplatin from biodegradable gelatin hydrogel [J].JControlRelease,2003,92(3):301-313. [23] 陈健,黄书岚,何文,等.替莫唑胺壳聚糖缓释微球的制备及体外释药特性 [J].中国医院药学杂志,2005,25(12):1115-1118. [24] 林亚平,董芸.药物释放数学模型的评价及选择 [J].数理医学杂志,1994(4):308-310. [25] DASH S,MURTHY P N,NATH L,etal.Kinetic modeling on drug release from controlled drug delivery systems [J].ActaPoloniaePharmaceutica,2010,67(3):217-223. PreparationandCharacterizationofTemozolomide-LoadedGels ZHANGNing1,CHENMingyu2,YANGLiying1,XUJian2,ZHONGPing2,RONGZongming1 ( 1.SchoolofChemistryandMolecularEngineering,EastChinaUniversityofScienceandTechnology,Shanghai200237,China; 2.HuashanHospital,FudanUniversity,Shanghai200040,China) We herein reported a series of Temozolomide(TMZ)-loaded gels which were prepared with biodegradable polymers,namely,gelatin and polyvinyl alcohol(PVA).The physicochemical properties of Temozolomide-loaded gels were confirmed by scanning electron microscope(SEM) and contact angle meter.Moreover,their behaviors of drug release were characterized by UV spectrophotometer.The results showed that the less porosity in gelatin sponge by mixing polyvinyl alcohol(PVA),polyethylene glycol(PEG) or polyglutamic acid(PGA) respectively was preferable to Temozolomide-loaded gels with drug encapsulation efficiency above 60%,but their degradation time was shorter and affected by the hydrophilicity of added polymers as well; while in Temozolomide loaded PVA gels with different amount of gelatin,the drug encapsulation efficiency was above 90%,accompanied by drug release time up to 130 hours at the maximum,moreover,hydrophilicity and release rate of the gels were adjusted by adding different amount of gelatin. gelatin; polyvinyl alcohol(PVA); drug releaseinvitro; Temozolomide 0427-7104(2017)05-0610-09 2016-06-20 张 宁(1988—),女,硕士研究生;戎宗明,副教授,通信联系人,E-mail:rongzm@ecust.edu.cn;钟 平,教授,通信联系人,E-mail:zhp228899@163.com. TB332;R944.2 A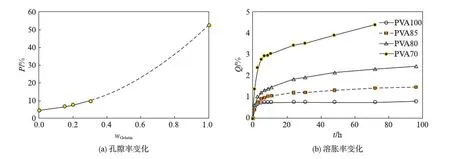

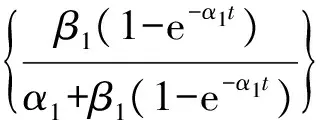
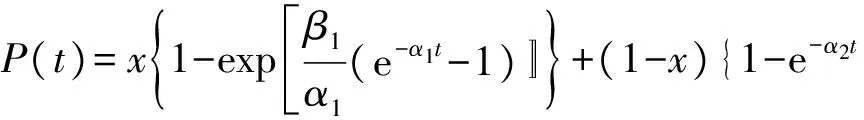

3 结 论

