供体MSCs来源的外泌体转运miR-26a恢复宿主MSCs功能并缓解骨质疏松
叶庆元 邱新毓 田荣 刘世宇
基础医学研究
供体MSCs来源的外泌体转运miR-26a恢复宿主MSCs功能并缓解骨质疏松
叶庆元 邱新毓 田荣 刘世宇
目的探讨移植的供体间充质干细胞(mesenchymal stem cells,MSCs)通过分泌外泌体缓解雌激素缺乏导致的骨质疏松的机制。方法建立12 只小鼠雌激素缺乏骨质疏松模型,通过siRNA调控MSCs外泌体释放及直接注射外泌体,明确外泌体的分泌在MSCs治疗骨质疏松中的作用;通过体外成骨分化诱导、茜素红染色、qPCR明确供体MSCs来源的外泌体对宿主MSCs功能的影响;通过miR-26a模拟物、抑制物转染、qPCR明确外泌体发挥治疗作用的机制。结果供体MSCs通过分泌外泌体缓解雌激素缺乏骨质疏松,并证明外泌体通过恢复骨质疏松宿主MSCs成骨分化功能缓解骨质疏松,外泌体可通过转运miR-26a恢复骨质疏松宿主MSCs的成骨分化功能。结论供体MSCs来源的外泌体可通过转运miR-26a恢复宿主MSCs功能并缓解骨质疏松。
间充质干细胞(MSCs); 骨质疏松; 外泌体
骨质疏松是一种危害性和发病率都非常高的骨代谢性疾病,严重威胁中、老年尤其是绝经期妇女骨质疏松患者的健康[1]。目前骨质疏松的治疗策略尚不能从根本上逆转骨质疏松的发生[2]。骨髓中的间充质干细胞(mesenchymal stem cells,MSCs)是骨再生的种子细胞,对维持正常骨代谢功能起到重要作用,其成骨分化功能的缺陷是骨质疏松发生的重要原因[3-4]。研究发现,移植的外源性MSCs可以通过调控宿主骨髓MSCs的成骨分化功能逆转骨质疏松[5-6],然而其调控机制仍不明确。近期研究发现,移植外源性细胞通过分泌外泌体影响宿主细胞的功能[7]。外泌体是一类直径介于30~100 nm之间具有膜结构的分泌型小体,可稳定转运microRNA(miRNA)等关键信号分子[8-9]。前期研究发现,在雌激素缺乏骨质疏松患者和雌激素缺乏小鼠骨质疏松模型中,骨髓MSCs的成骨分化功能缺陷与miR-26a等[10-11]多种miRNAs的异常低表达密切相关。因此提出假说:移植的供体MSCs能够通过转运关键miRNA调节宿主MSCs功能并缓解骨质疏松。
1 材料与方法
1.1 材料
1.1.1 动物 12 周龄雌性C57BL6/J小鼠购于第四军医大学动物实验中心,用于骨髓MSCs的分离培养、卵巢摘除去势骨质疏松模型建立以及系统注射治疗,动物实验程序符合第四军医大学动物使用与管理委员会规定。
1.1.2 主要试剂 α-MEM培养基、胎牛血清、左旋谷氨酰胺、2-巯基乙醇(Invitrogen,美国);外泌体分离提取试剂盒(System Biosciences,美国);蛋白提取试剂盒、蛋白定量试剂盒、Western blot发光液(Thermo,美国);β-甘油磷酸、维生素C、地塞米松、茜素红(Sigma,美国);microRNA及基因qPCR检测试剂盒、microRNA模拟物及抑制物(Qiagen,美国);抗小鼠CD63、CD81抗体、Rab27a siRNA(Santa Cruz,美国);Opti-MEM培养液、Lipofectamine 3000(Life Technologies,美国)。
1.2 方法
1.2.1 小鼠骨髓MSCs的分离培养 取12 周龄雌性C57BL6/J小鼠股骨和胫骨,利用PBS冲出全骨髓细胞,将单细胞悬液接种于含MSCs培养液的10 cm直径培养皿中,置于37 ℃和含5% CO2环境的细胞培养箱中。将贴壁克隆样生长的MSCs传代,第一代MSCs将用于本研究所有的实验。
1.2.2 MSCs来源外泌体的提取 将用于MSCs培养的胎牛血清在105g条件下离心过夜,配置不含外泌体的MSCs培养液。MSCs常规培养3 d后利用外泌体提取试剂盒提取培养液上清中的外泌体,并利用蛋白定量试剂盒进行蛋白定量。
1.2.3 小鼠去势骨质疏松模型(OVX)的建立及系统注射治疗 选取12 周龄雌性C57BL6/J 小鼠,腹腔注射1%戊巴比妥钠麻醉后,经背部切口,暴露分离双侧卵巢并完全切除。体内系统注射实验中,将200 μg外泌体或106个MSCs(未经处理或Rab27a-siRNA转染)混悬于200 μl PBS中,经尾静脉注射于去势骨质疏松小鼠。
1.2.4 扫描电镜 提取外泌体后,加入200 μl的2.5%戊二醛于4 ℃条件下固定12 h。然后将样本放入含有0.5%的氢氟酸和1 mol/L的磷酸混合液中进行电镀阳极化处理1 h。最后将整个样本放入扫描电子显微镜下观察(日立S-4800,日本)。
1.2.5 μCT检测及相关分析 MSCs或外泌体治疗4 周后,取小鼠椎骨(第四腰椎)置于固定液中充分固定,使用西门子μCT扫描股骨标本,按照相应标准程序对椎骨进行360°扫描,扫描参数为:电压160 kV、电流500 mA、分辨率10.44 μm,采用自带 Inveon Research Workplace软件系统进行3D图像重建、图像采集和骨密度(BMD)、骨体积分数(BV/TV)分析。
1.2.6 成骨诱导分化及茜素红染色 将MSCs于含有2 mmol/L β-甘油磷酸, 100 μmol/L维生素C和10 nmol/L地塞米松的小鼠MSCs成骨诱导液中培养,诱导7天后提取RNA进行qPCR检测,诱导21 d后使用60%异丙醇固定细胞并使用茜素红染色液染色。利用Image J软件分析茜素红染色阳性面积,并分析计算染色阳性面积占总面积的百分比值。
1.2.7 qPCR检测 使用qPCR检测miR-26a表达时,提取细胞总RNA,然后使用反转录试剂盒完成反转录,最后使用Qiagen公司的miR-26a引物、RUN6引物(内参)和qPCR试剂盒按照说明步骤在CFX96TM实时定量PCR仪中完成扩增和检测。使用qPCR检测Runx2表达时,使用Runx2引物、GAPDH引物(内参)和qPCR试剂盒完成扩增和检测。其中引物序列如下:Runx2的上游引物为5′-CAGTCCCAACTTCCTGTGCT-3′,下游引物为5′- CCCATCTGGTACCTCTCCGA-3′;GAPDH的上游引物为5′-CACCATGGAGAAGGCCGGGG-3′,下游引物为5′-GACGGACACATTGGGGG TAG-3′。
1.2.8 microRNA模拟物、抑制物及siRNA转染 本研究使用siRNA转染降低MSCs中Rab27a的表达,无效siRNA转染作为阴性对照。使用miR-26a 抑制物和模拟物转染抑制或过表达miR-26a,无效抑制物和模拟物作为阴性对照。为获得低表达miR-26a的外泌体,将MSCs转染miR-26a抑制物48 h后收集其分泌的外泌体。
1.3 统计学分析
使用SPSS 13.0软件进行统计分析。所有数据在分析前进行正态分布和方差齐性检验,分别利用t检验和方差分析检验2 组或多组之间差异的显著性,在多组之间两两比较时,使用Bonferroni方法进行P值的矫正,P<0.05时差异被认为具有显著性。
2 结 果
2.1 小鼠骨髓MSCs来源外泌体的获得及鉴定
扫描电镜结果显示MSCs分泌的外泌体为球形囊泡、直径小于100 nm(图 1A)。提取外泌体总蛋白并利用Western blot检测发现与细胞对照相比,外泌体表达相关标志蛋白CD81和CD63(图 1B),证明本研究成功提取MSCs分泌的外泌体。
2.2 MSCs通过分泌外泌体恢复骨质疏松小鼠骨量
系统注射MSCs能够有效缓解骨质疏松。为证明系统注射的供体MSCs是否通过分泌外泌体发挥治疗作用,本研究通过siRNA下调MSCs中一种控制外泌体释放的蛋白Rab27a[12]。μCT结果示(图 2A),MSCs系统注射4 周后显著缓解OVX骨质疏松症状,而抑制MSCs的外泌体释放显著抑制了MSCs的治疗作用;同时,直接注射外泌体4周后也能够显著缓解骨质疏松症状。骨密度(BMD)及骨体积分数(BV/TV)分析同样验证了上述结果(图 2B)。结果证明系统注射的供体MSCs通过分泌外泌体缓解骨质疏松。

图 1 MSCs来源外泌体的鉴定
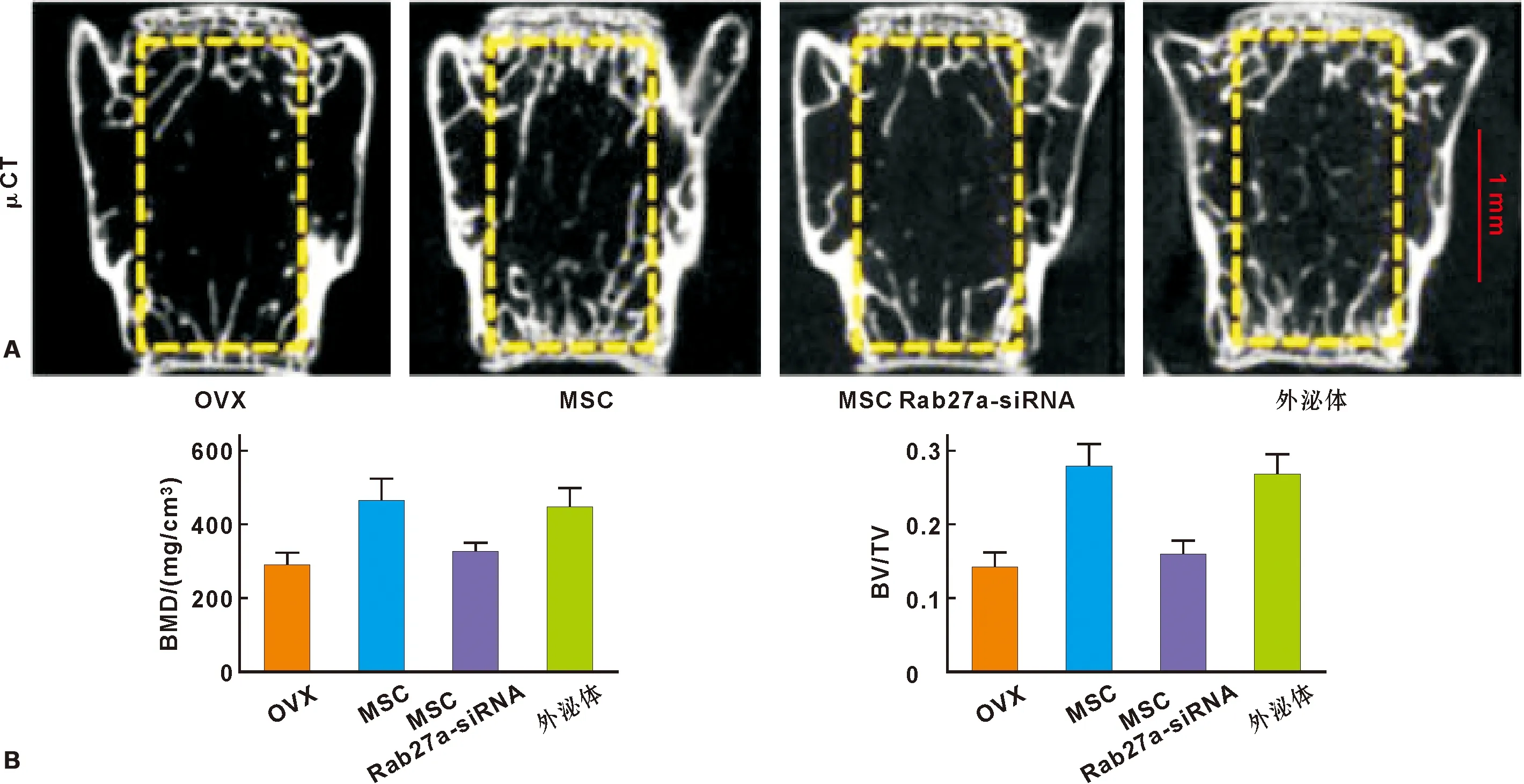
A: μCT小鼠椎骨扫描; B: 骨密度(BMD)及骨体积分数(BV/TV)分析
2.3 MSCs来源的外泌体恢复骨质疏松小鼠MSCs成骨分化功能
为进一步探讨供体MSCs如何通过外泌体缓解骨质疏松,我们在MSCs或外泌体系统注射4 周后分离培养宿主骨髓MSCs并进行成骨分化诱导,茜素红染色(图 3A)、染色阳性面积分析(图 3B)、Runx2表达结果(图 3C)显示,MSCs系统注射显著恢复宿主MSCs成骨分化功能,而抑制MSCs外泌体的分泌显著削弱了恢复作用。同时,外泌体注射产生了与MSCs注射相似的治疗作用。在MSCs培养液中直接加入外泌体(20 μg/ml),茜素红染色(图 3D~E)及Runx2表达显示外泌体显著促进了骨质疏松宿主MSCs的成骨分化功能。此部分结果证明了供体MSCs来源的外泌体通过恢复骨质疏松宿主MSCs的成骨分化功能缓解骨质疏松。
2.4 供体MSCs来源的外泌体转运miR-26a恢复宿主MSCs功能
骨髓MSCs中miR-26表达下调是MSCs分化功能缺陷及雌激素缺乏骨质疏松发生的重要原因[10],本研究验证了miR-26a在假手术组(Sham)及卵巢摘除组(OVX)的表达(图 4A)。为验证外泌体转运miR-26a恢复宿主MSCs功能的假说,首先以血清为对照,发现外泌体中含有miR-26a(图 4B)。进一步利用miR-26a模拟物提高MSCs中miR-26a的表达,并发现与低表达miR-26a的外泌体相比较,正常外泌体处理能够更大程度提高MSCs中miR-26a的表达(图 4C)。通过茜素红染色及染色面积分析发现(图 4D~E),转染miR-26a模拟物能够显著提高骨质疏松宿主MSCs的成骨分化功能;同时,通过对MSCs转染miR-26a抑制物获得低表达miR-26a的外泌体,与正常外泌体相对比,低表达miR-26a的外泌体促进MSCs成骨分化功能显著降低,Runx2表达进一步验证了上述结果(图 4F)。此部分结果显示,MSCs来源的外泌体能够转运miR-26a恢复骨质疏松宿主MSCs的成骨分化功能。
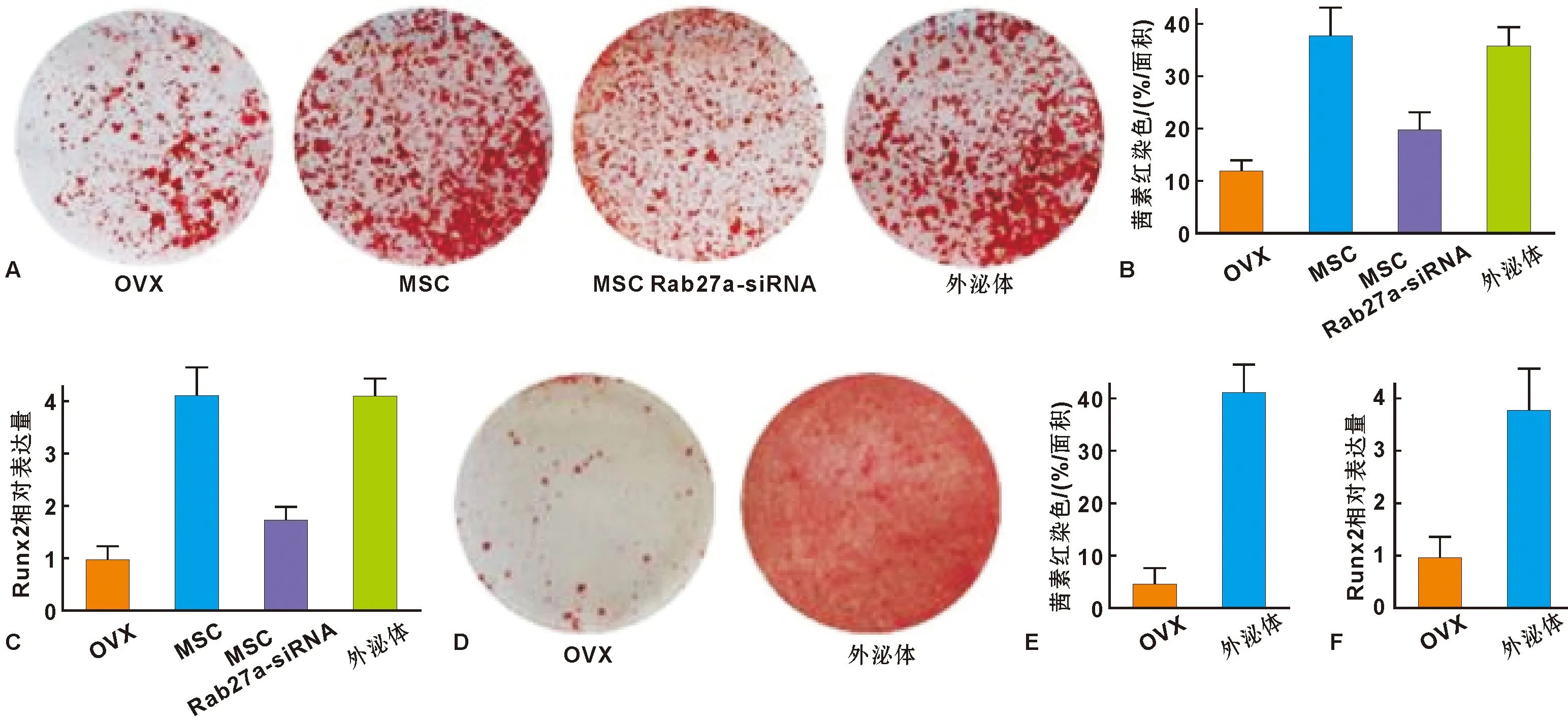
A、D: 茜素红染色; B、E: 茜素红染色面积分析; C、F: qPCR检测Runx2表达

A~C: qPCR检测miR-26a表达; D: 茜素红染色; E: 茜素红染色面积分析; F: qPCR检测Runx2表达
A-C: qPCR analysis of miR-26a; D: Alizarin red staining; E: Positive staining area analysis based on alizarin red staining; F: qPCR analysis of miR-26a
Fig 4 Rescue of MSC osteogenic differentiation of recipient OVX mice by exosomes through miR-26a
3 讨 论
《骨质疏松症防治中国白皮书》指出,我国至少有6 944 万人患有骨质疏松,预计到2020 年我国骨质疏松和低骨量患者将增加至2.8 亿,但是目前仍无安全有效的治疗方式,其主要原因为目前治疗方式仅能抑制骨吸收,并不能通过促进成骨恢复骨量从而逆转骨质疏松的发生。近期研究显示,MSCs系统注射能够通过恢复宿主成骨功能逆转骨质疏松,有望成为未来治疗骨质疏松的重要手段[5-6,12]。
MSCs移植已被证明能够在多种疾病的治疗中产生疗效,然而其机制仍然不明确。早期研究显示,移植的MSCs能够于宿主体内直接分化成为多种类型细胞促进组织再生[13-14];而后续研究发现,MSCs移植后存活并分化的细胞数量较少,而旁分泌作用在MSCs疗效产生中发挥关键作用[15];近期热点研究显示,外泌体在MSCs产生治疗作用的过程中同样发挥关键作用。以上研究说明,MSCs通过多种机制产生疗效,并在不同疾病条件及宿主环境中发挥不同治疗效果,因此,未来仍需继续探讨MSCs治疗的机制,调控多种机制并优化宿主环境,使治疗效果最大化。
本研究发现,系统注射小鼠来源的供体MSCs,能够通过分泌外泌体转运miR-26恢复卵巢去势小鼠的宿主MSCs功能并缓解骨质疏松。这一发现也提示了microRNA与维持机体骨量代谢平衡的相关激素可能具有密切关系,为研究如何缓解与治疗绝经后妇女因激素水平下调所造成的骨质疏松具有一定的参考价值。另外,MSCs分泌的外泌体中含有多种miRNA[8-9],未来仍需要探讨多种miRNA对骨质疏松的协同及拮抗作用,以通过调控外泌体中多种miRNA的表达提高外泌体的治疗作用。此外,在MSCs治疗中,如何控制移植细胞量、选择合适的移植区域和移植方式仍需要进一步探讨,这些研究不仅有望大幅提高MSCs的治疗效果,更有利于控制MSCs治疗所面临的潜在危险[16]。
[1]Prevention and management of osteoporosis[J]. World Health Organ Tech Rep Ser, 2003, 921: 1-164.
[2] Khan AA, Rios LP, Sándor GK, et al. Bisphosphonate-associated osteonecrosis of the jaw in Ontario: A survey of oral and maxillofacial surgeons[J]. J Rheumatol, 2011, 38(7): 1396-1402.
[3] 李光辉, 王茜, 居兆钰, 等. 应用外周血CD34+细胞与骨髓间充质干细胞共培养细胞膜片修复兔颅骨缺损[J]. 实用口腔医学杂志, 2013, 29(6): 761-765.
[4] 孙津龙, 明磊国, 沈丽娟, 等. Bax channel blocker逆转衰老骨髓间充质干细胞生物学行为的研究[J]. 实用口腔医学杂志, 2014, 30(3): 311-316.
[5] Antebi B, Pelled G, Gazit D. Stem cell therapy for osteoporosis[J]. Curr Osteoporosis Rep, 2014, 12(1): 41-47.
[6] Liu S, Liu D, Chen C, et al. MSC transplantation improves osteopenia via epigenetic regulation of notch signaling in lupus[J]. Cell Metab, 2015, 22(4): 606-618.
[7] Sun L, Akiyama K, Zhang H, et al. Mesenchymal stem cell transplantation reverses multiorgan dysfunction in systemic lupus erythematosus mice and humans[J]. Stem Cells, 2009, 27(6): 1421-1432.
[8] EL Andaloussi S, Mäger I, Breakefield XO, et al. Extracellular vesicles: Biology and emerging therapeutic opportunities[J]. Nat Rev Drug Discov, 2013, 12(5): 347-357.
[9] Théry C, Zitvogel L, Amigorena S. Exosomes: Composition, biogenesis and function[J]. Nat Rev Immunol, 2002, 2(8): 569-579.
[10]Li Y, Fan L, Hu J, et al. MiR-26a rescues bone regeneration deficiency of mesenchymal stem cells derived from osteoporotic mice[J]. Mol Ther, 2015, 23(8): 1349-1357.
[11]Yang N, Wang G, Hu C, et al. Tumor necrosis factor alpha suppresses the mesenchymal stem cell osteogenesis promoter miR-21 in estrogen deficiency-induced osteoporosis[J]. J Bone Miner Res, 2013, 28(3): 559-573.
[12]Ostrowski M, Carmo NB, Krumeich S, et al. Rab27a and Rab27b control different steps of the exosome secretion pathway[J]. Nat Cell Biol, 2010, 12(1): 19-30.
[13]Altman AM, Matthias N, Yan Y, et al. Dermal matrix as a carrier forinvivodelivery of human adipose-derived stem cells[J]. Biomaterials, 2008, 29(10): 1431-1442.
[14]Kuo TK, Hung SP, Chuang CH, et al. Stem cell therapy for liver disease: Parameters governing the success of using bone marrow mesenchymal stem cells[J]. Gastroenterology, 2008, 134(7): 2111-2121, 2121, e1-3.
[15]Liu S, Jiang L, Li H, et al. Mesenchymal stem cells prevent hypertrophic scar formation via inflammatory regulation when undergoing apoptosis[J]. J Invest Dermatol, 2014, 134(10): 2648-2657.
[16]Herberts CA, Kwa MS, Hermsen HP. Risk factors in the development of stem cell therapy[J]. J Transl Med, 2011, 9: 29-29.
RescueofrecipientMSCfunctionsandremissionofrecipientosteoporosisbydonorMSC-derivedexosomesthroughtransferofmiR-26a
YEQingyuan,QIUXinyu,TIANRong,LIUShiyu.
710032Xi'an,StateKeyLaboratoryofMilitaryStomatology&NationalClinicalResearchCenterforOralDiseases&ShaanxiKeyLaboratoryofOralDiseases,DepartmentofOralHistologyandPathology,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,China
Objective: To explore mechanisms underlying the rescuing effects of transplanted mesenchymal stem cells(MSCs) derived exosomes on estrogen-deficient osteoporosis.MethodsMouse estrogen-deficient osteoporosis model was constructed in 12 female C57BL6/J rats and the exosome release was regulated by siRNA. Osteogenic induction, alizarin red staining and qPCR were performed to evaluate the effects of exosomes on recipient MSC functions. The miR-26a mimics and inhibitors and qPCR were used to explore the mechanisms underlying exosome-mediated functional rescue of recipient MSCs.ResultsDonor MSCs alleviated estrogen-deficient osteoporosis via exosome release, and the alleviated osteoporosis by exosomes rescued the recipient MSC functions were observed. Moreover, the rescued recipient MSC functions by exosomes transferred miR-26a were found.ConclusionDonor MSC-derived exosomes may rescue MSC functions and may remit osteoporosis of the recipient through transfering miR-26a.
Mesenchymalstemcells(MSCs);Osteoporosis;Exosomes
国家自然科学基金面上项目(编号: 31670995)
710032 西安, 军事口腔医学国家重点实验室, 口腔疾病国家临床医学研究中心, 陕西省口腔疾病国际联合研究中心, 第四军医大学口腔医院组织病理学教研室[叶庆元(现就读于第四军医大学学员一旅) 邱新毓 田荣 刘世宇]
刘世宇 E-mail: liushiyu123@126.com
R329
A
10.3969/j.issn.1001-3733.2017.05.001
(收稿: 2017-05-08 修回: 2017-07-13)

