RIP3介导的坏死性凋亡在C57BL/6小鼠颅脑创伤模型中的作用
于泽奇 衣泰龙 涂悦 杨小飒 江继鹏 董晓煜 张赛 程世翔
·基础研究·
RIP3介导的坏死性凋亡在C57BL/6小鼠颅脑创伤模型中的作用
于泽奇1衣泰龙2涂悦2杨小飒2江继鹏2董晓煜3张赛2程世翔2
目的 探讨受体相互作用蛋白3(RIP3)介导的坏死性凋亡在C57BL/6小鼠颅脑创伤(TBI)模型中的作用及其机制。 方法 采用电子控制性皮质撞击仪(CCI),设定打击参数(速度5 m/s、时间120 ms、深度1 mm),对小鼠顶叶大脑皮质进行精确撞击,建立颅脑创伤模型。将80只雄性C57BL/6小鼠随机分为4组,每组20只:Ctrl组不予处理,Sham组仅开骨窗,TBI组CCI打击后原位注射4 μl的DMSO,GSK’872组CCI打击后原位注射4 μl的 GSK’872。再采用改良型神经功能缺损评分(mNSS)量表评估小鼠颅脑创伤后损伤程度,脑干湿比重法检测颅脑创伤后脑水肿程度,HE染色法检测小鼠脑皮层及海马区损伤程度,以创伤后觉醒时间评价损伤后恢复情况,Western blot法检测RIP3/RIP1/混合连接激酶结构域样蛋白 (MLKL)、Akt/p-Akt/哺乳动物雷帕霉素靶蛋白 (mTOR)/p-mTOR、含半胱氨酸的天冬氨酸蛋白水解酶8(Caspase-8)/X连锁凋亡抑制蛋白(XIAP)、Caspase-1/核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)蛋白表达变化。 结果 与TBI组相比,GSK’872 可明显降低 mNSS 评分 [1 d:(11.95±1.50) vs (13.05±1.82),t=2.084,P<0.05;3 d:(8.95±1.39) vs (11.00±2.10),t=3.634,P<0.01;5 d:(6.75±1.33) vs (8.90±1.52),t=4.759,P<0.01;7 d:(4.00±1.08) vs (7.15±1.09),t=9.200,P<0.01], 同时可明显减轻脑水肿 程度 [(77.91±0.84)%vs(80.34±0.94)%,t=8.692,P<0.01],减轻皮层及海马区损伤程度,并促进创伤后觉醒[(4.08±0.63) h vs(5.11±0.74) h,t=4.717,P<0.01]。 Western blot结果显示, 与 TBI组相比, 应用 GSK’872 后能降低RIP3[(0.70±0.03) vs (1.04±0.04),t=13.051,P<0.01]、RIP1[(0.93±0.02) vs (1.16±0.03),t=11.203,P<0.01]、MLKL[(0.75±0.04) vs (1.03±0.03),t=9.873,P<0.01]、Akt[(0.55±0.04) vs (0.77±0.05),t=6.278,P<0.01]、p-Akt[(0.80±0.04) vs(0.99±0.04),t=6.217,P<0.01]、mTOR[(0.48±0.05) vs (0.90±0.05),t=10.608,P<0.05]、p-mTOR[(0.59±0.06) vs(1.00±0.05),t=9.144,P<0.01]、Caspase-1[(0.80±0.04) vs(0.98±0.05),t=5.226,P<0.01]、NLRP3[(0.51±0.03) vs (0.89±0.03),t=15.590,P<0.01]、XIAP[(0.50±0.03) vs(0.83±0.03),t=13.340,P<0.01] 蛋白表达, 并可促进 Caspase-8 持续升高 [(0.83±0.03) vs(0.71±0.03),t=5.044,P<0.01],差异具有统计学意义。 结论 RIP3介导的坏死性凋亡在小鼠颅脑创伤中起重要作用,应用GSK’872可减轻小鼠颅脑创伤后的损伤程度,提示RIP3有可能成为将来临床上治疗颅脑创伤新的靶点。
受体相互作用蛋白3; 颅脑创伤; 坏死性凋亡
颅脑创伤(traumatic brain injury,TBI)是一种破坏性极强的神经外科常见疾病,是指外源性机械力作用于颅脑导致的非退行性、非先天性的脑损伤[1]。TBI的病理生理过程包括原发性损伤和继发性损伤:前者是由直接外力冲击大脑所致,发生在损伤中心区;后者在损伤中心区周围,在伤后数秒、数分钟,甚至持续数天延迟性发生。继发性损伤加剧了TBI诱导的脑组织损伤、神经细胞死亡、炎症反应及神经功能损害。因此,对其信号靶点和通路进行干预,可有望降低TBI后的损害程度[2]。
坏死性凋亡是近期发现的一种新的细胞死亡形式,参与多种疾病的发展进程,比如细菌感染,胰腺炎,动脉粥样硬化,脑、心肌、肠道炎症等[3-8]。其中受体相互作用蛋白 3(receptor-interacting protein3,RIP3)是细胞坏死的开关分子,在坏死性凋亡途径中发挥重要作用[9]。近年来,研究表明RIP3可不依赖于RIP1而独自引起坏死性凋亡的发生,并诱导混合连接激酶结构域样蛋白(mixed lineage kinase domain-like protein,MLKL)磷酸化,最终导致细胞膜通透性改变,甚至细胞膜破裂[10]。另一方面,GSK’872是RIP3的特异性抑制剂,研究表明GSK’872可有效地抑制坏死性凋亡的发生[11,12]。但坏死性凋亡与颅脑创伤之间的详细机制仍未完全清楚,因此本实验应用电子控制性皮质撞击仪 (controlled coctical impactor,CCI)建立小鼠颅脑创伤模型,以探讨RIP3介导的坏死性凋亡在颅脑创伤中的作用及其机制。
材料与方法
一、实验动物
雄性C57BL/6小鼠80只 (动物合格证号:0002284),购自解放军医学科学院实验动物中心,8~12 周龄,体质量(20±5)g,于温度 20~25 ℃、湿度(60±5)%条件下适应性饲养1周后进行后续实验。将小鼠随机分为4组,每组20只:Ctrl组 (不予处理);Sham 组(仅开骨窗);TBI组[开骨窗,予以 CCI打击,并在原位注射4 μl的二甲基亚砜(dimethyl sulfoxide,DMSO)],GSK’872 组(开骨窗,予以 CCI打击,并在原位注射 4 μl的 GSK’872,浓度为25 mmol/l,用 DMSO 溶解)。
二、仪器与试剂
电子控制性皮质撞击仪(eCCI-6.3,美国Custom Design&Fabrication公司),小鼠立体定向仪(深圳瑞沃德生命科技有限公司),HE染色试剂 (上海博谷生物科技有限公司),化学发光成像系统(AI600,美国GE 公司), 兔抗小鼠 RIP3、RIP1、MLKL、Akt、p-Akt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p-mTOR、X 连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)、含半胱氨酸的天冬氨酸蛋白水解酶1(cysteinyl aspartate specific proteinase,Caspase-1)、核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain receptor protein 3,NLRP3)和 3-磷酸-甘油醛脱氢酶 (glyceraldehyde-3-phosphate dehydrogenase,GAPDH)一抗(美国Abcam公司),羊抗小鼠Caspase-8一抗(美国Santa Cruz Biotechnology公司),辣根过氧化物酶标记羊抗兔免疫球蛋白G(immunoglobulin G,IgG)抗体(美国KPL公司),辣根过氧化物酶标记兔抗羊 IgG 抗体(美国 KPL公司),GSK’872(美国Millipore公司)。
三、建立C57BL/6小鼠颅脑创伤模型
使用5%水合氯醛(0.01 ml/g)腹腔注射麻醉小鼠,置于立体定向仪上,于无菌条件下切开头皮,暴露右顶骨。前囟人字缝尖连线中点偏右2 mm颅钻钻孔,直径3.5 mm,暴露完整硬脑膜后开始打击。设置CCI损伤参数:3 mm打击帽,打击臂与垂直方向角度20°,打击速率为 5 m/s,打击深度为1 mm,打击最低点持续时间为120 ms。CCI致伤后,观察小鼠是否有呼吸异常,若有则给予小动物呼吸机维持通气,若无则直接缝合头皮。
四、小鼠神经功能缺陷评分
由于不清楚实验情况,经过专业培训的老师参照改良的神经功能缺损评分表(modified neurological severity scores,mNSS) 对 CCI损伤后 1、3、5、7 d 小鼠进行功能评定,包括提尾试验、行走测试、感觉试验、平衡木试验、反射缺失和不正常运动[13]。
五、小鼠脑组织含水量测定
在CCI损伤后24 h将小鼠断头处死,开颅取脑,吸干表面水分,将脑组织放在烘烤过的锡纸上称重(即湿重),再置于100℃恒温干燥箱内烘烤24 h至恒重,取出称重(即干重)。按公式计算小鼠脑含水量变化,脑组织含水量=(湿重-干重)/湿重×100%。
六、HE染色
小鼠经CCI损伤后24 h,用5%水合氯醛腹腔注射麻醉,经心脏灌注固定后,取脑组织,切取合适部位约1 cm,用4%多聚甲醛固定24 h以上。经漂洗、脱水、透明、浸泡等步骤处理后,切成5 μm厚的切片。再烤干、脱蜡、浸水等步骤处理后,用苏木素和伊红分别染色。染色结束后,经75%、85%、95%、100%乙醇脱水,二甲苯透明,树胶封片,室温保存。
七、觉醒时间
将CCI损伤后小鼠置于室温下,记录Ctrl组、Sham组、TBI组、GSK’872组小鼠觉醒时间。
八、Western blot
采用BCA法测定蛋白浓度,取各组等量蛋白行10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE),转至硝酸纤维素 (nitrocellulose filter membrane,NC)膜,用含 5%脱脂奶粉的 TBST进行封闭1 h。再分别加入兔抗小鼠RIP3、RIP1、MLKL、Akt、p-Akt、mTOR、p-mTOR、XIAP、Caspase-1、NLRP3一抗(稀释比例均为 1∶1 000),羊抗小鼠 Caspase-8一抗 (稀释比例 1∶1 000),4℃孵育过夜。 转天用TBST洗膜5次,每次5 min,加入辣根过氧化物酶标记的羊抗兔、兔抗羊二抗(稀释比例均为1∶10 000),室温摇床孵育 1 h,再用 TBST洗膜 5次,每次5 min。将ECL发光液覆盖在NC膜上,用GE化学发光成像系统对图像进行采集。内参为GAPDH。使用ScnImage软件进行灰度值分析,以目的蛋白与内参蛋白的条带比值代表目的蛋白的表达水平。
九、统计学分析
采用SPSS16.0软件进行数据统计,实验数据采用均数±标准差(x±s)表示,组间比较行非配对样本t检验,以P<0.05为差异具有统计学意义。
结 果
一、小鼠神经功能缺陷情况
Ctrl组与Sham组基本完全正常;TBI损伤后小鼠行走异常,平衡功能、感觉功能异常,mNSS评分明显升高。GSK’872组较TBI组mNSS评分明显降低,差异具有统计学意义(1 d:t=2.084,P<0.05;3 d:t=3.634,P<0.01;5 d:t=4.759,P<0.01;7 d:t=9.200,P<0.01),且随着时间的延长,效果逐渐明显(图 1)。
二、小鼠脑组织含水量测定
Ctrl组脑含水量为 (76.27±1.09)%,Sham 组为(76.07±1.37)%,组间差异无统计学意义(t=0.502,P>0.05);与Sham组相比,TBI组脑含水量显著上升[(80.34±0.94)%vs(76.07±1.37)%,t=11.370,P<0.01],而应用GSK’872后,脑含水量与TBI组相比显著下降[(77.91±0.84)%vs(80.34±0.94)%,t=8.692,P<0.01],差异具有统计学意义(图2)。

图1 小鼠神经功能缺陷情况

图2 小鼠脑组织含水量比较
三、HE染色检查脑组织损伤程度
Ctrl组和Sham组皮层及海马区结构正常,神经细胞形态规则,胞质丰富,未见损伤灶;而CCI损伤后,TBI组皮层和海马区可见不同程度损伤,红细胞聚集、脑组织结构松散、胞体明显缩小变形、胞核模糊不清晰、神经元细胞空泡化等。而与TBI组相比,应用GSK’872后,神经细胞核固缩及空泡化程度有所减轻,红细胞数目也有所下降,表明应用RIP3特异性抑制剂GSK’872对于小鼠颅脑创伤后具有良好的神经保护作用(图3)。
四、小鼠觉醒时间
Ctrl组小鼠觉醒时间为(2.99±0.63) h,Sham 组为(3.04±0.64) h,组间差异无统计学意义(t=0.252,P>0.05);与Sham组相比,TBI后小鼠觉醒时间显著增长[(5.11±0.74) h vs (3.04±0.64) h,t=9.534,P<0.01],而应用GSK’872后,小鼠觉醒时间与TBI组相比明显缩短[(4.08±0.63) h vs (5.11±0.74) h,t=4.717,P<0.01],差异具有统计学意义(图4)。研究结果表明,颅脑创伤后应用RIP3特异性抑制剂GSK’872能够有效促进觉醒。
五、Western blot结果
与Sham组相比,CCI损伤后 6 h的 TBI组RIP3、RIP1、MLKL 表达显著升高[RIP3:(1.04±0.04)vs(0.60±0.02),t=18.660,P<0.01;RIP1:(1.16±0.03)vs (0.68±0.05),t=15.002,P<0.01;MLKL:(1.03±0.03)vs (0.40±0.03),t=25.864,P<0.01],差异具有统计学意义。而应用 GSK’872 后,与 TBI相比,RIP3、RIP1、MLKL表达量均有所下降,分别为 [RIP3:(0.70±0.03) vs (1.04±0.04),t=13.051,P<0.01;RIP1:(0.93±0.02) vs (1.16±0.03),t=11.203,P<0.01;MLKL:(0.75±0.04) vs (1.03±0.03),t=9.873,P<0.01],差异具有统计学意义(图5)。
与Sham组相比,CCI损伤后6 h的TBI组Akt、p-Akt、mTOR、p-mTOR 表达显著升高 [Akt:(0.77±0.05) vs(0.53±0.05),t=6.065,P<0.01;p-Akt:(0.99±0.04)vs (0.40±0.05),t=17.401,P<0.01;mTOR:(0.90±0.05)vs (0.45 ±0.04),t=12.902,P <0.01;p-mTOR:(1.00 ±0.05)vs (0.75±0.05),t=6.232,P<0.01],差异具有统计学意义。而应用GSK’872后,与 TBI相比,Akt、p-Akt、mTOR、p-mTOR表达量均有所下降,分别为[Akt:(0.55±0.04) vs (0.77±0.05),t=6.278,P<0.01;p-Akt:(0.80±0.04) vs(0.99±0.04),t=6.217,P<0.01;mTOR:(0.48±0.05) vs (0.90±0.05),t=10.608,P<0.05;p-mTOR:(0.59±0.06) vs (1.00±0.05),t=9.144,P<0.01],差异具有统计学意义(图6)。

图3 小鼠脑组织HE染色(×400)

图4 小鼠CCI损伤后觉醒时间比较
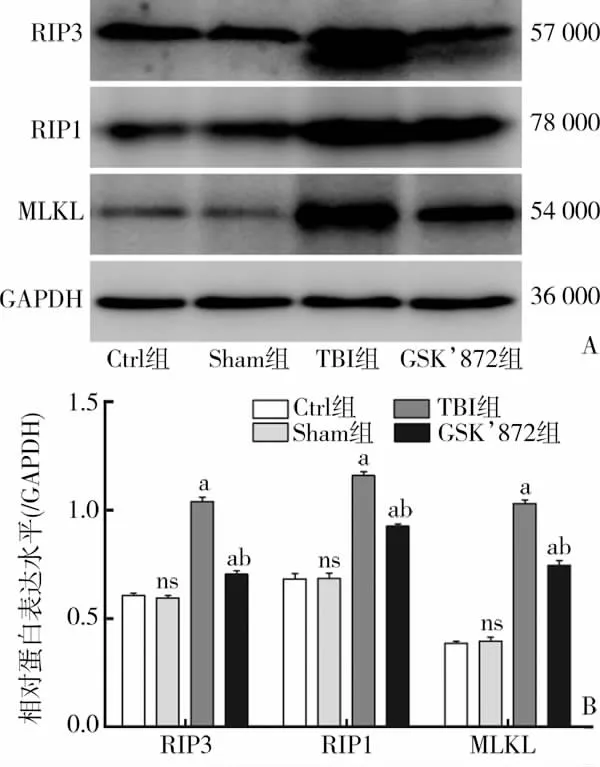
图5 受体相互作用蛋白3、受体相互作用蛋白1、混合连接激酶结构域样蛋白表达变化
与Sham组相比,CCI损伤后 6 h的TBI组Caspase-8 表达显著升高[(0.71±0.03) vs (0.46±0.03),t=9.989,P<0.01],XIAP 表达显著下降 [(0.83±0.03)vs (0.97±0.03),t=5.831,P<0.01],差异具有统计学意义。而应用GSK’872后,与TBI组相比,Sham组的Caspase-8 表达持续升高[(0.83±0.03) vs (0.71±0.03),t=5.044,P<0.01],XIAP 表达持续下降 [(0.50±0.03) vs(0.83±0.03),t=13.340,P<0.01],差异具有统计学意义(图 7)。
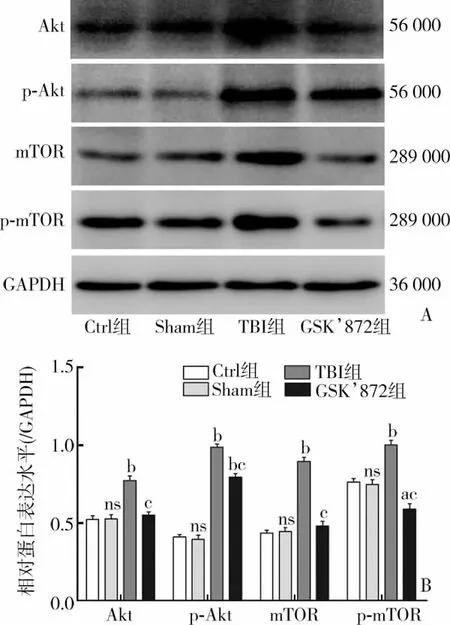
图 6 Akt、p-Akt、mTOR、p-mTOR 蛋白表达变化
与Sham组相比,CCI损伤后 6 h的 TBI组Caspase-1、NLRP3 表达显著升高 [Caspase-1:(0.98±0.05) vs (0.70±0.05),t=7.186,P<0.01;NLRP3:(0.89±0.03) vs (0.43±0.03),t=18.28,P<0.01],差异具有统计学意义。而应用GSK’872后,与 TBI相比,Caspase-1、NLRP3表达量均有所下降,分别为[Caspase-1:(0.80±0.04) vs (0.98±0.05),t=5.226,P<0.01;NLRP3:(0.51±0.03) vs (0.89±0.03),t=15.590,P<0.01],差异具有统计学意义(图 8)。
讨 论
颅脑创伤通过原发性损伤和继发性损伤导致脑组织结构破坏及功能障碍。目前人们普遍认为,坏死性凋亡在其中起到重要作用[14]。RIP3是调控坏死性凋亡的关键分子,而MLKL更是导致细胞膜破裂的重要执行者[15,16]。另外,RIP3和RIP1可形成坏死小体,并通过一系列坏死过程导致细胞死亡[17]。此外,RIP3特异性抑制剂GSK’872能够在某些情况下对神经细胞起到保护性作用[18,19]。因此,笔者在小鼠颅脑创伤模型中应用RIP3特异性抑制剂GSK’872,结果显示,GSK’872能够有效降低RIP3/RIP1/MLKL信号表达,降低小鼠CCI损伤后的脑组织损伤程度,促进创伤后觉醒,减轻水肿程度等,这表明RIP3特异性抑制剂GSK’872能够在一定程度上逆转损伤导致的神经元坏死,这为临床上治疗颅脑创伤提供了宝贵依据。

图7 Caspase-8、XIAP蛋白表达变化

图8 Caspase-1、NLRP3蛋白表达变化
Akt一直被认为是神经系统中调控神经元存活的关键分子,mTOR是Akt的下游分子,在许多神经系统疾病中介导细胞应激反应[20,21]。有研究指出,应用Akt和mTOR的特异性抑制剂能够减少小鼠CCI模型中的细胞死亡,表明Akt/mTOR可能参与颅脑创伤后细胞坏死性凋亡途径中[22-23]。本研究发现颅脑创伤能够诱导Akt和mTOR的磷酸化,并进一步导致坏死性凋亡的发生,而此过程可被RIP3特异性抑制剂GSK’872抑制,表明RIP3参与到Akt/mTOR信号途径中,并可对其进行调控。
Caspase-8在调节细胞内环境稳态以及保护免受肿瘤坏死因子(tumor necrosis factor,TNF)诱导的细胞坏死过程中起重要作用[24]。研究表明,Caspase-8可通过蛋白酶剪切RIP1,并抑制RIP1对于TNF诱导核转录因子kappa B途径的激活,从而启动细胞凋亡途径[25]。而Caspase-8的缺乏或抑制又可诱导炎症反应以及坏死性凋亡的发生[26]。但Caspase-8是否在凋亡或坏死性凋亡途径中起到重要作用目前还是有争议的。本研究表明,在颅脑创伤发生时,Caspase-8表达上调,而XIAP表达减少。然而应用RIP3特异性抑制剂 GSK’872不仅抑制了 RIP1/RIP3/MLKL介导的坏死性凋亡,同时明显地上调了Caspase-8介导的凋亡途径,这表明应用RIP3特异性抑制剂GSK’872可以阻断颅脑后坏死性凋亡的发生,并部分扭转到凋亡途径,与以往的研究不同,导致这种现象发生的原因可能是,在以往研究中坏死性凋亡可能被完全抑制,或者实验模型并不是模拟自然的颅脑创伤过程[27]。
众所周知,炎症反应常常导致细胞死亡,而近年的研究表明,在许多炎症疾病中都有坏死性凋亡途径的发生[28-30]。RIP3可特异性激活NLRP3,并进一步促进Caspase-1的活化,从而形成炎性体,并最终促进促炎因子白细胞介素1β的分泌,导致炎症反应的发生[31]。在本研究中,CCI损伤导致NLRP3和Caspase-1显著升高,而应用RIP3特异性抑制剂GSK’872后,Caspase-1显著降低,而NlLRP3相对于Ctrl组及Sham组而言仍然偏高。这些研究结果揭示,通过调控RIP3介导的坏死性凋亡可调节脑损伤后的炎症反应。
综上所述,RIP3介导的坏死性凋亡在小鼠颅脑创伤模型中起重要作用,而应用RIP3特异性抑制剂GSK’872,可通过调控 RIP3/RIP1/MLKL复合体,Akt/mTOR信号途径有效阻断坏死性凋亡,并部分扭转成凋亡途径。由此表明通过控制或抑制颅脑创伤早期的坏死性凋亡可有效减轻神经细胞损伤程度以及随后的炎症反应。但颅脑创伤后凋亡、坏死性凋亡以及炎症之间关系究竟如何,还有待进一步研究,这将为临床上治疗颅脑创伤提供新的理论依据和目标靶点。
[1] Mckee AC,Daneshvar DH.The neuropathology of traumatic brain injury[J].Handb Clin Neurol,2015,127:45-66.
[2] Mazzeo AT,Filippini C,Rosato R,et al.Multivariate projection method to investigate inflammation associated with secondary insults and outcome after human traumatic brain injury:a pilot study[J].J Neuroinflammation,2016,13(1):157.
[3] Bleriot C,Lecuit M.The interplay between regulated necrosis and bacterial infection[J].Cell Mol Life Sci,2016,73(11-12):2369-2378.
[4] Takemoto K,Hatano E,Iwaisako K,et al.Necrostatin-1 protects against reactive oxygen species(ROS)-induced hepatotoxicity in acetaminophen-induced acute liver failure[J].FEBS Open Bio,2014,4:777-787.
[5] Karunakaran D,Geoffrion M,Wei L,et al.Targeting macrophage necroptosisfortherapeutic and diagnostic interventions in atherosclerosis[J].Sci Adv,2016,2(7):e1600224.
[6] Xu Y,Wang J,Song X,et al.RIP3 induces ischemic neuronal DNA degradation and programmed necrosis in rat via AIF[J].Sci Rep,2016,6:29362.
[7] Kitur K,Wachtel S,Brown A,et al.Necroptosis promotes staphylococcus aureus clearance by inhibiting excessive inflammatory signaling[J].Cell Rep,2016,16(8):2219-2230.
[8] Bozec D,Iuga AC,Roda G,et al.Critical function of the necroptosis adaptor RIPK3 in protecting from intestinal tumorigenesis[J].Oncotarget,2016,7(29):46384-46400.
[9] Zhang DW,Shao J,Lin J,et al.RIP3,an energy metabolism regulator that switches TNF-induced cell death from apoptosis to necrosis[J].Science,2009,325(5938):332-336.
[10] Su Z,Yang Z,Xie L,et al.Cancer therapy in the necroptosis era[J].Cell Death Differ,2016,23(5):748-756.
[11] Das A,McDonald DG,Dixon-Mah YN,et al.RIP1 and RIP3 complex regulates radiation-induced programmed necrosis in glioblastoma[J].Tumour Biol,2016,37(6):7525-7534.
[12] Gerges S,Rohde K,Fulda S.Cotreatment with Smac mimetics and demethylating agents induces both apoptotic and necroptotic cell death pathways in acute lymphoblastic leukemia cells[J].Cancer Lett,2016,375(1):127-132.
[13] Zaidi HA,Zabramski JM,Safavi-Abbasi S,et al.Spontaneous intracerebral hemorrhage[J].World Neurosurg,2015,84(5):1191-1192.
[14] Liu T,Bao YH,Wang Y,et al.The role of necroptosis in neurosurgical diseases[J].Braz J Med Biol Res,2015,48(4):292-298.
[15] Degterev A,Hitomi J,Germscheid M,et al.Identification of RIP1 kinase as a specific cellular target of necrostatins[J].Nat Chem Biol,2008,4(5):313-321.
[16] Sun L,Wang H,Wang Z,et al.Mixed lineage kinase domain-like protein mediates necrosis signaling downstream of RIP3 kinase[J].Cell,2012,148(1-2):213-227.
[17] Galluzzi L,Kepp O,Kroemer G.MLKL regulates necrotic plasma membrane permeabilization[J].Cell Res,2014,24(2):139-140.
[18] He S,Wang L,Miao L,et al.Receptor interacting protein kinase-3 determines cellular necrotic response to TNF-alpha[J].Cell,2009,137(6):1100-1111.
[19] Liu T,ZhaoDX,CuiH,etal.Therapeutichypothermia attenuates tissue damage and cytokine expression after traumatic brain injury by inhibiting necroptosis in the rat[J].Sci Rep,2016,6:24547.
[20] Noshita N,Lewén A,Sugawara T,et al.Akt phosphorylation and neuronalsurvivalaftertraumaticbrain injuryin mice[J].Neurobiol Dis,2002,9(3):294-304.
[21] Crino PB.The mTOR signalling cascade:paving new roads to cure neurological disease[J].Nat Rev Neurol,2016,12(7):379-392.
[22] Park J,Zhang J,Qiu J,et al.Combination therapy targeting Akt and mammalian target of rapamycin improves functional outcome after controlled cortical impact in mice[J].J Cereb Blood Flow Metab,2012,32(2):330-340.
[23] Liu Q,Qiu J,Liang M,et al.Akt and mTOR mediate programmed necrosis in neurons[J].Cell Death Dis,2014,5:e1084.
[24] Günther C,Martini E,Wittkopf N,et al.Caspase-8 regulates TNF-α-induced epithelial necroptosis and terminal ileitis[J].Nature,2011,477(7364):335-339.
[25] Kim JW,Choi EJ,Joe CO.Activation of death-inducing signaling complex (DISC)by pro-apoptotic C-terminal fragment of RIP[J].Oncogene,2000,19(39):4491-4499.
[26] Challa S,Chan FK.Going up in flames:necrotic cell injury and inflammatory diseases[J].Cell Mol Life Sci,2010,67(19):3241-3253.
[27] Kaiser WJ,Sridharan H,Huang C,et al.Toll-like receptor 3-mediated necrosis via TRIF,RIP3,and MLKL[J].J Biol Chem,2013,288(43):31268-31279.
[28] Wallach D,Kang TB,Dillon CP,et al.Programmed necrosis in inflammation:Toward identification of the effector molecules[J].Science,2016,352(6281):aaf2154.
[29] Newton K,Manning G.Necroptosis and inflammation[J].Annu Rev Biochem,2016,85:743-763.
[30] Pasparakis M,Vandenabeele P.Necroptosis and its role in inflammation[J].Nature,2015,517(7534):311-320.
[31] Menu P,Vince JE.The NLRP3 inflammasome in health and disease:the good,the bad and the ugly[J].Clin Exp Immunol,2011,166(1):1-15.
2017-05-08)
(本文编辑:张丽)
于泽奇,衣泰龙,涂悦,等.RIP3介导的坏死性凋亡在C57BL/6小鼠颅脑创伤模型中的作用[J/CD].中华神经创伤外科电子杂志,2017,3(5):277-283.
Effects of necroptosis induced by receptor interacting-protein 3 in traumatic brain injury model of C57/BL mice
Yu Zeqi1,Yi Tailong2,Tu Yue2,Yang Xiaosa2,Jiang Jipeng2,Dong Xiaoyu3,Zhang Sai2,Cheng Shixiang2.1First Department of Surgery,the Chengdu Hospital of Sichuan Armed Police Corps,Chengdu 610041,China;2Neurology and Neurosurgery Hospital,Affiliated Hospital of Logistics College of Chinese People’s Armed Police Force,Tianjin 300162,China;3Medical Unit of Three Department of Beijing Armed Police Corps,Beijing 100621,China
Corresponding author:Cheng Shixiang,Email:shixiangcheng@vip.126.com
ObjectiveTo investigate the effects of necroptosis induced by receptor interacting- protein 3(RIP3)on traumatic brain injury(TBI)model of C57BL/6 mice and its mechanisms.MethodsC57BL/6 mice were positioned beneath the controlled cortical impactor device(CCI)and subjected to impact injury at 1 mm depth of penetration,for a sustained depression of 120 msec and a velocity of 5 m/s.Ctrl group was not treated.Sham group was
craniotomy,without CCI injury.TBI group was received CCI injury and 4 μl DMSO injected.GSK’872 group was received CCI injury and 4 μl GSK’872 injected.Then,the degree of injury was detected by modified neurological severity scores(mNSS),the degree of brain edema was measured with drying wet method,the injure degree of cortex and hippocampus was assessed by HE staining,the recovery after CCI was measured by awakening time and the expressions of RIP3/RIP1/MLKL,Akt/p-Akt/mTOR/p-mTOR,Caspase-8/XIAP,Caspase-1/NLRP3 were detected by Western blot assay.ResultsCompared with TBI group,GSK’872 could significantly decrease the score of mNSS[1 d:(11.95±1.50)vs(13.05±1.82),t=2.084,P<0.05;3 d:(8.95±1.39)vs(11.00±2.10),t=3.634,P<0.01:5 d:(6.75±1.33)vs(8.90±1.52),t=4.759,P<0.01;7 d:(4.00±1.08)vs(7.15±1.09),t=9.200,P<0.01],decrease the degree of brain edema[(77.91±0.84)%vs(80.34±0.94)%,t=8.692,P<0.01],reduce the degree of injury in cortex and hippocampus,and promote the awaking of mice after CCI[(4.08±0.63)h vs (5.11±0.74)h,t=4.717,P<0.01].Furthermore,Western blotting assay reveled that GSK’872 could significantly decrease the levels of RIP3[(0.70±0.03)vs(1.04±0.04),t=13.051,P<0.01],RIP1[(0.93±0.02)vs(1.16±0.03),t=11.203,P<0.01],MLKL[(0.75±0.04)vs(1.03±0.03),t=9.873,P<0.01],Akt[(0.55±0.04)vs(0.77±0.05),t=6.278,P<0.01],p-Akt[(0.80±0.04)vs(0.99±0.04),t=6.217,P<0.01],mTOR[(0.48±0.05)vs(0.90±0.05),t=10.608,P<0.05],p-mTOR[(0.59±0.06)vs(1.00±0.05),t=9.144,P<0.01],Caspase-1[(0.80±0.04)vs(0.98±0.05),t=5.226,P<0.01],NLRP3[(0.51±0.03)vs(0.89±0.03),t=15.590,P<0.01],XIAP[(0.50±0.03)vs(0.83±0.03),t=13.340,P<0.01],but increase the level of Caspase-8 compared with TBI group[(0.83±0.03)vs(0.71±0.03),t=5.044,P<0.01].ConclusionNecroptosis induced by RIP3 may play an important role in TBI,however,GSK’872 could reduce the degree of injury after TBI,which reveals that RIP3 may be a new target for clinical treatment of TBI in the future.
Receptor-interacting protein3;Traumatic brain injury;Necroptosis
10.3877/cma.j.issn.2095-9141.2017.05.006
国家自然科学基金项目(31200809);武警部队后勤科研项目(WJHQ2012-20);军队技术产品研究重大项目(AWS15J001);天津市科技计划项目(15ZXLCSY00040)
610041成都,武警四川总队成都医院外一科1;300162天津,武警后勤学院附属医院脑科医院2;100621北京,北京武警总队三支队卫生队3
程世翔,Email:shixiangcheng@vip.126.com

