猴头菇醇提物及其不同极性部位的 体外抗氧化活性
,,,惠华,*
(1.华南理工大学食品科学与工程学院,广东广州 510640; 2.广东太阳神集团有限公司,广东广州 510665)
猴头菇醇提物及其不同极性部位的 体外抗氧化活性
黄越1,周春晖2,戴宏杰1,黄惠华1,*
(1.华南理工大学食品科学与工程学院,广东广州 510640; 2.广东太阳神集团有限公司,广东广州 510665)
以猴头菇为原材料,探究猴头菇醇提物及其不同极性萃取相的体外抗氧化活性。采用不同极性有机溶剂萃取猴头菇醇提物得到石油醚相、乙酸乙酯相、正丁醇相和水相4个不同极性部位萃取物。分别测定各极性部位总酚和总黄酮含量,并比较猴头菇醇提物及其各极性部位的体外抗氧化活性。结果表明:乙酸乙酯相的总酚和总黄酮含量最高,分别为16.52 mg/g和10.08 mg/g。猴头菇醇提物及其不同极性部位萃取物均具有一定的抗氧化活性,其中乙酸乙酯相的抗氧化活性相对较高,对DPPH·、·OH和ABTS+·的清除率分别可达到41.64%(2.5 mg/mL)、82.84%(2.5 mg/mL)和89.18%(0.5 mg/mL)。由此可见,猴头菇醇提物的乙酸乙酯相萃取组分具有较好的抗氧化活性,可作为主要活性部位进行后续单体分离研究。
猴头菇,醇提物,极性部位,抗氧化活性
猴头菇(Hericiumerinaceus)属担子菌纲、多孔菌目、齿菌科、猴头属,又名猴头、猴头菌、猴头蘑、刺猬菌等,是我国著名的食药兼用菌,其营养丰富,味道鲜美,素有“山珍猴头,海味燕窝”之称[1]。猴头菇中含有多糖、低聚糖、多肽、猴头菌素、猴头菌酮、甾醇类、脂肪酸和腺苷等多种活性物质,具有抗氧化[2]、降血糖[3]、降血脂[4]、抑菌[5]、抗肿瘤[6]、增强机体免疫力[7]等多种生物活性。
目前关于猴头菇功效成分的研究仍以多糖为主,对其它小分子物质如多酚、黄酮的研究还远远不足。本课题组曾对猴头菇多糖的抗氧化活性进行了相关研究,得到的水提猴头菇粗多糖对DPPH·、·OH和ABTS+·的清除率分别可达到47.91%(5.0 mg/mL)、54.30%(5.0 mg/mL)和87.30%(0.5 mg/mL),说明猴头菇资源具有良好的抗氧化活性潜力[8]。而在提取猴头菇多糖时,通常会采用乙醇溶液浸泡一段时间进行预处理(主要目的为脱脂),浸泡后的残渣再进行多糖提取,而乙醇浸泡液(醇提物)往往疏于研究和利用,造成了资源浪费,而相关研究表明,天然产物的乙醇提取物大都具有良好的生物活性[9-10]。Liu等[1]通过HPD-100大孔树脂将猴头菇子实体醇提物进行富集浓缩,再将提取物用石油醚和氯仿萃取,硅胶柱层析分离后得到两种化合物,均具有显著的抗幽门螺杆菌活性。杜秀菊等[11]采用系统溶剂法分离桦褐孔菌菌核的乙醇提取物,分别得到石油醚相、氯仿相、乙酸乙酯相和乙醇相等4个不同极性部位,均表现出良好的抗氧化活性。其中乙醇相在其浓度为500 μg/mL时,对DPPH·和·OH的清除率可分别达到83.13%和52.44%。
本文以猴头菇子实体为原料,采用低浓度乙醇溶液(50%)浸提得到猴头菇醇提物,依次采用不同极性强度的有机溶剂(石油醚、乙酸乙酯、正丁醇)进行梯度萃取,得到不同极性萃取组分和剩余水相组分。以还原能力和清除DPPH·、·OH、ABTS+·的能力为指标,筛选出具有较高抗氧化活性组分,为后续分离单体化合物提供依据,丰富和提高了猴头菇在食品、医药和保健领域的利用途径和价值。
1 材料与方法
1.1材料与仪器
猴头菇子实体 产自吉林省长白山二道白河;1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picryhydrazyl,DPPH)、2,2′-氨基-双(3-乙基苯并噻唑胶-6-磺酸)(2,2′-azino-bis(3-ethylbmzothiazoline-6-sulfonic acid),ABTS)、福林酚(Folin-Ciocalteu)试剂、芦丁、邻二氮菲、抗坏血酸(VC) 均购自美国Sigma公司;没食子酸、硝酸铝、铁氰化钾、三氯乙酸、三氯化铁、石油醚、乙酸乙酯、正丁醇等 均为分析纯。
HK-08B型流水式中药粉碎机 广州市旭朗机械设备有限公司;TDL-5-A型低速台式离心机 上海安亭科学仪器厂;UV-1800型紫外分光光度计 日本岛津公司;RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;LGJ-10型冷冻干燥机 北京松源华兴科技发展有限公司。
1.2猴头菇醇提物及其不同极性部位样品的制备
[9]的方法并稍作改动,按图1所述流程图制备猴头菇醇提物及其不同极性萃取组分和剩余水相组分样品。具体制备方法如下:
选取新鲜的猴头菇子实体为原料,切分成小块后于50 ℃条件下干燥16 h,然后用中药粉碎机进行粉碎,80目筛分,得猴头菇干粉,继续在50 ℃下干燥至恒重后备用。称取一定量的猴头菇干粉,按照料液比1∶15 g/mL与50%乙醇溶液进行混合,50 ℃水浴环境下提取5 h,所得提取液于3000 r/min离心10 min,收集上清液,剩余残渣再按上述条件提取1次,合并2次上清液,45 ℃下旋蒸浓缩得乙醇提取浸膏,取部分浸膏冷冻干燥,得到猴头菇乙醇提取物。将剩余醇提浸膏与一定量的蒸馏水混合,得到水悬浮液,按1∶1体积比依次加入石油醚、乙酸乙酯、正丁醇进行萃取,每相萃取3次,得到石油醚相、乙酸乙酯相、正丁醇相以及剩余部分水相萃取液。收集各相萃取液旋转蒸发除去溶剂,冷冻干燥后得到猴头菇醇提物的不同极性部位萃取物:石油醚相、乙酸乙酯相、正丁醇相和水相,置于-20 ℃下储存备用。

图1 猴头菇醇提物及其不同极性部位制备流程图Fig.1 The preparation flow chart of ethanol extract and its different polar fractions from Hericium erinaceus
1.3总酚和总黄酮含量的测定
总酚含量的测定参考赵晓娟等[12]的方法,以没食子酸为标准品,采用Folin-Ciocalteu法进行测定。精密称取没食子酸标准品10 mg,蒸馏水溶解定容至100 mL。分别吸取没食子酸标准品溶液0、0.25、0.50、0.75、1.00、1.25、1.50 mL于25 mL比色管中,依次加入5 mL蒸馏水和2.5 mL福林酚试剂,混匀静置30 s后加入4 mL 12% Na2CO3溶液,蒸馏水定容至25 mL,45 ℃下避光反应1.5 h,将反应溶液于756 nm波长处测定吸光度。以没食子酸标准品质量浓度C(μg/mL)为横坐标,吸光值A为纵坐标,绘制总酚含量测定的标准曲线。
总黄酮含量的测定参考林建原等[13]的方法。以芦丁为标准品,采用亚硝酸钠-硝酸铝-氢氧化钠比色法进行测定。精密称取芦丁标准品50 mg,50%乙醇溶解后定容至100 mL。分别吸取芦丁标准品溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL于10 mL比色管中,加入5% NaNO2溶液0.3 mL,混匀后静置6 min,然后加入10% Al(NO3)3溶液0.3 mL,混匀静置6 min,再分别加入4% NaOH溶液4.0 mL,补充50%乙醇溶液至10 mL,混匀后继续静置15 min,将反应溶液于510 nm波长处测定吸光度。以芦丁标准品质量浓度C(μg/mL)为横坐标,吸光值A为纵坐标,绘制总黄酮含量测定的标准曲线。
1.4猴头菇醇提物及其不同极性部位体外抗氧化活性测定
1.4.1 DPPH·清除能力测定 参考Hua等[14]的方法并稍作修改。取1.0 mL不同质量浓度(0.5、1.0、1.5、2.0、2.5 mg/mL)的样品溶液,加入无水乙醇配制的0.1 mmoL/L DPPH溶液3.0 mL,振荡混匀后于室温避光条件下反应30 min,517 nm波长处测定吸光度。以VC作为阳性对照,按式(1)计算DPPH·清除率:
式(1)
式中:Ax为加入1.0 mL样品溶液和3.0 mL DPPH溶液后的吸光度;Ax0为1.0 mL样品溶液和3.0 mL无水乙醇的吸光度;A0为1.0 mL蒸馏水和3.0 mL DPPH溶液的吸光度。
1.4.2 ·OH清除能力测定 参考Mao等[15]的方法并稍作修改。取1.0 mL不同质量浓度(0.5、1.0、1.5、2.0、2.5 mg/mL)的样品溶液,加入0.75 mmol/L邻二氮菲溶液1.0 mL和0.15 mol/L磷酸盐缓冲液(pH7.4)2.0 mL混合均匀,继续加入0.75 mmol/L FeSO4溶液1.0 mL,最后加入0.01% H2O2溶液1.0 mL并振荡混匀,37 ℃水浴反应1.0 h,反应溶液于536 nm波长处测定吸光度。以VC作为阳性对照,按式(2)计算·OH清除率:
式(2)
式中:A1为加入样品及H2O2时测得的吸光度;A0为以蒸馏水代替样品时测得的吸光度;A2为以蒸馏水代替样品及H2O2时测得的吸光度。
1.4.3 ABTS+·清除能力测定 参考Li等[16]的方法并稍作修改。将7 mmol/L ABTS+·溶液与2.45 mmol/L过硫酸钾溶液等量混合反应,在室温、避光条件下静置12~16 h得到ABTS+·储备液。使用时采用磷酸盐缓冲液(10 mmol/L,pH7.4)稀释ABTS+·储备液,至其在734 nm波长处的吸光度达到0.70±0.02,得到ABTS+·测定液。取1.0 mL不同质量浓度(0.1、0.2、0.3、0.4、0.5 mg/mL)的样品溶液与2.0 mL ABTS+·测定液混合均匀,室温避光放置6 min后测定其在734 nm波长处的吸光度。以VC作为阳性对照,按式(3)计算ABTS+·清除率:

式(3)
式中:Ai为加入样品溶液和ABTS+·测定液后的吸光度;Aj为样品溶液与磷酸盐缓冲液的吸光度;A0为蒸馏水与ABTS+·测定液的吸光度。
1.4.4 还原力测定 参考Liu等[17]的方法并稍作修改。取2.0 mL不同质量浓度(0.5、1.0、1.5、2.0、2.5 mg/mL)的样品溶液,加入0.2 mol/L磷酸盐缓冲液(pH6.6)2.0 mL和1%铁氰化钾溶液2.0 mL混合均匀,于50 ℃水浴保温20 min,加入10%三氯乙酸溶液2.0 mL,振荡混匀后离心(3000 r/min,5 min),然后取2.0 mL离心后上清液,与2.0 mL蒸馏水、0.4 mL 0.1% FeCl3溶液混合均匀,置于50 ℃水浴10 min后于700 nm波长处测定吸光度。空白对照以蒸馏水代替样品溶液,以VC作为阳性对照。
1.5数据处理
2 结果与分析
2.1总酚和总黄酮含量测定标准曲线
采用Folin-Ciocalteu法测定的没食子酸标准曲线方程为:Y=0.1277X+0.0377,回归系数R2=0.9923,线性关系良好。其中X为测试溶液中的没食子酸含量(μg/mL),Y为反应溶液在756 nm波长处的吸光值。采用亚硝酸钠-硝酸铝-氢氧化钠比色法测定的芦丁标准曲线方程为:Y=0.0127X+0.0135,回归系数R2=0.9990,线性关系良好。其中X为测试溶液中的芦丁含量(μg/mL),Y为反应溶液在510 nm波长处的吸光值。
2.2猴头菇醇提物及其不同极性部位得率、总酚及总黄酮含量

表1 猴头菇醇提物及其不同极性部位得率、 总酚及总黄酮含量Table 1 The yield and the contents of total phenols and flavonoids of ethanol extract and its different polar fractions from Hericium erinaceus(±SD,n=3)
注:同列标记字母不同,表示差异显著,p<0.05。醇提物得率(%)=(醇提物干重/原料干重)×100;各极性部位得率(%)=(各极性部位干重/醇提物干重)×100。
多酚和黄酮类物质在自然界分布广泛,且大多具有非常强的抗氧化活性[18]。由于不同种类的多酚和黄酮类物质的溶解性质不同,采用不同的有机溶剂萃取得到的萃取物中所含多酚与黄酮的种类和数量也会有所差异[19]。猴头菇醇提物及其不同极性部位得率、总酚及总黄酮含量测定结果见表1。其中,猴头菇醇提物得率为41.35%。采用不同极性溶剂萃取后得到的石油醚相、乙酸乙酯相、正丁醇相和剩余水相组分的得率分别为3.23%、2.55%、7.99%和42.25%。猴头菇醇提物及其不同极性萃取相均含有一定量的多酚和黄酮,其中总酚含量从高到低依次为:乙酸乙酯相>正丁醇相>石油醚相>醇提物>水相,这与吴峰华等[10]对覆盆子醇提物及其不同极性部位的总酚含量研究一致。总黄酮含量从高到低依次为:乙酸乙酯相>醇提物>石油醚相>水相>正丁醇相。由此可知,乙酸乙酯相中总酚与总黄酮含量均高于醇提物及其他萃取相,这与国旭丹等[20]对苦荞麸乙醇粗提物及其各极性部位的总酚与总黄酮含量测定结果一致。综上说明,猴头菇醇提物乙酸乙酯萃取相和其它萃取相相比含有较高含量的黄酮和多酚类物质,含量分别达到16.52 mg/g和10.08 mg/g,推测其可能具有更高的抗氧化活性。
2.3猴头菇醇提物及其不同极性部位萃取相的体外抗氧化活性
2.3.1 DPPH·清除能力 由图2可知,猴头菇醇提物及其不同极性部位萃取组分均表现出一定的DPPH·清除能力。在质量浓度0.5~2.5 mg/mL范围内,所有样品对DPPH·的清除能力均随样品浓度的升高而逐渐增大,呈现明显的剂量依赖性。猴头菇醇提物及其不同极性萃取相对DPPH·的清除率大小依次为:乙酸乙酯相>正丁醇相>水相>醇提物>石油醚相,其中乙酸乙酯相对DPPH·的清除率明显高于其他萃取相,正丁醇相对DPPH·的清除效果与水相相当,但均高于石油醚相,这与徐海燕等[21]对新疆紫草不同极性萃取部位对DPPH·清除能力的研究结果一致。当样品浓度为2.5 mg/mL时,猴头菇醇提物、石油醚相、乙酸乙酯相、正丁醇相和水相对DPPH·的清除率分别达到21.96%、21.88%、41.64%、33.37%和32.74%,萃取组分中乙酸乙酯相对DPPH·的清除效果最佳,这可能与其含有更高含量的多酚和黄酮类物质有关。而猴头菇水提粗多糖在浓度3.0 mg/mL时对DPPH·的清除率为40.5%,低于乙酸乙酯相萃取组分[8],说明猴头菇醇提物及其萃取物的利用具有一定价值。吴峰华等[10]对覆盆子醇提物及其不同极性部位中的总酚和黄酮含量与抗氧化能力间的相关性进行研究,结果表明总酚含量与抗氧化活性呈正相关性。栗铭鸿等[22]对元蘑醇提物不同极性部位清除自由基活性进行研究,当样品浓度为5 mg/mL时,元蘑醇提物的乙酸乙酯萃取部位对DPPH·清除率仅为30%。
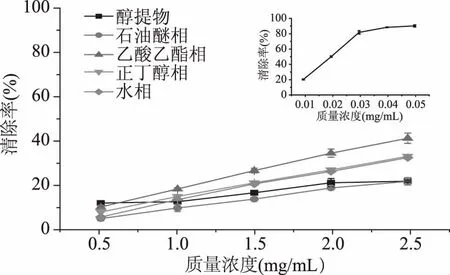
图2 猴头菇醇提物及其不同极性萃取相对DPPH·的清除率Fig.2 Scavenging rate of ethanol extract and its different polar fractions from Hericium erinaceus on DPPH·注:图中各个小图是VC的清除率;图3~图5同。
2.3.2 ·OH清除能力 由图3可知,猴头菇醇提物及其不同极性部位萃取相均表现出一定的清除·OH能力。在质量浓度0.5~2.5 mg/mL范围内,所有样品对·OH的清除能力均随样品浓度的增加而逐渐增大,呈现明显的剂量依赖性。猴头菇醇提物及其不同极性萃取相对·OH的清除率大小依次为:石油醚相>乙酸乙酯相>水相>正丁醇相>醇提物。石油醚相和乙酸乙酯相对·OH的清除效果显著高于猴头菇醇提物、正丁醇相和水相的清除效果,表现出较强的清除·OH活性,这与薛雅荣等[9]对菠萝皮渣醇提物不同极性部位清除·OH能力的研究结果一致。当样品浓度为2.5 mg/mL时,石油醚相和乙酸乙酯相对·OH的清除率分别达到96.85%和82.84%,显著高于猴头菇醇提物(41.73%)、正丁醇相(43.74%)和水相(48.35%),这可能与石油醚相和乙酸乙酯相含有更高含量的黄酮和多酚有关。而猴头菇水提粗多糖在浓度3.0 mg/mL时对·OH的清除率为31.96%[8],远低于醇提物及其各相萃取组分。
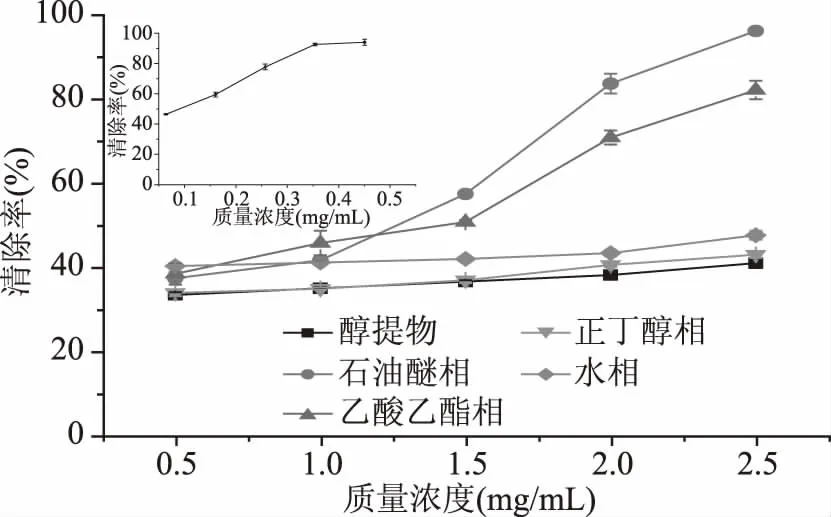
图3 猴头菇醇提物及其不同极性萃取相对·OH的清除率Fig.3 Scavenging rate of ethanol extract and its different polar fractions from Hericium erinaceus on ·OH
2.3.3 ABTS+·清除能力 如图4所示,猴头菇醇提物及其不同极性萃取相均具有一定的清除ABTS+·能力。在质量浓度0.1~0.5 mg/mL范围内,所有样品对ABTS+·的清除能力均随样品浓度的升高而逐渐增大,呈现明显的剂量依赖性。猴头菇醇提物及其不同极性萃取相对ABTS+·的清除率大小依次为:乙酸乙酯相>正丁醇相>醇提物>水相>石油醚相。在测试浓度范围内,乙酸乙酯相和正丁醇相对ABTS+·的清除率明显高于其它样品,表现出相对较强的清除ABTS+·活性。当样品浓度达到0.3 mg/mL后,继续增加样品浓度,乙酸乙酯相和正丁醇相对ABTS+·的清除率增加缓慢,基本保持平衡,清除率分别达到88.12%和85.47%,高于同浓度下猴头菇醇提物(65.27%)、石油醚相(47.64%)、水相(64.11%)以及猴头菇水提粗多糖(78.08%)[8]的清除ABTS+·活性。

图4 猴头菇醇提物及其不同 极性萃取相对ABTS+·的清除率Fig.4 Scavenging rate of ethanol extract and its different polar fractions from Hericium erinaceus on ABTS+·
2.3.4 还原能力 由图5可知,猴头菇醇提物及其不同极性部位萃取相均具有一定的还原能力。在质量浓度0.5~2.5 mg/mL范围内,所有样品的还原能力均随样品浓度的升高而逐渐增大,呈现明显的剂量依赖性。其中,乙酸乙酯相的还原能力显著高于其他相,而其他相的还原能力相差不大,但是均低于VC的还原能力,这与上述实验分析中乙酸乙酯相比其它相组分具有更好DPPH·、·OH和ABTS+·清除活性结果一致。国旭丹等[20]对苦荞麸乙醇粗提物各极性成分的还原能力测定结果也呈现出相同的趋势。当样品浓度为2.5 mg/mL时,乙酸乙酯相在700 nm波长处的吸光值达到0.897,显著高于猴头菇醇提物(0.531)、石油醚相(0.535)、正丁醇相(0.521)和水相(0.505)。而猴头菇水提粗多糖在浓度为3.0 mg/mL时的吸光值为0.78[8],因此其还原能力低于乙酸乙酯相。

图5 猴头菇醇提物及其不同极性萃取相的还原能力Fig.5 Reducing power of ethanol extract and its different polar fractions from Hericium erinaceus
3 结论
猴头菇醇提物及其不同极性部位萃取相的总酚和总黄酮含量及其体外抗氧化活性均存在一定差异。其中乙酸乙酯相的总酚和总黄酮含量最高,分别为16.52 mg/g和10.08 mg/g。猴头菇醇提物及其不同极性部位萃取相均表现出一定的抗氧化活性,且在一定浓度范围内呈现明显的量效关系。在相同浓度下,乙酸乙酯相的抗氧化活性相对较高,对DPPH·、·OH和ABTS+·的清除率分别可达到41.64%(2.5 mg/mL)、82.84%(2.5 mg/mL)和89.18%(0.5 mg/mL),但对·OH的清除率稍低于石油醚相(96.85%)。综上分析表明猴头菇醇提物中乙酸乙酯相萃取组分具有较好的综合抗氧化活性,可作为目标活性部位进行后续分离单体化合物研究,为猴头菇在医药、保健品和功能食品中的应用提供基础数据。
参考文献
[1]Liu J,Li L,Shang X,et al. Anti-Helicobacterpyloriactivity of bioactive components isolated fromHericiumerinaceus[J]. Journal of Ethnopharmacology,2016,183:54-58.
[2]Sousa A,Ferreira I,Barros L,et al. Antioxidant potential of traditional stoned table olives“Alcaparras”:influence of the solvent and temperature extraction conditions[J]. LWT-Food Science and Technology,2008,41:739-745.
[3]Jiang S,Wang S,Sun Y,et al. Medicinal properties ofHericiumerinaceusand its potential to formulate novel mushroom-based pharmaceuticals[J]. Applied Microbiology and Biotechnology,2014,98(18):7661-7670.
[4]Choi W,Kim Y,Park B,et al. Hypolipidaemic effect ofHericiumerinaceumgrown inArtemisiacapillarison obese rats[J].Mycobiology,2013,41(2):94-99.
[5]Ren L,Hemar Y,Perera CO,et al. Antibacterial and antioxidant activities of aqueous extracts of eight edible mushrooms[J]. Bioactive Carbohydrates and Dietary Fibre,2014,3(2):41-51.
[6]Kim SP,Kang MY,Kim JH,et al. Composition and mechanism of antitumor effects ofHericiumerinaceusmushroom extracts in tumor-bearing mice[J]. Journal of agricultural and Food Chemistry,2011,59(18):9861-9869.
[7]Harikrishnan R,Kim J,Kim M,et al.Hericiumerinaceumenriched diets enhance the immune response inParalichthysolivaceusand protect fromPhilasteridesdicentrarchiinfection[J]. Aquaculture,2011,318(1):48-53.
[8]黄越,周春晖,黄惠华. 不同提取方法猴头菇粗多糖的表征及其抗氧化活性的比较[J]. 食品工业科技,2017,38(3):80-86.
[9]薛雅荣,赵二劳,薛海波,等. 菠萝皮渣醇提物不同极性部位抗氧化活性研究[J]. 食品研究与开发,2016,37(20):8-11.
[10]吴峰华,毛晓慧,刘相真,等. 覆盆子醇提物及其不同极性部位抗氧化活性研究[J]. 中国食品学报,2012,12(2):24-29.
[11]杜秀菊,陈韵,张扬,等. 桦褐孔菌醇提物抗氧化活性部位的筛选[J]. 食品安全质量检测学报,2015,6(10):4219-4224.
[12]赵晓娟,陈悦娇,李敏仪,等. Folin-Ciocalteu法测定苹果醋饮料的总多酚含量[J]. 食品科学,2013,34(8):31-35.
[13]林建原,季丽红. 响应面优化银杏叶中黄酮的提取工艺[J]. 中国食品学报,2013,13(2):83-90.
[14]Hua D,Zhang D,Huang B,et al. Structural characterization and DPPH· radical scavenging activity of a polysaccharide from Guara fruits[J]. Carbohydrate Polymers,2014,103:143-147.
[15]Mao J,Yin J,Ge Q,et al.Invitroantioxidant activities of polysaccharides extracted from Moso Bamboo-Leaf[J]. International Journal of Biological Macromolecules,2013,55:1-5.
[16]Li C,Huang Q,Fu X,et al. Characterization,antioxidant and immunomodulatory activities of polysaccharides fromPrunellavulgarisLinn[J]. International Journal of Biological Macromolecules,2015,75:298-305.
[17]Liu Y,Du Y Q,Wang J H,et al. Structural analysis and antioxidant activities of polysaccharide isolated from Jinqian mushroom[J]. International Journal of Biological Macromolecules,2014,64:63-68.
[18]王忠雷,杨丽燕,张小华,等. 天然产物抗氧化活性成分研究进展[J]. 药物评价研究,2012,35(5):386-390.
[19]刘博奥,刘玉梅,刘继国,等. 天山雪菊不同溶剂提取物的抗氧化活性研究[J]. 中国酿造,2014,33(3):71-75.
[20]国旭丹,王敏,陕方,等. 苦荞麸乙醇粗提物各极性成分的抗氧化活性研究[J]. 中国食品学报,2011,11(6):20-26.
[21]徐海燕,王延蛟,王东东,等. 新疆紫草不同极性萃取部位体外抗氧化活性研究[J]. 中医药导报,2016,22(20):34-36.
[22]栗铭鸿,金铁,李官浩,等. 元蘑醇提物不同极性部位有效成分含量及清除自由基活性[J]. 食品科技,2016,41(10):184-189.
InvitroantioxidantactivityofethanolextractfromHericiumerinaceusanditsdifferentpolarfractions
HUANGYue1,ZHOUChun-hui2,DAIHong-jie1,HUANGHui-hua1,*
(1.School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China; 2.Guangdong Apollo Croup. Co.,Ltd.,Guangzhou 510665,China)
The antioxidant activitiesinvitroof ethanol extract fromHericiumerinaceusand its different polar fractions were studied and compared. The obtained ethanol extract fromHericiumerinaceuswas fractionated by different inorganic solvents orderly,including petroleum ether,ethyl acetate,n-butanol and water. The contents of total phenols and flavonoids of different polar fractions and their antioxidant activities were determined and compared. The results indicated that the ethyl acetate fraction showed the highest contents of total polyphenols and flavonoids(16.52 mg/g and 10.08 mg/g,respectively). The different polar fractions showed certain antioxidant activities,especially the ethyl acetate fraction whose scavenging rate on DPPH·,·OH and ABTS+· was 41.64%(2.5 mg/mL),82.84%(2.5 mg/mL)and 89.18%(0.5 mg/mL)respectively. These results demonstrated that ethyl acetate fraction had the highest antioxidant activity and can be employed as effective fractions for further investigation on antioxidants.
Hericiumerinaceus;ethanol extract;polar fractions;antioxidant activity
2017-04-18
黄越(1994-),女,硕士研究生,研究方向:农产品深加工,E-mail:huangyuecn@163.com。
*
黄惠华(1959-),男,博士,教授,研究方向:农产品加工与贮藏,E-mail:fehhuang@scut.edu.cn。
广东省科技计划项目(2013B090600008)。
TS201.1
A
1002-0306(2017)21-0016-05
10.13386/j.issn1002-0306.2017.21.004

