化学反应与能量变化知识点解读
■北京市十一学校 滕明俊(博士)
化学反应与能量变化知识点解读
■北京市十一学校 滕明俊(博士)
编者注:本期文章的作者主要为北京市十一学校的中青年骨干教师,他们写的文章将知识讲解得清楚明白,解题的思路与方法巧妙实用,对同学们开拓知识面和提高应试能力很有帮助。希望同学们读后收获满满。另外,特别感谢滕明俊老师及其同事为组织编写本期稿件所做的努力。
化学反应与能量变化知识是高考考查的重点,要顺利解答相关方面的题目,最重要的是对基本概念(燃烧热、中和热、热化学方程式等)和基本原理(盖斯定律)的理解和应用。
一、对基本概念的理解
1.反应热能量变化的本质为化学键的断裂和形成。反应热=反应物旧键断裂所吸收的能量-生成物新键生成所释放的能量。反应热小于零是放热反应,大于零是吸热反应。反应是放热还是吸热,这与反应条件(比如是否需要加热)没有必然联系。需要加热才能进行的反应不一定是吸热反应,例如,铝热反应2Al+Fe2O3══Al2O3+2Fe需要在加热条件下引发,但是该反应是剧烈的放热反应。
2.燃烧热的定义:1mol纯净物在25℃,101kPa的条件下完全燃烧生成稳定产物所放出的能量。定义中有几点需要特别注意:①量:可燃物为1mol,但不限制生成物的量;②反应的条件:25℃、101kPa;③产物:完全燃烧后的稳定产物。比如1molC燃烧生成CO所放出的热量,不能够称之为碳的燃烧热,因为CO不是完全燃烧后的稳定产物,CO2才是稳定产物。
3.中和热的定义:酸与碱发生中和反应生成1 molH2O时所释放的热量称为中和热。定义中需要注意的地方是:①量:生成物(H2O)为1mol,但不限制反应物的量,如果生成物不是1mol水,则能量变化不能称之为中和热;②放热反应;③在稀溶液中,强酸和强碱的中和热约为57.3kJ·mol-1,而对于强酸和弱碱,或是强碱和弱酸的反应,其中和热的数值小于57.3kJ·mol-1,因为弱酸或弱碱的电离是一个吸热的过程。
例1判断以下说法正确的是( )。
A.合成氨需要在高温高压下进行:N2+3H2══2NH3,所以该反应是吸热反应
B.1molH2完全燃烧生成1mol水蒸气所放出热量称之为氢气的燃烧热
C.燃烧热和中和热都是化学反应时放出的热量,故它们对应的ΔH<0
D.在25℃,101kPa下,1mol磷燃烧生成三氧化二磷所放出的热量为磷的燃烧热
解析:选项A,反应条件与反应吸热、放热没有必然的联系,合成氨虽然需要在高温条件下进行,但是该反应是放热反应,A项错误。
选项B,根据定义,H2的燃烧热为1molH2完全燃烧生成液态水H2O(l)所放出的热量,而非水蒸气,故B项错误。
D选项,磷燃烧的稳定产物为五氧化二氯,而不是三氧化二磷,故D项错误。
燃烧和中和过程都是放热过程,所以ΔH<0,C选项正确。
答案:C
【举一反三】
已知:①2H2(g)+O2(g)══2H2O(l)ΔH1=-571.6kJ·mol-1
求氢气的燃烧热。
解析:在25℃,101kPa的条件下,H2的稳定燃烧产物H2O以液态形式存在,而非气态,所以②ΔH=-241.8kJ·mol-1的热量变化不是反应热。
因为燃烧热规定是1mol可燃物参与反应,根据①式,H2的燃烧热应为-285.8kJ·mol-1。
答案:ΔH=-285.8kJ·mol-1。
二、热化学反应方程式的书写与正误判断
热化学反应方程式包含了物质变化和能量变化两部分的信息,表1总结了它与普通化学方程式的区别。

表1
判断热化学方程式正误和书写热化学方程式的注意事项:
(1)观察方程式是否已经配平;
(2)看是否注明物质的聚集状态,以及状态是否正确;
(3)看是否注明能量变化ΔH,①ΔH的符号(放热为“-”,吸热为“+”),②数值,③单位(kJ·mol-1),是否符合实际情况;
(4)分析各物质的计量数是否符合要求(燃烧热——可燃物的计量数为1,中和热——H2O的计量数为1)。
例2下列热化学方程式正确的是(ΔH的绝对值均正确)( )。
A.表示S的燃烧热的热化学反应方程式是2S(s)+3O2(g)══2SO3(s) ΔH=-630kJ·mol-1
B.乙醇的燃烧:C2H5OH+3O2→2CO2+3H2O ΔH=-1369kJ·mol-1
C.已 知NaOH(aq)+HCl(aq)══NaCl(aq)+H2O ΔH=-57.3kJ·mol-1,则反应 3NaOH(aq)+H3PO4(aq)══Na3PO4(aq)+H2O(l) ΔH=-57.3×3=-171.9kJ·mol-1
D.碳的燃烧:C(s)+O2(g)══CO2(g)ΔH=-393.5kJ·mol-1
解析:A选项,燃烧热应该是1mol纯净物在25℃,101kPa的条件下完全燃烧生成稳定产物所放出的能量。A选项中S的化学计量数应该是1而不是2。
B选项,没有标明聚集状态,且方程式中应该用“=”而不是“→”。
C选项,H3PO4是中强酸,其电离的过程吸热,所以H3PO4与NaOH的反应热的数值应该小于57.3×3=171.9kJ·mol-1。
答案:D
【举一反三】
火箭推进器常以气态联氨(N2H4)为燃料,液态过氧化氢为助燃剂。反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时,放出161kJ的热量。试写出反应过程中的热化学方程式:___。
答案:N2H4(g)+2H2O2(l)══N2(g)+4H2O(g) ΔH=-644kJ·mol-1
三、盖斯定律及其应用(见表2)

表2
例3半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
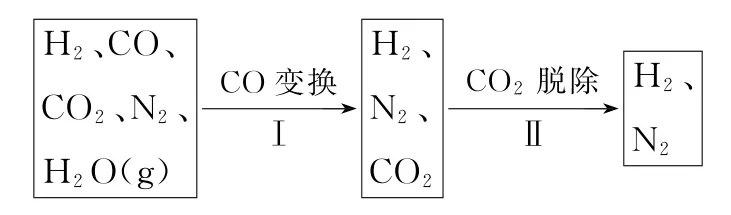
步骤Ⅰ,CO变换反应的能量变化如图1所示。
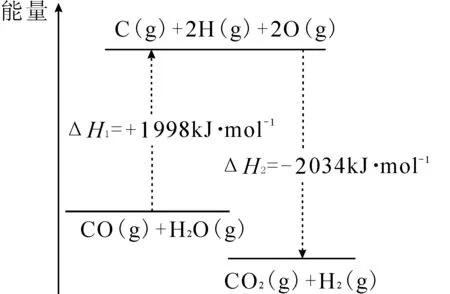
图1
则CO变换反应的热化学方程式是____。
解析:根据题意,先写出CO变换反应的目标方程式:
CO(g)+H2O(g)══CO2(g)+H2(g) ΔH
根据图中的能量变化图,可以写出已知方程式:
①CO(g)+H2O(g)══C(s)+2H(g)+2O(g) ΔH1
②C(s)+2H(g)+2O(g)══CO2(g)+H2(g) ΔH2
观察发现,①+②进行方程式叠加可以消除中间产物[C(s)+2H(g)+2O(g)],得到目标方程式,所以ΔH=ΔH1+ΔH2=+1998 kJ·mol-1+(-2034kJ·mol-1)=-36kJ·mol-1。
答案:CO(g)+H2O(g)══CO2(g)+H2(g) ΔH=-36kJ·mol-1
【举一反三】
根据下列热化学方程式分析,C(s)的燃烧热ΔH等于( )。
①C(s)+H2O(l)══CO(g)+H2(g)ΔH1=+175.3kJ·mol-1
②2CO(g)+O2(g)══2CO2(g) ΔH2=-566.0kJ·mol-1
③2H2(g)+O2(g)══2H2O(l) ΔH3=-571.6kJ·mol-1
A.ΔH1+ΔH2-ΔH3
B.2ΔH1+ΔH2+ΔH3

解析:首先写出C(s)的燃烧热的热化学方程式(目标方程式):
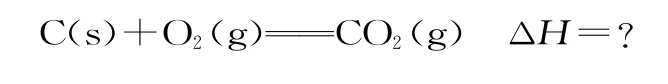
根据各物质在以上方程式中的位置,观察已知的三个方程式,发现不用调整反应方向,仅需要调整计量数。为把中间产物CO和H2消去,对②和③进行计量数调整,都分别乘以,可以得到目标方程式,所以
答案:D
(责任编辑 谢启刚)
《中学生数理化》高考理化版发稿计划
(双月化学专刊)
2018年2月号
有机化学:有机化合物的分类及命名,官能团的识别,有机物的结构,同系物与同分异构体,同分异构体种数的判断及书写,有机物的燃烧规律,有机物分子式、结构式的确定,烃和卤代烃,烃的含氧衍生物,高分子化合物,有机合成与推断。
2018年4月号
化学实验:化学实验的基本方法和技能,常见仪器的使用,化学实验基本操作及安全,常见气体的实验室制法,物质的检验、分离与提纯,物质的鉴别,阿伏加德罗常数的应用,物质的量,气体摩尔体积,溶质的质量分数、物质的量浓度及其相关计算,无机物和有机物的制备,实验探究(反应原理、物质组成、物质性质的探究),实验方案的设计、评价或改进方案。
2018年6月号(提前于4月底出版)
物质结构 元素周期律:元素、核素、同位素的含义,微粒的组成、结构和性质,化学键、离子化合物与共价化合物,元素周期表及其应用,元素周期律及其应用。
物质结构与性质:原子结构与性质,化学键与分子结构,晶体结构与性质。
2018年8月号(提前于4月底出版)
高考热点专题:化学与生活、科技、环境,科学应考,审题要领,选择题解题技巧,填空题答题规范,等等。

