猪链球菌荧光定量PCR检测方法的建立及临床应用
雷宇平,王仲兵,杨治平,张仲萍,王治维,胡明明
(山西省动物疫病预防控制中心,山西太原 030027)
猪链球菌荧光定量PCR检测方法的建立及临床应用
雷宇平,王仲兵,杨治平,张仲萍,王治维,胡明明
(山西省动物疫病预防控制中心,山西太原 030027)
为快速诊断和检测猪链球菌病,根据GenBank中已登录的猪链球菌抗原基因保守区域序列,设计并合成特异性引物及Taqman探针,通过优化荧光定量PCR反应体系及扩增条件,构建了快速、准确检测猪链球菌的Taqman荧光定量PCR检测方法(Taqman FQ-PCR),测定了该方法的灵敏性、重复性和特异性,并对疑似猪链球菌临床感染样本进行了检测.结果显示:所建立的Taqman FQ-PCR方法检测灵敏度为1X102拷贝/μL;对3种不同浓度的猪链球菌重组质粒进行3次重复扩增,变异系数均小于3%,说明重复性好;特异性检测显示,只有猪链球菌样本的扩增曲线呈阳性反应,其他致病菌均无荧光信号;采用此方法,对30份临床疑似猪链球菌感染样本进行检测,发现有27份样本为阳性,比采用国标法检测得到的结果更加灵敏.结果表明,建立的FQPCR方法具有灵敏性高、重复性好、特异性强等特点,可用于猪链球菌的快速诊断和检测.
荧光定量PCR;猪链球菌;检测;探针
猪链球菌(Streptococcus suis,SS)是一种人兽共患病原菌,临床上主要引起猪脑膜炎、脑炎、心内膜炎、败血症、流产及支气管肺炎等[1],不仅给养猪业带来巨大经济损失,还严重威胁了公共卫生安全.1999年夏季,此病在江苏省暴发,造成25人感染,14人死亡[2],2005年在四川省暴发,导致43人死亡[3].因此,SS的快速检测对预防和及时控制该病的传播十分重要.
目前,SS的检测方法主要为常规细菌分离培养和生化鉴定.这几种方法不仅耗时耗力,而且灵敏度不高,结果不准确.而荧光定量PCR(FQ-PCR)技术具有速度快、灵敏度高、特异性好等优点,可以弥补细菌学培养检测方法的不足并且可以准确测定样品中病原微生物数量,因而被广泛应用于病原微生物检测[4].本研究以SS抗原基因为靶基因,设计引物和探针,建立了SS的FQ-PCR检测方法.
1 材料与方法
1.1 材料
1.1.1 菌株.SS以及猪生活环境中常见的菌群,如猪副溶血嗜血杆菌、多杀性巴氏杆菌、猪布鲁氏菌、丹毒杆菌等,均由本实验室保存.
1.1.2 仪器与试剂.7500 Fast Real-Time PCR仪、Beckman coulter DU640型核酸蛋白检测仪(美国ABI公司);Premix Ex TaqTM试剂盒、DNA分子量标准DL2000(Takara公司);细菌基因组DNA快速提取试剂盒(Generay biotech公司).
1.2 引物与Taqman探针
根据GenBank中已登录的SS抗原基因序列,分析基因保守区;应用Primer Express 3.0软件,设计特异性引物及探针,并通过美国国家生物技术信息中心(NCBI)的BLAST功能,对其特异性进行初步鉴定,再由上海生工合成探针的5´端(用FAM标记)和3´端(用BHQ1标记).具体引物和探针序列见表1.

表1 引物与探针序列
1.3 阳性标准品制备
将含有SS抗原基因的部分片段构建于PUC57质粒上,制成重组克隆菌,用于后续扩增实验.提取重组质粒,用紫外分光光度计测OD260、OD280及OD260/OD280值,重复3次,确定质粒DNA浓度和纯度,计算拷贝数并稀释至1X105拷贝/μL,–20℃保存备用.拷贝数=质粒浓度X6.02X1023/(660X质粒总长度).
1.4 检测样品及DNA提取
对疑似SS感染的30只病猪扁桃体组织进行采样检测.无菌环境下称取扁桃体组织1 g放入研钵中,加入2.5 mL生理盐水,充分研磨混匀后,取150 μL 研磨液,使用细菌基因组DNA提取试剂盒,提取基因组DNA,采用紫外分光光度计,测定模板DNA的浓度与纯度,将获得的DNA样品于–20 ℃保存备用.
1.5 荧光定量PCR体系的建立
PCR扩增反应在ABI7500 Fast Real-Time PCR仪上进行.荧光定量PCR初始反应体系(25 μL):5XPCR buffer 5 μL、50 μmol/L 引 物 各 0.1 μL、50 μmol/L 探 针 0.05 μL、10XdNTP 0.9 μL、DNA polymerase(1 U/μL)1 μL、ddH2O 13.85 μL、DNA模板4 μL.反应程序为:42 ℃ 20 min,95 ℃ 10 min,94 ℃ 15 s,55 ℃ 30 s,40个循环.根据以上反应及扩增条件,以阳性质粒为模板,分别对引物浓度范围(5~10 μmol/L)、探针浓度范围(2.5 mmol/L~7.5 μmol/L)和退火温度(52~60 ℃)进行优化.引物探针浓度以2 μmol/L递增,退火温度以2 ℃递增,确定PCR反应条件.
1.6 灵敏度检测
将已定值的SS重组质粒稀释至1X105拷贝/μL,再10倍系列稀释5个梯度,以1X101~1X104拷贝/μL的稀释液为模板,每个梯度重复3次,确定其灵敏度.
1.7 精密性和重复性试验
取1X102、1X103和1X105拷贝/μL 3个浓度的重组质粒,进行3次批内和批间平行试验,每个梯度重复10次,计算变异系数(CV),判定该方法的精密性和可重复性.
1.8 特异性试验
采用优化后的方法,对SS、猪副溶血嗜血杆菌、多杀性巴氏杆菌、猪布鲁氏菌、丹毒杆菌的核酸进行检测,并设空白对照,以验证该方法的特异性.
1.9 临床应用试验
提取疑似SS感染的30只病猪扁桃体组织的总DNA;以SS重组质粒为阳性对照,以ddH2O为空白对照,以健康猪的扁桃体组织总DNA为阴性对照,按照最终优化的条件进行FQ-PCR扩增;同时对以上样品进行国标法复检,以验证两者之间的符合率.
2 结果
2.1 实时荧光定量PCR的建立
优化后的实时荧光定量PCR反应体系(25 μL)为:5XPCR buffer 5 μL、50 μmol/L 引物各 0.15 μL、50 μmol/L 探 针 0.1 μL、10XdNTP 0.9 μL、DNA polymerase(1 U/μL)1 μL、ddH2O 13.7 μL、DNA模板 4 μL.反应程序为:42 ℃ 20 min,95 ℃ 10 min,94 ℃ 15 s,55 ℃ 30 s,40个循环.阳性结果的判定标准以Ct值lt;35且扩增曲线呈S型为阳性;Ct值在35~37之间时,需重复2次试验,若均为良好的S型扩增曲线方,可判定为阳性.
2.2 灵敏度试验
将已定值的SS重组质粒倍比稀释至最小为1X101拷贝/μL,并以此作为实时荧光定量PCR的反应模板(图1).可得出,此方法的检测下限为 1.0X102拷贝 /μL.

图1 实时荧光定量PCR灵敏度试验
2.3 重复性试验
1X105、1X103、1X102拷贝 /μL 的标准样品的变异系数在批内和批间分别为2.00%、1.20%、1.23%和1.89%、1.32%、1.44%(表1),均低于3%,说明该方法具有较好的精密性和重复性.
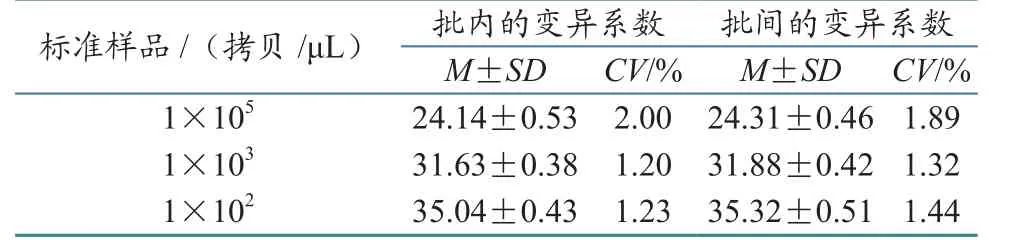
表1 实时荧光定量PCR重复性试验
2.4 特异性试验
以SS、猪副溶血嗜血杆菌、多杀性巴氏杆菌、猪布鲁氏菌、丹毒杆菌作为特异性试验的对照组,进行实时荧光定量PCR.检测结果中只有SS样本有扩增曲线,其他对照组无扩增曲线,表明该试验方法具有较高的特异性(图2).

图2 实时荧光定量PCR灵敏度试验
2.5 临床样本检测
对30份疑似SS感染临床样品,采用实时荧光定量PCR直接检测,共检测出SS阳性样品24份(表2).同样采用国标法(GB 19915.7-2005)复检结果,发现FQ-PCR检测结果与国标法检测结果相符,并且比传统的细菌分离方法具有更高的灵敏性.

表2 30例临床样品检测
3 讨论与结论
SS是猪饲养过程中常见的一种条件致病菌,通常感染猪的上呼吸道,特别是扁桃体以及鼻腔、生殖道和消化道,可引起关节炎、心内膜炎等,严重时可引起败血症、脑膜炎;人感染后则常发生化脓性脑炎、腹膜炎、肺炎、关节炎以及眼内炎等疾病,甚至导致死亡[5-9].该病原菌严重威胁了食品安全和畜牧养殖业生产.因此加强对SS的检测力度,对预防和控制猪链球菌病意义重大[10].
目前,传统的SS分离鉴定及常规的PCR检测耗时长、易污染、步骤繁琐、敏感性低,还可能出现假阳性结果[11].本试验建立的FQ-PCR不仅具有常规PCR技术的扩增高效率优势,而且具有高度特异性、敏感性和可重复性等特点,已被广泛运用于临床医疗、病原菌检测等体外扩增技术[12].本研究中采用的探针结合引物办法,具有更高的特异性,并且使用该方法对其他细菌进行检测显示,只有SS有扩增曲线,再次证明该方法具有良好的特异性.对同一个浓度的标准模板进行多次重复试验,得出的变异系数均低于3%,表明该方法具有很好的重复性和敏感性.采用此方法进一步对30份疑似SS感染的临床样品进行检测,得到的检测结果与传统的细菌分离鉴定结果一致,并且可以检测出国标法未检测出来的阳性样品,再次表明所建立的方法具有较高的灵敏度.
该研究成功建立了SS的FQ-PCR方法,实现了SS的快速、高效、准确检测,对控制该病原菌的传播和流行提供了一项新的技术支持.
[1] STAATS J J,FEDER I,OKWUMABUA O,et al.Streptococcus suis:past and present[J]. Veterinary research communications,1997,21(6):381-407.
[2] PROF D M R L,MED D D M N T,HAHN D M V G,et al. Meningitis caused by streptococcus suis:Case report and review of the literature[J]. Infection,1986,14(4):181-185.
[3] 张超颖,徐玉花,蒋春燕. 2型猪链球菌病的研究进展[J].畜禽业,2015(3):20-22.
[4] 许颂霄,王虹,尹一兵. 定量PCR的荧光技术[J]. 生命的化学,2005,25(5):413-415.
[5] SRISKANDAN S,SLATER J D. Invasive disease and toxic shock due to zoonotic Streptococcus suis:an emerging infection in the East?[J]. Plos medicine,2006,3(5):e187.
[6] 李春玲,语炜烈,贾爱卿,等. 应用多重PCR检测屠宰猪扁桃体中的猪链球菌[J]. 中国预防兽医学,2008,30(5):344-348.
[7] YU H,JING H,CHEN Z,et al. Human streptococcus suis outbreak,Sichuan,China[J]. Emerging infectious diseases,2006,12(6):914-920.
[8] TANG J,WANG C,FENG Y,et al. Streptococcal toxic shock syndrome caused by Streptococcus suis serotype 2[J].Plos medicine,2006,3(5):e151.
[9] CHEN C,TANG J,DONG W,et al. A glimpse of streptococcal toxic shock syndrome from comparative genomics of suis 2 chinese isolates[J]. Plos one,2007,2(3):e315.
[10] 王蓉蓉,孙卫东,蒋蔚,等. 猪链球菌2型主要毒力因子三重荧光定量PCR检测方法的建立[J]. 中国动物传染病学报,2014,22(6):25-31.
[11] 李逢慧,罗超,程天印. 猪链球菌2型CPS2J基因PCR检测技术研究进展[J]. 动物医学进展,2008(7):79-81.
[12] 欧阳松应,杨冬,欧阳红生,等. 实时荧光定量PCR技术及其应用[J]. 生命的化学,2004,24(1):74-76.
(责任编辑:杜宪)
Establishment of Fluorescence Quantitative PCR for Streptococcus suis Detection and Its Clinical Application
Lei Yuping,Wang Zhongbing,Yang Zhiping,Zhang Zhongping,Wang Zhiwei,Hu Mingming
(Shanxi Animal Disease Prevention and Control Center,Taiyuan,Shanxi 030027)
In order to diagnose and detect swine streptococcosis rapidly,the specific primers and Taqman probes were designed according to the conservative regional sequence of the antigen gene of Streptococcus suis(SS) in GenBank.By optimizing the reaction system and amplification conditions of real-time PCR,Taqman real-time PCR method was established,which could detect the SS quickly and accurately. The sensitivity,repeatability and specificity of this method were tested,and suspected clinical infection samples were also detected. The results showed that the sensitivity of the established Taqman FQ-PCR method was 1X102copy/μL. Three recombinant plasmids with different concentrations of SS were amplified 3 times,and the variation coefficient was less than 3%,which showed good repeatability. The specific test showed that only the amplification curve of SS was positive and the other pathogens had no fluorescent signal. Thirty samples of suspected SS infection were detected by this method,and 27 samples were tested positive,which was more sensitive than the national standard. In conclusion,the FQ-PCR method was sensitive,reproducible and specific,which was beneficial to the rapid diagnosis and detection of SS.
fluorescence quantitative PCR;Streptococcus suis;detection;probe
S852.61
A
1005-944X(2017)12-0084-04
10.3969/j.issn.1005-944X.2017.12.024
山西省重点研发计划一般项目(201603D221023-3)
——一道江苏高考题的奥秘解读和拓展

