鱼类病毒性出血性败血症病毒诊断胶体金免疫层析方法的建立
孙 涛,高瑞刚,孙明君,王 群,雷质文,岳志芹
(1. 山东出入境检验检疫局,山东青岛 266002;2. 青岛出入境检验检疫局,山东青岛 264000)
鱼类病毒性出血性败血症病毒诊断胶体金免疫层析方法的建立
孙 涛1,高瑞刚2,孙明君1,王 群1,雷质文1,岳志芹1
(1. 山东出入境检验检疫局,山东青岛 266002;2. 青岛出入境检验检疫局,山东青岛 264000)
为建立一种快速检测鱼类病毒性出血性败血症病毒(Viral haemorrhagic septicaemia virus,VHSV)的胶体金免疫层析方法(GICA),采用柠檬酸三钠还原法制备胶体金颗粒,以标记纯化的VHSV G蛋白单克隆抗体(MAb)10A7为捕捉抗体,将纯化的抗VHSV N蛋白的MAb 10EN单克隆抗体和羊抗鼠IgG抗体包被在硝酸纤维素膜上,作为检测带与质控带,经试验条件优化,组装形成胶体金免疫层析试纸条.用本试验研制的胶体金试纸条检测VHSV感染的CHSE细胞培养物.结果显示:在检测线和质控线均呈现红色条带,而健康的CHSE细胞培养物对照仅在质控线呈现红色条带;试纸条检出病毒培养物的病毒量最低限为104.0TCID50;随机挑取3个不同批次的试纸条,对阳性样品和阴性样品进行重复试验,未发现差异.特异性试验表明,该试纸条与传染性造血器官坏死病毒(IHNV)、传染性胰坏死病毒(IPNV)、鲤春病毒血症病毒(SVCV)、牙鲆弹状病毒(HRV)、草鱼呼肠孤病毒(GCRV)无交叉反应.将同一批次的试纸条在4 ℃条件下保存不同时间后进行检测,发现保存6个月的试纸条仍具有良好的稳定性.本试验研发的胶体金诊断试纸条具有良好的特异性、灵敏性和重复性,在快速辅助检测方面具有推广应用价值.
鱼病毒性出血性败血症病毒;胶体金;免疫层析法
病毒性出血性败血症病毒(Viral hemorrhagic septicemia virus,VHSV) 可引起鲑鳟鱼类和多种海水鱼类发生暴发性流行的烈性传染病,属弹状病毒科、粒外弹状病毒属成员[1].由于鱼类是变温动物,很难在体内产生稳定的抗体[2-3],因此在水生动物检测中,很少采用包被蛋白的间接ELISA方法进行相关疫病的抗体鉴定和诊断.而直接法中的分子诊断方法检测到的是核酸[4-6],不是抗原蛋白或活病毒,因此无法用其进行确诊.
目前标准的VHSV监测方法(监测鱼群带毒情况)基本是直接检测,即用细胞培养分离来鉴定.其操作复杂、过程繁多、检测用时长、成本高.胶体金免疫层析技术是在胶体金标记技术、免疫层析技术和新材料技术基础上发展起来的一项新型体外诊断技术[7-8].其原理是利用微孔滤膜的渗滤浓缩和毛细层析作用,使抗原、抗体在固相膜上反应.由于是运用可目测的标记物(胶体金或染色乳胶)而得到的直观实验现象(显色),从而使这种分析技术具备操作快速简便,无须仪器,结果准确、灵敏,可常温下运输保存等优点.
世界动物卫生组织(OIE)《水生动物疾病诊断手册》规定,在没有或不能进行病毒分离的情况下,可以利用两种不同的方法来进行病原确诊.本研究利用自行开发的VHSV特异性单克隆抗体,结合GICA,研制出快速、简便诊断VHSV的胶体金免疫层析试纸条,以此作为VHSV检测技术的补充.
1 材料和方法
1.1 抗体、病毒株及试剂
特异性识别抗VHSV G蛋白[9]的单克隆抗体10A7:由本实验室保存;抗VHSV N蛋白[10]的MAb 10EN:由中国检验检疫科学研究院馈赠.氯金酸、牛血清白蛋白(BSA)和聚乙烯醇:均购自Sigma公司;重组蛋白琼脂糖亲和层析柱:购自Invitrogen公司;羊抗小鼠IgG:购自上海朗顿生物科技有限公司;硝酸纤维素膜(NC膜):购自深圳三方圆公司;吸水纸、玻璃纤维和胶板:均购自上海金标生物科技有限公司;ZX3000喷膜机和CM4000切条机:均为美国Bio-Dot公司产品;鲑鱼胚胎细胞CHSE:由本实验室保存;Viral Hemorrhagic Septicemia Virus(VHSV)、Infectious haematopoietic necrosis virus(IHNV)、Infectious pancreatic necrosis virus(IPNV)、Spring Viremia of Carp Virus(SVCV)、Rhabdovirus olivacens virus(HRV)、Grass Carp Reovirus virus(GCRV):均由深圳局水生动物检疫实验室分离、鉴定、保存.
1.2 单克隆抗体的特异性鉴定与纯化
将单克隆抗体通过不同病毒抗原包被的ELISA试验测定特异性及其效价,然后用蛋白G亲和层析柱纯化后,用SDS-PAGE[11]法检测其纯度.
1.3 胶体金颗粒的制备及均匀度鉴定
采用柠檬酸三钠还原法制备胶体金,然后将其4 ℃避光保存.通过透射电镜直接观察颗粒大小和均匀程度.
1.4 胶体金标记MAb的制备
参照文献[7]方法,确定MAb 10A7与胶体金溶液的最佳标记量为16.74 μg/mL.取最佳MAb的量与胶体金溶液磁力搅拌混合30 min,加入5%的BSA溶液至终浓度为1%,2 000 r/min离心20 min;取上清,10 000 r/min离心1 h;对所得沉淀用0.02 mol/L碳酸盐缓冲液(pH 9.2、含1%的BSA和0.1%叠氮钠)重悬至原体积的1/10,4 ℃保存备用.
1.5 胶体金垫的制备
将玻璃纤维纸浸入胶体金标记的MAb溶液中1 h,室温干燥后4 ℃保存.
1.6 NC膜转印膜的制备
检测线(Test line,T线)和控制线(Control line,C线)抗体工作浓度参照文献[12].用喷膜仪将浓度为2 mg/mL的MAb10EN和羊抗鼠IgG抗体喷于NC膜中央,将喷样速度设为1.0 μL/cm,使其形成间距0.5 cm的T线和C线.将NC膜于室温干燥1 h,用含有1%聚乙烯醇的20 mmol/L Tris-HCl(pH7.4)室温封闭30 min,用去离子水漂洗,室温干燥,然后于相对湿度为10%以下的干燥条件下抽湿4 h,然后4 ℃保存备用.
1.7 胶体金免疫层析试纸条的组装
将胶体金垫、NC膜、样品垫、吸水纸和塑料底板,按照图1的顺序装配.将NC膜粘贴于衬板上,在NC膜的两端分别粘贴吸水垫和样品垫,使吸水垫和样品垫均与NC膜重叠3 mm,进而采用Bio-Dot的CM4000切条机将其裁成5 mm宽的条状.

图1 胶体金免疫层析试纸条结构
1.8 检测程序与结果判定
1.8.1 待检样品的处理.将VHSV病料无菌接种于CHSE细胞,72 h后收获细胞,加入1/2原培养体积的0.01 mol/L PBS(pH7.2),漩涡震荡1 h,然后10 000 r/min 4 ℃离心,取上清作为被检抗原.取健康CHSE细胞按照上述方法处理作为阴性对照.
1.8.2 样品检测及结果判定.将100 μL处理的样品滴入样品垫,10~15 min内观察结果.结果判定如下:阳性为T线和C线均呈现清晰红色条带,样品中VHSV含量越高,T线红色越深;阴性为只有C线呈现红色条带;无效为C线不呈现红色条带.
1.9 胶体金免疫层析试纸条性能评价
1.9.1 特异性试验.用试纸条分别检测VHSV、IHNV、IPNV、SVCV、HRV和GCRV,根据检测结果判定其特异性.
1.9.2 敏感性试验.将半数细胞培养感染剂量105.5TCID50的VHSV样品,用PBS进行10倍梯度稀释;将试纸条检测到的VHSV阳性参考样品的最高稀释倍数(最小病毒滴度)定为试纸条的灵敏度.
1.9.3 重复性试验.将5份病毒抗原作为阳性样品,5份CHSE细胞培养上清为阴性样品,用于试纸条的重复试验.随机取出不同批次和同一批次的试纸条,分别对阳性和阴性样品进行重复检测,观察结果评估其重复性.
1.9.4 保存期试验.将保存于4 ℃条件下的100条胶体金免疫层析试纸条,每隔1个月取出10条,对相应病毒抗原、CHSE细胞培养上清及PBS进行检测,通过结果分析来确定试纸条的质保期限.
2 结果
2.1 单抗特异性分析及纯化
将2种单克隆抗体(细胞培养上清)分别与VHSV、IHNV、IPNV、SVCV、HRV、GCRV 和CHSE细胞培养物包被的ELISA板反应.结果显示,2种单抗与VHSV病毒抗原包被ELISA板反应时呈强阳性,与其它病毒包被ELISA板反应时均为阴性(表1).利用单抗细胞株制备的小鼠腹水效价达1:51 200.

表1 单克隆抗体特异性试验
用层析法对2种单克隆抗体(腹水)进行IgG纯化,用核酸/蛋白分析仪检测,发现纯化后的2单克隆抗体10A7、10EN浓度分别为1.632、1.824 mg/mL;将未纯化的腹水和纯化后的2种单克隆抗体进行SDS-PAGE电泳分析,发现未纯化腹水上清泳道出现多条杂带(Lane 1),而纯化后的单克隆抗体仅在53、22 ku处出现IgG轻链和重链的条带,无杂带出现(Lane 2~3),表明纯化效果良好(图2).

图2 单抗纯化后SDS-PAGE电泳结果
2.2 胶体金颗粒形态
将胶体金通过透射电子显微镜观察颗粒大小和均一程度.结果显示,100个金颗粒的平均直径为25 nm,符合标记要求(图3).
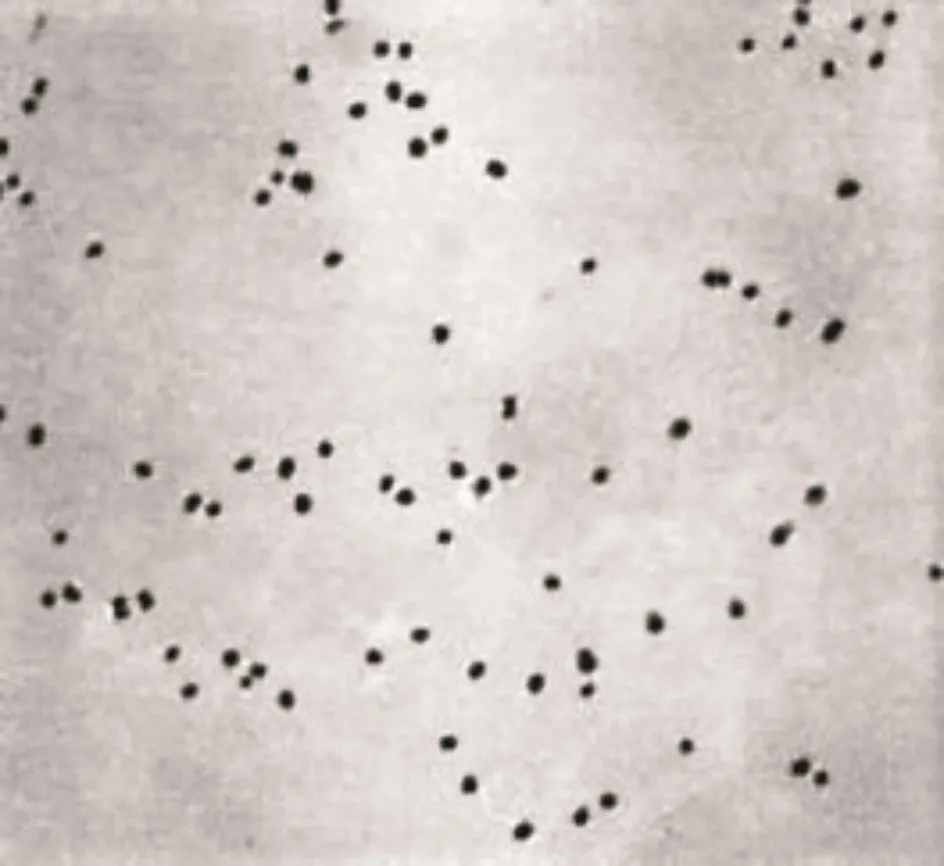
图3 胶体金颗粒透射电镜照片
2.3 标准样品检测
接种VHSV-H株的阳性细胞裂解液和阴性样品经胶体金免疫层析试纸条检测,发现结果与预期相符:阳性样品在试纸条上呈现2条清晰可见的红色条带;阴性样品仅在控制线呈现1条红色条带(图4).

图4 标准阳性样本的检测结果
2.4 胶体金免疫层析试纸条性能评价
2.4.1 特异性试验.将试纸条装配入实验室统一定制的塑料卡槽内,制成胶体金测试卡.对不同病毒样品进行检测,发现与其他常见病毒的反应均呈阴性(图5)

图5 VHSV胶体金试纸条的特异性试验结果
2.4.2 敏感性试验.将105.5TCID50的VHSV,用PBS分别稀释成TCID50为105.0/0.1 mL、104.5/0.1 mL、104.0/0.1 mL和103.5/0.1 mL,然后分别用试纸条检测,将每个稀释度重复2次,发现检测浓度在104.0/0.1 mL以上的样品均为阳性结果,浓度为103.5/0.1mL的样品为可疑(表2).这表明该试纸条的检测灵敏度至少能达到104.0/0.1 mL.

表2 VHSV胶体金试纸条敏感性试验结果
2.4.3 重复性试验.对随机挑取的3个批次的试纸条进行重复试验,每批次挑取10个试纸条,分别对阳性样品和阴性样品进行检测,发现结果完全一致.取30个同批次试纸条,分别对阳性样品和阴性样品进行3次重复检测,发现结果完全一致.这些试验结果表明,该试纸条的检测重复性良好.
2.4.4 保存期试验.将同批次的100个试纸条,在4 ℃条件下保存不同时间(0~9个月).每次取出10条,分别检测相应的病毒及EPC细胞裂解液,发现4 ℃条件下保存6个月以内试纸条的检测结果没有任何变化,用4℃保存7个月的试纸条检测,发现试纸条出现假阳性(表3).检测结果表明试纸条在4 ℃条件下可以保存6个月.

表3 VHSV胶体金试纸条保质期实验
3 讨论
一般认为,大分子物质是以其表面的正电基团牢固的与胶金粒的吸附层(带负电)结合在一起的,是属于物理过程.所以,调节标记体系的pH及蛋白质用量相对重要.马红艳等[13]报道,pH在9.6时,蛋白和膜的结合力最强,而pH在6~8时,膜对蛋白的吸附力差别不大,都比在9.6时明显减小.此外,标记时,蛋白质与纳米金粒子之间是以一定的比例结合的.过多加入抗体并不能增加标记物的产率,只能增加金标抗体中游离抗体的量,并不能提高检测的灵敏性,而且游离的单克隆抗体还会与质控孔结合,从而影响对结果的判定;若加入抗体的量不足,则会导致胶体聚集物而沉淀.因而确定稳定胶体金所需的最小抗体量是试验的一个重要环节.在本试验中,每次标记都按照实测值,计算具体的稳定点;将pH控制在较高水平上,加入正确比例的金溶胶与被标蛋白质量,可以保证获得最佳标记率.经测试合适的MAb 10A7与胶体金溶液的最佳标记量确定为16.74 μg/mL.
胶体金试纸条载体主要为硝酸纤维素膜(NC膜)、玻璃棉、吸水纸和支持板.其中,NC膜膜的孔径、厚度与蛋白样品的结合力,液体待检物流动速率、扩张强度等,对检测系统的灵敏性均有一定影响,其中孔径与层析速率的影响较大.膜孔径越小,层析速度也越小;金标复合物通过T线的时间也就越长,反应也就越充分,灵敏度就越高.但这样也同时减慢了跑板速度,增加了非特异性结合的机会,从而使假阳性率增高.所以要按照试验结果挑选适合实际项目的膜[14],并找到合适的平衡点.
许多报道[15-17]采用多抗检测动物疫病病原,但发现特异性往往不够理想[18].本研究采用针对不同基因蛋白的单抗和单抗结合,建立了VHSV病毒免疫层析检测方法.与其他弹状病毒类病原IHNV、HRV的细胞培养物进行同时检测,发现均为阴性,而且标记的单克隆抗体具有良好的特异性.敏感性结果显示,在检测倍比稀释的阳性参考样本时,随着稀释倍数的增加,试纸条的检测能力不断下降,并会出现样本临界值的误判现象.本研究曾尝试加大检测线和控制线的浓度来避免该问题,但效果不很理想.加之被检样本大多为细胞纯培养物,在一定程度上限制了该试纸条在临床检测上的应用.但其对细胞培养物的检测具有简便、快速的特点,因此具有较好的辅助检测意义.
[1] OIE. Manual of diagnostic tests for aquatic animals:Viral haemorrhagic septicemia[M/OL]. [2017-07-06]. http://www.oie.int/fileadmin/Home/eng/Health_standards/aahm/current/2.3.09_VHS.pdf.
[2] MORVAN C L,DESCHAUX P,TROUTAUD D.Effects and mechanisms of environmental temperature on carp(Cyprinus carpio)anti-DNP antibody response and non-specific cytotoxic cell activity:a kinetic study[J].Developmental and comparative immunology,1996,20(5):331-340.
[3] MORVAN C L,TROUTAUD D,DESCHAUX P.Differential effects of temperature on specific and nonspecific immune defences in fish[J]. Journal of experimental biology,1998,201(2):165-168.
[4] CHICO V,GOMEZ N,ESTEPA A,et al. Rapid detection and quantitation of viral hemorrhagic septicemia virus in experimentally challenged rainbow trout by real-time RTPCR[J]. Journal of virological methods,2006,132(1/2):154-159.
[5] CORNWELL E R,ECKERLIN G E,GETCHELL R G,et al. Detection of viral hemorrhagic septicemia virus by quantitative reverse transcription polymerase chain reaction from two fish species at two sites in Lake Superior[J]. Journal of aquatic animal health,2011,23(4):207-217.
[6] GARVER K A,HAWLEY L M,MCCLURE C A,et al. Development and validation of a reverse transcription quantitative PCR for universal detection of viral hemorrhagic septicemia virus[J]. Diseases of aquatic organisms,2011,95(2):97-112.
[7] WANG Y,DOU H,CHEN K,et al. Development of a colloidal gold-based immunochromatographic test strip for the rapid,on-site detection of Pseudomonas aeruginosa in clinical samples[J]. Scandinavian journal of infectious diseases,2011,43(5):329-338.
[8] ZHANG L,LI D,LIU L,et al. Development of a colloidal gold immunochromatographic strip for the rapid detection of soft-shelled turtle systemic septicemia spherical virus[J]. Journal of virological methods,2015,221:39-45.
[9] SUN T,YIN W L,FANG B H,et al. Prediction of G gene epitopes of viral hemorrhagic septicemia virus and eukaryotic expression of major antigen determinant sequence[J].Cellular and molecular biology(Noisy-le-grand),2017,63(7):84-88.
[10]杜娟 兰,刘荭. 鱼类病毒性出血性败血症病毒核蛋白基因的原核表达[J]. 华中农业大学学报,31(3):376-380.
[11] 萨姆布鲁克J. 分子克隆实验指南[M]. 3版.北京:科学出版社,2003.
[12] SIU L K,TSAI Y K,LIN J C,et al. Development of a colloidal gold-based immunochromatographic strip for rapid detection of klebsiella pneumoniae serotypes K1 and K2[J].Journal of clinical microbiology,2016,54(12):3018-3021.
[13]马红艳,李强,韩雪松. 胶体金诊断试剂盒中层析膜材料性能的分析[J]. 膜科学与技术,2002,22(6):14-19.
[14] ZHOU C,ZHANG X,HUANG X,et al. Rapid detection of chloramphenicol residues in aquatic products using colloidal gold immunochromatographic assay[J]. Sensors(Basel),2014,14(11):21872-21888.
[15] LI H,YANG J,BAO D,et al. Development of an immunochromatographic strip for the detection of antibodies against porcine reproductive and respiratory syndrome virus[J].Journal of veterinary science,2017,24(6):1151.
[16] TSUDA Y,SAKODA Y,SAKABE S,et al.Development of an immunochromatographic kit for rapid diagnosis of H5 avian influenza virus infection[J]. Microbiol immunol,2007,51(9):903-907.
[17] USHIJIMA H,THONGPRACHUM A,KHAMRIN P,et al. Evaluation of immunochromatographic tests and a new enzyme immunoassay for detection of a novel GII.17 norovirus in stool samples[J]. Japanese journal of infectious diseases,2017,70(3):326-328.
[18] SHENG X Z,SONG J L,ZHAN W B. Development of a colloidal gold immunochromatographic test strip for detection of lymphocystis disease virus in fish[J]. Journal of applied microbiology,2012,113(4):737-744.
(责任编辑:朱迪国)
Development of a Colloidal Gold Immunochromatographic Assay for Antigen Detection of Viral Hemorrhagic Septicemia Virus
Sun Tao1,Gao Ruigang2,Sun Mingjun1,Wang Qun1,Lei Zhiwen1,Yue Zhiqin1
(1. Shandong Entry-exit Inspection and Quarantine Bureau,Qingdao,Shandong 266002;2. Qingdao Entry-exit Inspection and Quarantine Bureau,Qingdao,Shandong 266002)
In order to establish a colloidal gold immunochromatographic assay GICA)for rapid detection of Viral haemorrhagic septicaemia virus VHSV)in fish,colloidal gold particles were prepared by trisodium citrate reduction method. Monoclonal antibodies(MAb)10A7 labeled with purified VHSV G protein were used as the capture antibodies. The purified MAb 10EN monoclonal antibody against VHSV N protein and sheep anti mouse IgG antibody were coated on nitrocellulose membrane,as a test strip and a quality control band. The colloidal gold immunochromatographic strip was prepared by optimizing the experimental conditions. The colloidal gold strip was used to detect VHSV infected CHSE cell cultures. The results showed that red lines appeared in the detection line and the quality control line,while the healthy CHSE cell culture control only appeared red stripe in the quality control line. The detection limit of the strip was 104.0TCID50VHSV. Three different batch of the strips were selected randomly,and test on samples of positive samples and negative were repeated,but no difference were found. Specificity tests showed that there was no cross reaction between the test strips and infectious Haematopoietic necrosis virus(IHNV),infectious pancreatic necrosis virus(IPNV),Spring viremia of carp virus(SVCV),Rhabdovirus olivacens virus(HRV) and Grass carp reovirus virus(GCRV). After different time under the 4 ℃ condition,the testing results showed that the same batch of strip remained good stability during six months.The test strip was specific,sensitive and reproducible,which could be of great significance for the on-site testing.
VHSV;colloidal gold;immunochromatography
S852.65
A
1005-944X(2017)12-0092-06
10.3969/j.issn.1005-944X.2017.12.026
quot;十二五quot;国家科技支撑计划(2013BAD12B02-03)
岳志芹

