十二烷基二甲基甜菜碱协助泡沫分离虎杖中白藜芦醇
吕妍燕,刘伟,张梦微,田帅,吴兆亮
十二烷基二甲基甜菜碱协助泡沫分离虎杖中白藜芦醇
吕妍燕,刘伟,张梦微,田帅,吴兆亮
(河北工业大学化工学院,天津300130)
为了开发简单高效的从虎杖中提取白藜芦醇的方法,促进白藜芦醇的产业化应用,本文采用水提和泡沫分离相结合的方法,在泡沫分离过程中选用十二烷基二甲基甜菜碱作为捕获剂,泡沫分离虎杖浸提液中白藜芦醇。研究了椭球型泡沫分离塔、pH、十二烷基二甲基甜菜碱浓度、气体体积流量对泡沫分离白藜芦醇分离效率的影响,并对分离前后白藜芦醇的抗氧化性进行了研究。结果表明,采用椭球型泡沫分离塔,在pH为3、十二烷基二甲基甜菜碱浓度1.50g/L以及气体体积流量20mL/min的条件下,白藜芦醇富集比和回收率分别为8.43和 81.73%,消泡液中白藜芦醇浓度为0.085g/L,而且泡沫分离过程中能有效保持白藜芦醇的生物活性。
虎杖;白藜芦醇;分离;表面活性剂;泡沫;富集比;回收率
白藜芦醇,化学名称3,5,4´-三羟基二苯乙烯,是植物为防止霉菌感染而分泌的一种天然多酚类物质。白藜芦醇具有多种药理活性,如抗氧化、抗肿瘤、降低血小板聚集、预防和治疗动脉粥样硬化及心脑血管疾病等[1-4]。近年来,将白藜芦醇这一天然物质应用于医药、食品加工特别是生物农药和护肤用品等领域,引起了学者及企业家的广泛关注。白藜芦醇主要存在于蓼科植物虎杖的根茎中。因此开发简单高效的方法从虎杖中提取白藜芦醇具有重要意义。
从虎杖中提取白藜芦醇过程主要涉及虎杖浸提[5-8]和白藜芦醇纯化步骤(比如树脂吸附)[9-10]。由于浸提液中白藜芦醇浓度低,杂质浓度高,直接用浸提液进行纯化白藜芦醇效率低。为了提高白藜芦醇的纯化效率,开发浸提液中的白藜芦醇富集技术很重要。泡沫分离具有设备简单、能耗低、易放大和环境友好等优点,特别适合低浓度目标物质的富集[11-12]。该技术以气泡作为分离介质,基于物质之间在气液界面上吸附性能的差异实现分离,并达到富集的目的[13-16]。
对于本身无表面活性的物质,通常加入合适的表面活性剂,利用表面活性剂作为捕获剂通过电荷作用或化学反应与目标物质结合从而达到富集目标物质的目的,如回收大豆异黄酮和番茄红素[17-18]。适宜的表面活性剂的选取至关重要,本文选取的十二烷基二甲基甜菜碱在酸性和碱性条件下都具有优良的表面活性,且具有对皮肤刺激小和生物降解性好等优点,作为起泡剂和乳化剂已经广泛用于化妆品、清洁制品、农药和印染工业等[19-20]。因此本文以十二烷基二甲基甜菜碱作为捕获剂,从虎杖浸提液中富集白藜芦醇,研究分离塔塔型、pH、十二烷基二甲基甜菜碱的加入量及气体体积流量对富集效果的影响,并对比富集前后白藜芦醇的抗氧化性,旨在为进一步开发利用白藜芦醇这一天然物质提供依据。
1 材料与方法
1.1 材料与试剂
虎杖饮片,天津市本草堂药店。粉碎后过筛(0.40mm),粉末置于棕色瓶中低温避光保存。
试剂和药品:磷酸、无水乙醇、乙酸钠、冰乙酸、盐酸、氯化铁、硫酸亚铁,天津市风船化学试剂有限公司;十二烷基二甲基甜菜碱(BS-12),临沂绿森化工有限公司;色谱级甲醇和乙腈,天津市康科德科技有限公司,用于配制流动相;白藜芦醇标准品,上海阿拉丁生化科技股份有限公司;2,4,6-三吡啶基三嗪(TPTZ),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
PHS-3C型pH计,杭州奥立龙仪器有限公司;FA1204B型电子天平,上海精密科学仪器有限公司;Agilent 1100高效液相色谱仪,美国安捷伦科技有限公司;Vector-22型傅里叶红外光谱仪,德国布鲁克公司;FD-1A-50型真空冷冻干燥机,北京博医康实验仪器有限公司;TDZ5-WS型离心机,长沙湘仪离心机技术有限公司;DFA100型泡沫分析仪,德国克吕士公司。
1.3 虎杖浸提液的制备
称取一定量的虎杖粉末置于具塞锥形瓶中,加入20倍质量的蒸馏水,于40℃下超声(53kHz)浸提2h,冷却至室温后于4500r/min下离心10min,取离心后上清液即为获得的虎杖浸提液。
1.4 白藜芦醇浓度的测定
通过高效液相色谱仪(Agilent 1100)测定白藜芦醇的浓度,采用DiamonsilTMC18(250mm×4.6mm,5μm),以甲醇/0.1%磷酸水溶液/乙腈(45∶45∶10,体积比)为流动相,在检测波长306nm、柱温30℃、流动相流速0.8mL/min的条件下,得到白藜芦醇峰面积()与浓度(,g/L)的标准曲线为:=67545+41.51,2=0.9999。
1.5 泡沫分离装置及分离效果评价参数
泡沫分离装置由泡沫分离塔、空气压缩机、转子流量计、缓冲瓶、气体分布器、截水阀和泡沫收集器组成。泡沫分离塔分为实验塔和对照塔(如图1所示)。实验塔是椭球型塔,它是由玻璃管制成,高800mm,内径40mm,内部烧结一个椭球型通道,通道最大内径80mm,长度300mm,椭球形通道距离柱底400mm;对照塔是与实验塔具有相同高度(800mm)、相同内径(40mm)但却无内部椭球型通道的玻璃直塔。空气由压缩机泵入,经转子流量计调节,通过塔底安置的一个由孔径为0.42mm的烧结玻璃制成的气体分布器鼓入泡沫分离塔内。泡沫由泡沫分离塔顶部流入到泡沫收集器进行机械破泡,获得的液体即为消泡液。

图1 泡沫分离装置图
1—空气压缩机;2—缓冲瓶;3—转子流量计;4—截水夹; 5—气体分布器;6—实验塔;7—对照塔;8—消泡液收集器
泡沫分离对虎杖浸提液中白藜芦醇的分离效率通过富集比()和回收率(,%)进行评价,具体表达式如式(1)和式(2)所示。

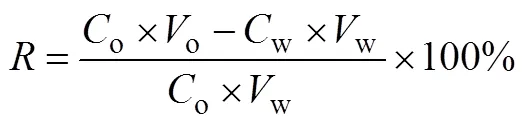
式中,o、w分别为原料液和残液中白藜芦醇的浓度,g/L;o、w、f分别为原料液、残液和消泡液的体积,L。
1.6 抗氧化性检测
抗氧化性检测用铁离子还原/抗氧化能力分析法(FRAP法)[21-22]。
取一定体积的原液和消泡液经冷冻干燥后获得的粉末经相同体积的甲醇溶液萃取后,经5000r/min离心6min,留取上清液。分别取甲醇溶液、原液、消泡液各1mL,加入6mL FRAP溶液,混合均匀后反应10min,其中以加入甲醇的溶液作为空白对照于593nm紫外波长下测定吸光值,实验重复3次,取平均值。抗氧化性强弱以FeSO4还原所需的毫摩尔数对应的紫外吸光值大小来表示。
1.7 数据统计分析
本文的每个数据点均重复至少3次实验,最终的实验数据是多次重复实验结果的算数平均值,并且实验误差由误差棒表示。
2 实验结果与讨论
2.1 泡沫分离虎杖中白藜芦醇工艺
2.1.1 实验塔对白藜芦醇分离效率的影响
研究结果表明,实验塔能有效强化排液,从而提高被分离物质的富集比[23]。在本节中,研究实验塔在泡沫分离富集虎杖中白藜芦醇富集比和回收率的影响。量取虎杖浸提液200mL,在十二烷基二甲基甜菜碱浓度为1.15g/L、气体体积流量15mL/min、分布器40目和pH为5的条件下进行实验,得到的实验结果如表1所示。

表1 实验塔对白藜芦醇富集比和回收率的影响
由表1结果表明,与对照塔相比采用实验塔时藜芦醇富集比明显提高,由1.51提高至10.48,而回收率有所降低,由95.01%下降至89.51%。这是因为实验塔强化了排液过程[24],泡沫相持液量降低,使得消泡液中白藜芦醇浓度增加,因此白藜芦醇的富集比提高。同时,在排液过程中,更多白藜芦醇会随部分间隙液一同回流到主体液中,从而从残液排出,造成消泡液中白藜芦醇总量降低,所以白藜芦醇回收率有小幅度下降。考虑到白藜芦醇的高富集比,以下实验均采用实验塔。
2.1.2 原料液初始pH对白藜芦醇分离效率的影响
为了研究白藜芦醇在不同pH的条件下的稳定性,将虎杖浸提液调至不同pH条件检测白藜芦醇的含量,得到的实验结果如图2所示。
图2结果表明在pH为2~7条件下白藜芦醇稳定,在pH>7的条件下不利于白藜芦醇的稳定,因此,以下实验均在pH 2~7条件下进行。
量取虎杖浸提液200mL,在十二烷基二甲基甜菜碱浓度为1.50g/L、气体体积流量为15mL/min、分布器40目和pH为2~7的条件下,得到pH对白藜芦醇富集比和回收率的影响,得到的实验结果如图3所示。

图2 pH对白藜芦醇稳定性的影响

图3 pH对白藜芦醇富集比和回收率的影响
原料液的pH是影响泡沫分离目的物质分离效率的重要影响因素[25]。图3结果表明随着虎杖浸提液pH从3增加到7,白藜芦醇的富集比下降,由10.12降低至1.89,回收率升高,由67.81%提高至87.83%。这是由于白藜芦醇有3个羟基,显弱酸性,溶解度随着pH的增加而增加[25]。低的溶解度有利于十二烷基二甲基甜菜碱和白藜芦醇的结合物吸附在气泡表面上,从而导致白藜芦醇的富集比升高,回收率降低。pH为2和pH为3的白藜芦醇富集比和回收率相差小,所以合适的pH为3。
2.1.3 十二烷基二甲基甜菜碱的浓度对白藜芦醇分离效率的影响
表面活性剂的加入量也是影响泡沫分离目标物质富集比和回收率的一个重要因素,所以这节研究原料液中十二烷基二甲基甜菜碱浓度对白藜芦醇富集比和回收率的影响。量取虎杖浸提液200mL,在气体体积流量为15mL/min、分布器40目、pH为3和十二烷基二甲基甜菜碱浓度为1.00~2.25g/L的条件下进行实验,得到的实验结果如图4所示。

图4 十二烷基二甲基甜菜碱的浓度对白藜芦醇富集比和回收率的影响
由图4结果表明,随着十二烷基二甲基甜菜碱浓度的逐渐增加,白藜芦醇的富集比降低,回收率升高。当十二烷基二甲基甜菜碱的浓度由1.00g/L升高到2.25g/L时,白藜芦醇的富集比由12.96降低至5.29,白藜芦醇的回收率由66.43%提高至92.80%。在虎杖浸提液中白藜芦醇浓度一定的前提下,随着十二烷基二甲基甜菜碱浓度的增加,十二烷基二甲基甜菜碱与白藜芦醇的结合物浓度增加,有利于更多的白藜芦醇分子吸附在气液界面上,使得白藜芦醇的回收率升高,但同时由于十二烷基二甲基甜菜碱的浓度增加,泡沫稳定性增加,从而不利于泡沫相排液,泡沫持液量随之增加,从而使得白藜芦醇的富集比降低。综合考虑白藜芦醇的富集比和回收率,合适的十二烷基二甲基甜菜碱浓度为1.50g/L。
2.1.4 气体体积流量对白藜芦醇分离效率的影响
气体体积流量的大小直接影响气泡在泡沫相的停留时间从而影响泡沫相中泡沫排液和影响目标物质的分离效率[26]。量取虎杖浸提液200mL、十二烷基二甲基甜菜碱浓度为1.50g/L、分布器40目和pH为3的条件下于不同气体体积流量下进行实验,得到的实验结果如图5所示。

图5 气体体积流量对白藜芦醇富集比和回收率的影响
由图5结果表明,随着气体体积流量的增加,白藜芦醇的富集比逐渐降低,回收率逐渐增加。随着气体体积流量的增大,富集比从15.05下降至3.67,回收率从73.21%上升至92.30%。气体体积流量较低时,气泡在泡沫相的停留时间长,泡沫有足够的时间进行排液,泡沫相持液量低,所以白藜芦醇的富集比高,回收率低。气体体积流量增加,会产生更多气泡,从而夹带更多液体,而且气泡在泡沫相的停留时间以及间隙液的排液速率都会降低,此时,泡沫的持液量增加,消泡液的体积增加,所以富集比下降,回收率上升。综合考虑白藜芦醇富集比和回收率,合适的气体体积流量为20mL/min,得到的白藜芦醇富集比为8.43,白藜芦醇回收率为81.73%,消泡液中白藜芦醇的浓度为0.085g/L。
2.2 泡沫分离对白藜芦醇生物活性的影响
白藜芦醇是生物活性物质,因此为了探索泡沫分离对白藜芦醇生物活性的影响,这部分采用FRAP抗氧化法,研究上述合适泡沫分离条件下的原液和消泡液抗氧化性,结果如表2所示。
根据表2,采用FRAP法确定的白藜芦醇富集比和回收率与采用高效液相色谱仪确定的白藜芦醇的富集比和回收率基本相同,这个结果表明泡沫分离在对白藜芦醇进行有效分离的同时,还有效保持了白藜芦醇的生物活性。

表2 抗氧化性测定
3 结论
(1)选用环境友好型表面活性剂十二烷基二甲基甜菜碱协助泡沫分离虎杖浸提液中的白藜芦醇,采用椭球型泡沫分离塔,在pH为3、十二烷基二甲基甜菜碱浓度1.50g/L以及气体体积流量20mL/min的条件下,泡沫分离白藜芦醇的富集比和回收率分别为8.43和81.73%,其中,消泡液中白藜芦醇的浓度达到0.085g/L。
(2)白藜芦醇是非表面活性物质,白藜芦醇能够通过泡沫分离实现富集,正是因为十二烷基二甲基甜菜碱与白藜芦醇形成了结合物,并且以结合物的形式吸附在气液界面上,因此十二烷基二甲基甜菜碱是泡沫分离虎杖中白藜芦醇合适的捕获剂。
(3)抗氧化实验表明泡沫分离在对白藜芦醇进行有效分离的同时,还有效保持白藜芦醇的生物活性。
[1] 付元庆,李铎. 白藜芦醇[J]. 营养学报,2014,36(1):13-16.
FU Y Q,LI D. Reveratrol[J]. Acta Nutrimenta Sinica,2014,36(1):13-16.
[2] 韩雪莲. 白藜芦醇及其衍生物和类似物抗肿瘤研究进展[J]. 化工进展,2014,33(6):1526-1532.
HAN X L. Progress in anti-tumor research on resveratrol and its derivatives and analogues[J].Chemical Industry and Engineering Progress,2014,33(6):1526-1532.
[3] 李先宽,李赫宇,李帅,等. 白藜芦醇研究进展[J]. 中草药,2016,47(14):2568-2578.
LI X K,LI H Y,LI S,et al. Advances in study on resveratrol[J]. Chinese Traditional and Herbal Drugs,2016,47(14):2568-2578.
[4] 左惠荣,司瑞,党晶艺,等. 白藜芦醇对心肌微血管内皮细胞缺氧/复氧的保护及作用机制[J]. 中华临床医师杂志,2012,6(20):183-187.
ZUO H R,SI R,DANG J,et al. Protective effect and its mechanism of resveratrol on hypoxia/reoxygenation-induced apoptosis in cardiac microvascular endothelial cells[J]. Chinese Journal of Clinicians(Electronic Edition),2012,6(20):183-187.
[5] 张敏,曹庸,于华忠,等. 虎杖白藜芦醇提取工艺的初步研究[J]. 林产化工通讯,2004,38(3):6-9.
ZHANG M,CAO Y,YU H Z,et al. Preliminary study on extraction process of resveratrol from polygonum cuspidatum[J]. Journal of Chemical Industry of Forest Products,2004,38(3):6-9.
[6] 邓梦茹,刘韶,朱周觐. 酶法提取虎杖中的白藜芦醇[J]. 中南药学,2011(9):669-672.
DENG M R,LIU S,ZHU Z J. Optimization of resveratrol from Polygonum cuspidatum by enzyme-assisted extraction[J]. Central South Pharmacy,2011(9):669-672.
[7] 张琳虹. 虎杖有效成分的超临界二氧化碳萃取技术研究[J]. 中国药物与临床,2012,12(3):338-340.
ZHANG H L. The technology research of active ingredients from Polygonum cuspidatum by supercritical carbon dioxide[J]. Chinese Remedies and Clinics,2012,12(3):338-340.
[8] 张初署,禹山林,潘丽娟,等. 花生植株白藜芦醇提取工艺优化[J]. 农业工程学报,2009(s1):148-152.
ZHANG C S,YU S L,PAN L J,et al. Technology optimization for extraction of resveratrol from peanut plant[J]. Transactions of the Chinese Society of Agricultural Engineering,2009(s1):148-152.
[9] 李燕,刘军海. 大孔树脂对虎杖白藜芦醇的静态吸附动力学研究[J]. 食品与机械,2011(5):82-86.
LI Y,LIU J H. Study on the static adsorption kinetics of resveratrol from Polygonum cuspidatum sieb. et zucc by macroporous resin[J]. Food and Machinery,2011(5):82-86.
[10] 王莹,李梦耀,马岚,等. 虎杖中白藜芦醇的提取与纯化[J]. 应用化工,2014,43(1):128-131.
WANG Y,LI M Y,MA L,et al. Extraction and purification of resveratrol from Polygonum cuspidatum[J]. Applied Chemical Industry,2014,43(1):128-131.
[11] 常志东,刘会洲,陈家镛. 泡沫分离法的应用与发展[J]. 化工进展,1999,18(5):18-21.
CHANG Z D,LIU H Z,CHEN J Y. The application and development of foam separation[J]. Chemical Industry and Engineering Progress,1999,18(5):18-21.
[12] 谭相伟,吴兆亮,贾永生,等. 泡沫分离技术在蛋白质多元体系分离中的应用[J]. 化工进展,2005,24(5):510-513.
TAN X W,WU Z L,JIA Y S,et al. Application of separation in multicomponent mixture of proteins[J]. Chemical Industry and Engineering Progress,2005,24(5):510-513.
[13] 孙瑞娉,殷昊,卢珂,等. 两级泡沫分离废水中大豆蛋白的工艺[J]. 农业工程学报,2010(11):374-378.
SUN R P,YIN H,LU K,et al. Technology of soy protein separation from wastewater by two-stage foam fractionation[J]. Transactions of the Chinese Society of Agricultural Engineering,2010(11):374-378.
[14] BURGHOFF B. Foam fractionation applications[J]. Journal of Biotechnology,2012,161(2):126-137.
[15] 丁琳琳,王延吉,吴兆亮,等. 基于甘草配伍黄芩同时泡沫分离甘草酸和黄芩苷[J]. 化工学报,2017,68(1):170-177.
DING L L,WANG Y J,WU Z L,et al. Simultaneous separation of glycyrrhizic acid and baicalin by mixingwithusing foam fractionation[J]. CIESC Journal,2017,68(1):170-177.
[16] 杨向平,刘元东,秦海良,等. 大豆蛋白废水中乳清蛋白的泡沫分离实验[J]. 化工进展,2008,27(1):92-97.
YANG X P,LIU Y D,QIN H L,et al. Experimental research on recovery of lactoalbumin from soy protein wastewater by foam fractionation[J]. Chemical Industry and Engineering Progress,2008,27(1):92-97.
[17] JIANG J X,WU Z L,LIU W,et al. Separation of soybean saponins from soybean meal by a technology of foam fractionation and resin adsorption[J]. Preparative Biochemistry and Biotechnology,2016,46(4):346-353.
[18] LIU W,WU Z L,WANG Y J,et al. Rhamnolipid assisted recovery of lycopene from the tomato-based processing wastewater using foam fractionation[J]. Journal of Food Engineering,2015,164:63-69.
[19] CHEN Z G,DING W F,REN F L,et al. A simple and sensitive assay of nucleic acids based on the enhanced resonance light scattering of zwitterionics[J]. Analytica Chimica Acta,2005,550(1):204-209.
[20] ZHANG Z,WU Z L,LIU G M. Interfacial adsorption of methyl orange in liquid phase of foam fractionation using dodecyl dimethyl betaine as the collector[J]. Journal of Industrial and Engineering Chemistry,2015,28: 184-189.
[21] 牛鹏飞,仇农学,杜寅. 苹果渣中不同极性多酚的分离及体外抗氧化活性研究[J]. 农业工程学报,2008,24(3):238-242.
NIU P F,QIU N X,DU Y. Separation of polyphenols from apple pomace based on different polarities and their antioxidative activities[J]. Transactions of the Chinese Society of Agricultural Engineering,2008,24(3):238-242.
[22] 程雅芳,李全文,续颖,等. 花生茎中白藜芦醇的提取及体外抗氧化性的研究[J]. 食品工业科技,2011,32(7):144-146.
CHENG Y F,LI Q W,XU Y,et al. Study on extraction and antioxidant ability of resveratrol from peanut stem[J]. Science and Technology of Food Industry,2011,32(7):144-146.
[23] LI J,WU Z L,LI R. Technology of streptomycin sulfate separation by two-stage foam separation[J]. Biotechnology Progress,2012,28(3):733-739.
[24] LAMBERT W D,DU L P,MA Y F,et al. The effect of pH on the foam fractionation of β-glucosidase and cellulose[J]. Bio-resource Technology,2003,87(3):247-253.
[25] 张雅杰,佟连生,高敬茹,等. 两种芦丁提取方法pH值的比较研究[J]. 黑龙江医药科学,2008,31(3):44-44.
ZHANG Y J,TONG L S,GAO J R,et al. Study on two kinds of method to extract rutin comparing pH[J]. Heilongjiang Medicine and Pharmacy,2008,31(3):44-44
[26] LI H Z,WU Z L,LIU W,et al. Recovery of yam mucilage from the yam starch processing wastewater by using a novel foam fractionation column[J]. Separation and Purification Technology,2016,171:26-33.
Foam separation of resveratrol from: dodecyl dimethyl betaine as a collector
LÜ Yanyan,LIU Wei,ZHANG Mengwei,TIAN Shuai,WU Zhaoliang
(School of Chemical Engineering,Hebei University of Technology,Tianjin 300130,China)
To promote the industrialization of resveratrol application,the dodecyl dimethyl betaine (BS-12)was selected as collector to recover resveratrol fromleaching solution by foam separation. This paper studied the effects of ellipsoid type foam separation tower,pH,dodecyl dimethyl betaine concentration and volumetric air flow rate on resveratrol separation efficiency. The results showed that the suitable operation conditions wereleaching solution pH 3,the odecyl dimethyl betaine concentration 1.50g/L,and volumetric air flow rate 20mL/min. Under those operation conditions,the enrichment ratio and the recovery percentage of resveratrol were 8.43 and 81.73%,respectively. Then,the concentration of resveratrol in the foamate was 0.085 g/L. Furthermore,the biological activity of resveratrol could be kept during the process of foam separation.The present studies developed a green technology for effectively separating resveratrol fromleaching solution and then promoting the development and utilization of resveratrol.
;resveratrol;separation;surfactants;foam;enrichment ratio;recovery percentage
TQ9
A
1000–6613(2017)12–4601–06
10.16085/j.issn.1000-6613.2017-0560
2017-03-30;
2017-05-08。
河北省重点基础研究计划项目(16964002D)。
吕妍燕(1992—),女,硕士研究生。
吴兆亮,教授,研究方向为发酵与生物分离工程。E-mail: zhaoliangwu_ hebut@163.com。

