一种新型相变纳米微球增强高强度聚焦超声消融的实验研究
陈宗桂,张玉荣,刘 欢,罗 曼,王 琦,李发琪(重庆医科大学生物医学工程学院 省部共建国家重点实验室培育基地—重庆市超声医学工程重点实验室 重庆市生物医学工程学重点实验室 重庆市微无创医学协同创新中心,重庆 400016)
·基础与实验研究·
一种新型相变纳米微球增强高强度聚焦超声消融的实验研究
陈宗桂,张玉荣,刘 欢,罗 曼,王 琦,李发琪*
(重庆医科大学生物医学工程学院 省部共建国家重点实验室培育基地—重庆市超声医学工程重点实验室 重庆市生物医学工程学重点实验室 重庆市微无创医学协同创新中心,重庆 400016)
目的探讨脂质包裹1,1,2-三氯三氟乙烷相变纳米微球对高强度聚焦超声(HIFU)消融效果的影响。方法采用薄膜水化法制备脂质包裹1,1,2-三氯三氟乙烷相变纳米微球并检测其理化性质。通过离体及在体实验验证其对HIFU的增效作用。离体实验采用250 W、10 s的连续波辐照离体牛肝组织。在体实验采用200 W、5 s的连续波辐照活体新西兰大白兔的肝脏组织。测量、计算HIFU辐照后靶区的凝固性坏死体积、能效因子(EEF)及强回声区体积,并进行统计分析。结果相变纳米微球在溶液中呈球状、均匀分布,粒径均一。离体实验显示,注射有纳米微球的牛肝组织HIFU辐照后凝固性坏死体积、EEF及强回声区体积均大于未经处理的牛肝组织(t=28.80、19.55、14.30,P=0.01、0.02、0.02)。在体实验显示,注射有纳米微球的新西兰大白兔肝组织HIFU辐照后凝固性坏死体积、EEF及强回声区体积均大于对照组(t=9.41、13.52、15.67,P=0.02、0.01、0.01)。结论脂质包裹1,1,2-三氯三氟乙烷相变纳米微球可明显提高HIFU消融效率。
声液滴汽化;声空化;生物学效应;1,1,2-三氯三氟乙烷
作为一种无创消融肿瘤技术[1-4],高强度聚焦超声(high intensity focused ultrasound, HIFU)具有广泛应用前景。但HIFU消融体积较大或位置深在肿瘤所需时间较长,明显增加了HIFU治疗的风险。改变组织的声环境可明显增强HIFU消融[5-6]。鉴于此,有学者[7-9]采用超声微泡造影增强HIFU消融。然而,微泡在人体内循环的半衰期较短(<10 min),消融较大的肿瘤时需多次注射超声微泡造影剂,可增加多重感染的风险,且微泡可能对组织造成不可预测的损伤。有研究[10-12]表明,脂质包裹相变纳米微球可明显增强HIFU消融效果。然而,传统的氟碳增效剂仍存在不足,如全氟戊烷的沸点低、性质不稳定、易造成血管栓塞,而全氟己烷沸点太高,增强HIFU消融效果不理想等。1,1,2-三氯三氟乙烷无毒、稳定性高,沸点47.57 ℃,介于全氟戊烷与全氟己烷之间。本研究将脂质包裹1,1,2-三氯三氟乙烷组成相变微球,探讨其对HIFU消融效果的影响。
1 材料与方法
1.1 相变纳米微球制备 将10 mg棕榈酰磷脂酰胆碱(1,2-dihexadecanoyl-rac-glycero-3-phosphocholine, DPPC;Avanti公司)、4 mg二棕榈酰磷脂酰乙醇胺(1, 2-distearoyl-sn-glycero-3-phosphoethanolamine, DSPE;Avanti公司)、3 mg 1,2-棕榈酰磷脂酰甘油[1, 2-dipalmitoyl-sn-glycero-3-phospho-(1'-rac-glycerol), DPPG;Avanti公司]、3 mg胆固醇及10 ml氯仿均匀混合后,采用RE-52B型旋转蒸发仪(上海亚荣生化公司)对盛有混匀溶液的烧瓶置于低压加热蒸发,直至有均匀的脂质薄膜生成。然后向烧瓶中加入4 ml磷酸盐缓冲液(phosphate buffered saline, PBS;pH值7.4),摇匀。当脂质薄膜完全溶解后,将溶液倒入试管,并将试管置于盛有碎冰的烧杯中。将200 μl液态1,1,2-三氯三氟乙烷加入试管中。采用Sonics VCX 150型超声处理器(声功率130 W,处理时间120 s,超声频率20 kHz,占空比70%)对溶液进行乳化后制得脂质包裹相变纳米微球,并将相变纳米微球溶液于4℃冰箱中保存、备用。
1.2 相变纳米微球性质检测 以PBS稀释相变纳米微球溶液后,采用Olympus CKX-41型倒置荧光显微镜观察其形态、大小及分布。采用Malvern激光粒径测量仪检测相变纳米微球的平均粒径。
1.3 HIFU辐照
1.3.1 离体实验 选用新鲜的离体牛肝,在8 h内进行离体实验。将注射1 ml相变纳米微球的新鲜离体牛肝作为实验组(离体实验组),未做任何处理的新鲜离体牛肝作为空白对照组(离体空白对照组)。HIFU辐照前,将两组牛肝组织放入真空泵中脱气约1 h。将牛肝组织的包膜正对HIFU换能器,采用海扶JC-200型HIFU治疗仪,以250 W、10 s的连续波对牛肝组织进行辐照,换能器的几何焦点距离牛肝包膜约20 mm。辐照结束后,通过Jupiter F软件测量牛肝组织凝固性坏死体积,并计算EEF。EEE=P×T/V,其中P为声功率,T为辐照时间,V为凝固性坏死体积。并通过HIFU治疗仪自带的软件对比分析辐照前后离体牛肝组织回声变化。
1.3.2 在体实验 选用新西兰大白兔8只(重庆医科大学动物实验中心提供),雌雄不限,体质量2.0~2.5 kg,平均(2.25±0.75)kg。整个实验过程经本院动物伦理委员会批准通过(批准号:SCXK 2012-0001)。实验前对所有动物停饲24 h,停饮6 h。随机分为2组,每组4只。对实验组(在体实验组)经耳缘静脉注射1 ml纳米微球,空白对照组(在体空白对照组)不做任何处理。将3 g戊巴比妥钠加入100 ml生理盐水中用于麻醉,剂量1 ml/kg体质量。经兔耳缘静脉注射纳米微球。对在体实验组于注射纳米微球后5 min通过B超确定其肝脏位置,并以200 W、5 s的连续波进行HIFU辐照。对在体空白对照组于相应时间以相同辐照条件进行HIFU辐照。辐照结束后4天处死实验兔,取出兔肝组织。通过Jupiter F软件测得兔肝组织凝固性坏死体积并计算EEF。并通过HIFU治疗仪自带的软件对比分析辐照前后在体兔肝组织的回声变化。
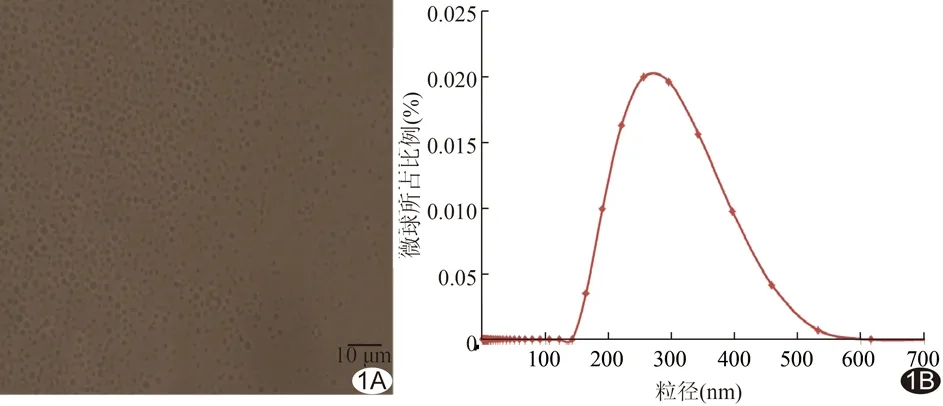
图1 相变纳米微球的理化性质 A.倒置荧光显微镜下观察相变纳米微球形态(×400); B.激光粒径测量仪检测纳米微球粒径
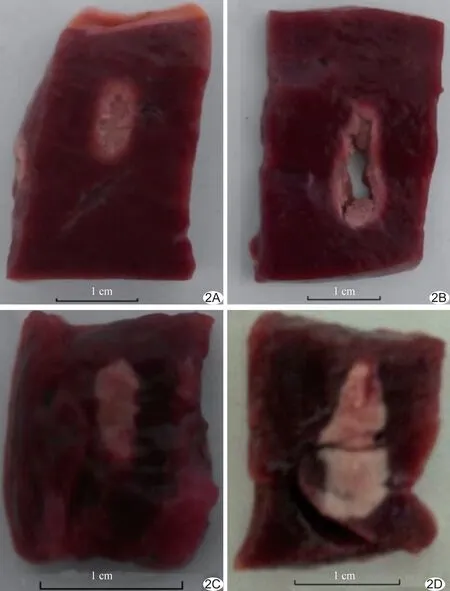
图2 HIFU辐照后凝固性坏死情况 A、B.以250 W、10 s辐照注射有相变纳米微球(A)及未经任何处理(B)的离体牛肝组织; C、D.以200 W、5 s辐照注射有相变纳米微球(C)及未经任何处理(D)的在体兔肝组织
1.4 统计学分析 采用SPSS 19.0统计分析软件,计量资料以±s表示。采用独立样本t检验比较离体及在体实验中各组凝固性坏死体积、EEF和强回声区体积的差异。P<0.05为差异有统计学意义。
2 结果
采用薄膜水化法制得的相变纳米微球,其溶液呈乳白色。静置约1 h后分层,上层为透明液体,下层为乳白色沉淀。荧光显微镜下观察,微球成球状均匀分布在溶液中(图1A)。Malvern激光粒径测量仪测得脂质包裹1,1,2-三氯三氟乙烷微球粒径为(268.25±50.69)nm(图1B)。
2.1 离体实验结果 HIFU辐照结束后,沿声轴方向切开牛肝组织,肉眼可见牛肝组织的坏死区域成椭球形,边界清晰,且离体实验组坏死区域大于空白对照组、坏死程度高于空白对照组(图2A、2B)。离体实验组牛肝组织凝固性坏死体积为空白对照组的2.41倍,EEF为空白对照组2.30倍;离体实验组牛肝组织凝固性坏死体积及EEF[(747.05±215.08)mm3、(3.53±0.72)J/mm3]均明显大于空白对照组[(310.50±22.69)mm3、(8.09±0.57)J/mm3;(t=28.80、19.55,P=0.01、0.02)],见图3。HIFU辐照结束后,离体实验组及空白对照组均出现强回声区(图4)。离体实验组牛肝组织强回声区体积为空白对照组的1.95倍;离体实验组强回声区体积[(144.85±19.99)mm3]明显大于空白对照组[(74.00±15.17)mm3;t=14.30,P=0.02],见图5。

图4 HIFU辐照前后离体牛肝组织B超图像 A、B.未经任何处理的离体牛肝组织HIFU辐照前(A)和辐照后(B)B超图像; C、D.注射纳米微球的离体牛肝组织HIFU辐照前(C)和辐照后(D)B超图像 图5 HIFU辐照后B超显示强回声区体积 (黑色表示离体牛肝组织强回声区体积;红色表示在体兔肝组织强回声区体积;*:P<0.05) 图6 HIFU辐照后在体兔肝组织凝固性坏死体积及EEF (黑色表示兔肝组织凝固性坏死体积;红色表示兔肝组织EEF;*:P<0.05)

图3 HIFU辐照后离体牛肝组织凝固性坏死体积及EEF (黑色表示牛肝组织凝固性坏死体积;红色表示牛肝组织EEF;*:P<0.05)
2.2 在体实验结果 兔肝组织损伤情况见图2C、2D。在体实验组兔肝组织凝固性坏死体积为空白对照组的5.26倍,EEF为空白对照组的5.08倍;在体实验组兔肝组织凝固性坏死体积及能效因子[(355.99±82.45)mm3、(2.95±0.72)J/mm3]均明显大于空白对照组[(67.67±7.98)mm3、(14.98±1.98)J/mm3;(t=9.41、13.52,P=0.02、0.01)],见图6。HIFU辐照结束后,在体实验组及空白组兔肝组织均出现强回声区(图7)。在体实验组兔肝组织强回声区体积为空白对照组的2.67倍;在体实验组强回声区体积[(44.73±7.94)mm3]明显大于空白组[(16.75±2.22)mm3;(t=15.67,P=0.01)],见图5。
3 讨论
HIFU消融治疗体积较大的实体肿瘤时常采用大辐照剂量和长辐照时间,但在HIFU治疗过程中易引起皮肤灼伤等一系列并发症。如何有效提高HIFU的治疗效率一直是HIFU研究的热点问题[13-14]。超声微泡造影剂对提高HIFU疗效具有重要作用[15-16]。作为一种空化核,超声微泡造影剂能够明显降低靶区组织的空化阈值,增加组织凝固性坏死体积。但微泡粒径过大、穿透性差、血液循环时间短和损伤体积不可控等缺点限制了HIFU在临床的进一步应用。而脂质包裹相变微球具有强穿透性、高稳定性,存在时间较长等优点。本研究制备脂质包裹1,1,2-三氯三氟乙烷相变纳米微球,相变温度为47.57 ℃,粒径为(268.25±50.69)nm。肿瘤血管壁的空隙为380~780 nm,且肿瘤组织淋巴回流受阻;因此,相变纳米微球可自由通过血管积聚在肿瘤组织。HIFU辐照时,脂质包裹相变微球只在换能器的焦点处相变,微球与声波的相互作用加剧了能量的沉积,从而使组织的损伤形状在空间上可控。本研究在实验过程中,为降低水温和溶氧量对实验结果造成的影响,每隔30 min自动换水,并通过水处理器对水进行脱气。

图7 HIFU辐照前后在体兔牛肝组织B超图像 A、B.未经任何处理的新西兰大白兔HIFU辐照前(A)及辐照后(B)B超图像; C、D.注射纳米微球的新西兰大白兔HIFU辐照前(7C)及辐照后(7D)B超图像
本实验以脂质包裹1,1,2-三氯三氟乙烷组成的相变微球作为增效剂,通过离体及在体实验对其增强HIFU辐照效果的作用进行验证,结果表明该相变微球具有良好的生物安全性及稳定性。离体实验和在体实验中,实验组HIFU辐照后的凝固性坏死体积均大于空白对照组。但在离体实验中,发现实验组个别牛肝组织发生凝固性坏死的体积明显不同于组中其他离体牛肝组织,分析原因可能包括:①将纳米微球注射进离体牛肝组织时,在组织中留下针孔,HIFU辐照过程中辐射力推动纳米微球沿针孔外流,造成靶区纳米微球的浓度分布不均,导致靶区能量沉积不均匀、损伤范围不一致;②靶区附近存在毛细血管而B超未显示,微球沿毛细血管流失,导致HIFU消融效果不明显。
总之,本实验通过薄膜水化法制备粒径为(268.25±50.69)nm的相变微球。通过离体和在体实验,初步证实脂质包裹1,1,2-三氯三氟乙烷对HIFU具有增效作用,有助于提高HIFU介导消融效率,缩短治疗时间。
[1] Al-Bataineh O, Jenne J, Huber P. Clinical and future applications
of high intensity focused ultrasound in cancer. Cancer Treat Rev, 2012,38(5):346-353.
[2] Halpern EJ. Science to Practice: High-intensity focused ultrasound ablation:Will image-guided therapy replace conventional surgery? Radiology, 2005,235(2):345-346.
[3] Lukka H, Waldron T, Chin J, et al.High-intensity focused ultrasound for prostate cancer: A systematic review. Clinical Oncology, 2011,23(2):117-127.
[4] Zhang L, Chen WZ, Liu YJ, et al. Feasibility of magnetic resonance imaging-guided high intensity focused ultrasound therapy for ablating uterine fibroids in patients with bowel lies anterior to uterus. Eur J Radiol, 2010,73(2):396-403.
[5] 张奕,邹建中.改变组织声环境增强HIFU能量沉积的研究现状.中国医学影像学杂志,2010,18(2):191-192.
[6] 唐瑞遥,陈锦云.改变组织声环境增效高强度聚焦超声方法研究进展.现代医药卫生,2015,31(11):1635-1637.
[7] Jiang N, Xie B, Zhang X, et al.Enhancing ablation effects of a microbubble-enhancing contrast agent ("SonoVue") in the treatment of uterine fibroids with high-intensity focused ultrasound: A randomized controlled trial. Cardiovasc Intervent Radiol, 2014,37(5):1321-1328.
[8] Zhang P, Kopechek JA, Porter TM. The impact of vaporized nanoemulsions on ultrasound-mediated ablation. J Ther Ultrasound, 2013,1(1):1-13.
[9] Moyer LC, Timbie KF, Sheeran PS, et al. High-intensity focused ultrasound ablation enhancement in vivo via phase-shift nanodroplets compared to microbubbles. J Ther Ultrasound, 2014,3(1):1-9.
[10] 李兴,李非,易良波,等.相变纳米微球和微泡增强HIFU在体模中所致凝固性坏死的对比.中国介入影像与治疗学,2015,12(7):441-444.
[11] You Y, Wang Z, Ran H, et al. Nanoparticle-enhanced synergistic HIFU ablation and transarterial chemoembolization for efficient cancer therapy. Nanoscale, 2016,8(7):4324-4339.
[12] Zhang X, Zheng Y, Wang Z, et al. Methotrexate-loaded PLGA nanobubbles for ultrasound imaging and synergistic targeted therapy of residual tumor during HIFU ablation. Biomaterials, 2014,35(19):5148-5161.
[13] 易良波,王琦,王智彪,等.对比观察Sono Vue与包裹全氟戊烷的介孔二氧化硅纳米微球在蛋清体模中的高强度聚焦超声增效作用.中国介入影像与治疗学,2014,11(2):103-106.
[14] 钟志强,陈首名,李非,等.MRI监控高强度聚焦超声联合Sono Vue损伤山羊肝脏组织的增效研究.中国介入影像与治疗学,2015,12(9):559-562.
[15] Zhao DW, Tian M, Zou JZ, et al. Effects of non-focused microbubble-enhanced and high-intensity focused ultrasound on hemostasis in a rabbit model of liver trauma. Ultrasound Med Biol, 2017,43(3):629-639.
[16] Elbes D, Denost Q, Laurent C, et al. Pre-clinical study of in vivo magnetic resonance-guided bubble-enhanced heating in pig liver. Ultrasound Med Biol, 2013,39(8):1388-1397.
Experimentalstudyofanovelphasechangenanodropletsenhancedhighintensityfocusedultrasoundablation
CHENZonggui,ZHANGYurong,LIUHuan,LUOMan,WANGQi,LIFaqi*
(StateKeyLaboratoryofUltrasoundEngineeringinMedicineCo-foundedbyChongqingandtheMinistryofScienceandTechnology,ChongqingKeyLaboratoryofUltrasoundinMedicineandEngineering,CollegeofBiomedicalEngineering,ChongqingMedicalUniversity,ChongqingCollaborativeInnovationCenterforMinimally-invasiveandNoninvasiveMedicine,Chongqing400016,China)
ObjectiveTo investigate the effect of lipid encapsulated 1,1,2- trichlorotrifluoroethane phase change nanodroplets for high intensity focused ultrasound (HIFU) ablation.MethodsThe lipid encapsulated 1,1,2- trichlorotrifluoroethane phase change nanodroplets was prepared with membrane hydration method, and its physicochemical properties were examined. The synergistic effect of HIFU ablation was verified with experiments in vitro and in vivo experiments. For in vitro experiment, the isolated bovine liver tissues were irradiated with HIFU (250 W, 10 s, continuous wave). For in vivo experiment, the livers of New Zealand rabbits were irradiated with HIFU (200 W, 5 s, continuous wave). The volume of coagulative necrosis, energy efficiency factors (EEF) and the volume of the hyperechoic area after HIFU radiation were measured. And the statistical analysis was performed.ResultsPhase change nanoparticles were spherical in solution and uniform in size. For in vitro experiment, the coagulative necrosis volume, EEF and hyperechoic area of bovine liver tissue injected with nanodroplets were significantly higher than those of untreated bovine liver tissue (t=28.80, 19.55, 14.30;P=0.01,0.02,0.02) after HIFU. For in vivo experiment, the coagulative necrosis volume, EEF and hyperechoic area of rabbit liver tissue injected with nanodroplets were significantly higher than those of untreated rabbit liver tissue (t=9.41, 13.52, 15.67;P=0.02, 0.01, 0.01) after HIFU.ConclusionThe lipid encapsulated 1,1,2- trichlorotrifluoroethane phase change nanodroplets can significantly improve the efficiency of HIFU ablation significantly.
Acoustic droplet vaporization; Acoustic cavitation; Bioeffects; 1,1,2- trichlorotrifluoroethane
国家自然科学基金(11574039、11274404)。
陈宗桂(1989—),男,福建莆田人,在读硕士。研究方向:超声生物学效应。E-mail: zonggui1129@163.com
李发琪,重庆医科大学生物医学工程学院 省部共建国家重点实验室培育基地—重庆市超声医学工程重点实验室 重庆市生物医学工程学重点实验室 重庆市微无创医学协同创新中心,400016。E-mail: lifaqi70@163.com
2017-07-04
2017-08-18
10.13929/j.1672-8475.201707005
R-332; R445.1
A
1672-8475(2017)12-0757-06

