干旱胁迫对桃叶杜鹃菌根苗叶肉细胞超微结构的影响1)
熊贤荣 欧静 龙海燕 欧阳嘉晖 熊丹
(贵州大学,贵阳,550025)
干旱胁迫对桃叶杜鹃菌根苗叶肉细胞超微结构的影响1)
熊贤荣 欧静 龙海燕 欧阳嘉晖 熊丹
(贵州大学,贵阳,550025)
为了探明ERM真菌在干旱胁迫时对桃叶杜鹃叶肉细胞超微结构的影响,在温室大棚内,采用盆栽控水法对分别接种两种ERM真菌(TY29、TY35)的桃叶杜鹃1年生幼苗进行干旱胁迫处理,以不接种真菌的为对照,在透射电镜下观测不同水分处理下接菌苗与对照苗叶肉细胞超微结构的变化。结果表明:在正常水分条件下,各处理桃叶杜鹃幼苗的叶肉细胞结构相同,细胞完整。随着干旱程度的加深,各处理细胞的叶绿体和线粒体的受损程度都逐渐增大,但在相同水分胁迫下,接种ERM菌根真菌的桃叶杜鹃幼苗的线粒体和叶绿体等细胞器的完整程度要高于对照,细胞器受损害程度更小,具有较好的抗旱能力,其中接种TY35对桃叶杜鹃叶肉细胞的作用更明显。
桃叶杜鹃;ERM真菌;干旱胁迫;超微结构
随着全球气候变暖,干旱灾害频繁发生,植物的生长受到限制,植物如何在干旱环境中生存正成为研究热点,有研究表明菌根真菌能与植物根系形成互惠共生体,对植物的生长发育和抗逆性有积极的影响,在改善植物水分代谢和提高植物耐旱性中发挥了重要作用[1]。随着菌根真菌对植物的有益作用被研究的越来越多,其提高植物耐旱性作用也逐渐受到关注。
杜鹃花是我国传统名花,有“花中西施”的美称,高山杜鹃是其重要的类别之一,因其花序巨大,色彩鲜艳,株型美观且叶常绿不凋而深受人们喜爱,可作为园林景观、庭院栽培和盆花销售,是城市园林景观建设的优良资源,国内高山杜鹃种质资源丰富,但可应用栽培的种类少。桃叶杜鹃(RhododendronannaeFranch.)是高山杜鹃的代表种,其花色艳丽,花期5—7月,是一种观赏价值较高的晚花类杜鹃,在景观应用上有巨大的市场潜力[2],但其喜凉爽湿润气候,耐旱性较弱,制约其引种栽培,而接种杜鹃花类菌根(ERM),对杜鹃花类植物克服恶劣环境、加强养分吸收起到重要的作用。欧静等发现接种ERM显著提高桃叶杜鹃幼苗的苗高、地径、叶面积、主根长和生物量等,同时接种真菌后,桃叶杜鹃种子萌发时间有所提早,繁殖系数有较大提高[3-4]。本研究采用透射电子显微镜对干旱胁迫下桃叶杜鹃幼苗叶肉细胞超微结构进行观察,并设置不接种菌株的对照组CK,从微观方面上更加深入了解ERM对植株作用,为ERM提高植物抗旱性研究提供一定的理论依据。
1 材料与方法
供试土壤按照V(腐殖质)∶V(石英砂)=3∶1的比例混匀后,经121 ℃高温高压蒸汽灭菌2 h,灭菌后测得其土壤理化性质为:pH=4.77,有机质质量分数44.15 g/kg,全氮质量分数1.56 g/kg,全磷质量分数0.161 g/kg,有效磷质量分数7.04 mg/kg,碱解氮质量分数268.55 mg/kg,速效钾质量分数205.91 mg/kg。
供试植物为1年生桃叶杜鹃实生苗。采用播种繁殖,播种方法采用撒播,每盆100粒。供试的2个菌株为前期从野生桃叶杜鹃根系分离并筛选出的综合促生能力和侵染率较强的2个菌株[4-5]:TY29(AB158314:Trametesochracea),TY35(AB378554:Pochoniabulbillosa)(括号中前者为国际GenBank中的登录号,后者为与试验菌株亲缘关系最近种),由课题组分离保存。采用PDA液体培养基对试验菌株进行培养,置于摇床上28 ℃振荡(160 r/min)暗培养15 d,打碎并制成液体菌剂备用。
于2015年12月播种后放入人工气候箱内恒温培养(昼夜都为25 ℃,湿度90%、光照12 h)。2016年4月,将桃叶杜鹃幼苗移出人工气候培养箱,移栽至花盆中,每盆移植1株,栽植塑料花盆规格为90 cm×60 cm×80 cm,每盆装灭菌土20 g,于2016年4月12日,每株幼苗根部各施入菌液5 mL,CK苗浇5 mL不含菌液的PDA液体培养基。在贵州大学林学院苗圃大棚内进行培育。同一个处理随机摆放,各处理之间相互隔离,进行常规育苗方法管理。
1.1 实验设计
2016年8月选取生长一致的植株进行胁迫处理,每个处理15盆,每盆1株,各处理重复3次。用随机区组试验设计,因素A为接菌处理,设3个处理,分别为TY29、TY35和对照CK;因素B为干旱胁迫处理,设4个胁迫梯度,按正常浇水(土壤含水率80%~90%,作为干旱胁迫的对照) 、轻度干旱(土壤含水率65%~75%) 、中度干旱(土壤含水率50%~60%)、重度干旱(土壤含水率35%~45%)进行处理。每天下午通过称质量法维持土壤相对含水量保持在试验设计范围内,其他管理一致,每天傍晚补足白天损失的水分,连续处理30 d后测定各指标。
1.2 指标测定
2016年8月对菌根侵率进行测定,植株收获时菌根侵染率按Phillips[6]方法测定,涉及到的计算公式如下:
菌根侵染率=(菌根侵染的根段数量/检测的根段总数量)×100%;
菌根依赖性=(接种植株平均干质量/对照植株平均干质量)×100%;
菌根贡献率=((接种植株平均干质量-不接种植株平均干质量)/接种植株平均干质量)×100% 。
1.3 样品的制备与观察
取材与固定:水分胁迫30 d后,取各处理幼苗中间部位、大小相近的叶片,沿叶片中部(避开主脉)切取大小1 mm×1 mm的小块,将样品放入2.5%的戊二醛溶液中,在4 ℃条件下固定24 h以上。然后用pH为7.2的磷酸缓冲溶液进行漂洗,再用1%的锇酸溶液对样品进行后固定,在0~4 ℃条件下固定24 h。
制片与观察:将样品取出,用pH为7.2的磷酸缓冲溶液进行漂洗,然后用1%的锇酸溶液对样品进行后固定,在0~4 ℃条件下固定24 h。再用pH为7.2的磷酸缓冲溶液漂洗3次,每次25 min,再经过30%、50%、70%、80%、90%和100%的乙醇脱水,每级停留30 min,然后用环氧丙烷置换过渡,Epon812渗透包埋,经超薄切片机切片后,用醋酸双氧铀和柠檬酸铅对染,最后置于透射电镜在Hu212A透射电镜下观测其中柱细胞并拍照(桃叶杜鹃细胞超微结构制片与拍照均在上海交通大学分析测试中心进行)。
2 结果与分析
2.1 菌根侵染率、菌根依赖性和菌根贡献率
由表1可见,不同ERM菌株接种桃叶杜鹃幼苗,其菌根侵染率差异明显,其中TY35的侵染率最高为45%,TY29的侵染率为27.5%,未接种的CK处理幼苗根系侵染率为0,极显著低于接种处理幼苗根系的侵染率。接种苗的菌根依赖性均大于100%,TY35达到147.89%;接种幼苗的菌根贡献率为13.65%~32.38%。

表1 不同菌株接种桃叶杜鹃幼苗的菌根侵染率 %
注:表中数为“平均值±标准差”;同列不同小写字母表示差异显著(p<0.05);同列不同大写字母表示差异极显著(p<0.01)。
2.2 正常水分条件下的叶片超微结构
正常水分条件下,对照处理与接菌处理的叶肉细胞无结构差异,细胞呈椭圆形或长椭圆形,细胞质壁结合较紧密,细胞膜平滑,清晰可见,内含叶绿体较多,且多呈梭形分布在细胞的边缘,紧贴着细胞壁,内部结构清晰、完整,类囊体丰富,片层结构发达,且排列整齐,叶绿体结构上还分布着大小不一的白色淀粉粒以及嗜锇颗粒。线粒体多呈较规则的圆形分布在细胞周围,结构完整,外膜清晰可见,内部电子密度较高,内嵴较丰富(图1)。
2.3 轻度胁迫条件下的叶片超微结构
轻度胁迫下,各处理苗的叶肉细胞产生了不同的变化,与正常水分相比,CK处理植株的叶肉细胞细胞壁有增厚现象,细胞膜变得模糊、扭曲,细胞质凝聚成许多纤维状颗粒体,均匀散布在细胞内,叶绿体及各细胞器开始向细胞中央移动,不再贴壁分布(图2,d1),叶绿体数量明显减少,发生肿胀变形,向内皱缩,类囊体片层开始膨胀(图2,d2),淀粉边缘糊化,少数发生降解,嗜锇颗粒数量开始增多。线粒体体积增大,外膜轮廓变得模糊,细胞着色较浅,内部嵴的数量变少(图2,d3)。TY29处理植株的叶肉细胞细胞膜结构基本完整(图2,e1),部分叶绿体发生变形,类囊体片层结构膨胀,嗜锇颗粒数量开始增多(图2,e2),线粒体数量开始增多,外膜结构清晰,内部变化并不明显(图2,e3)。TY35处理植株的变化如图所示,细胞壁稍有增厚,膜结构清晰,细胞质壁贴合紧密,细胞质也凝聚成许多纤维状颗粒体(图2,f1),叶绿体变化较小,仅少数叶绿体发生肿胀,嗜锇颗粒变化不明显(图2,f2)。
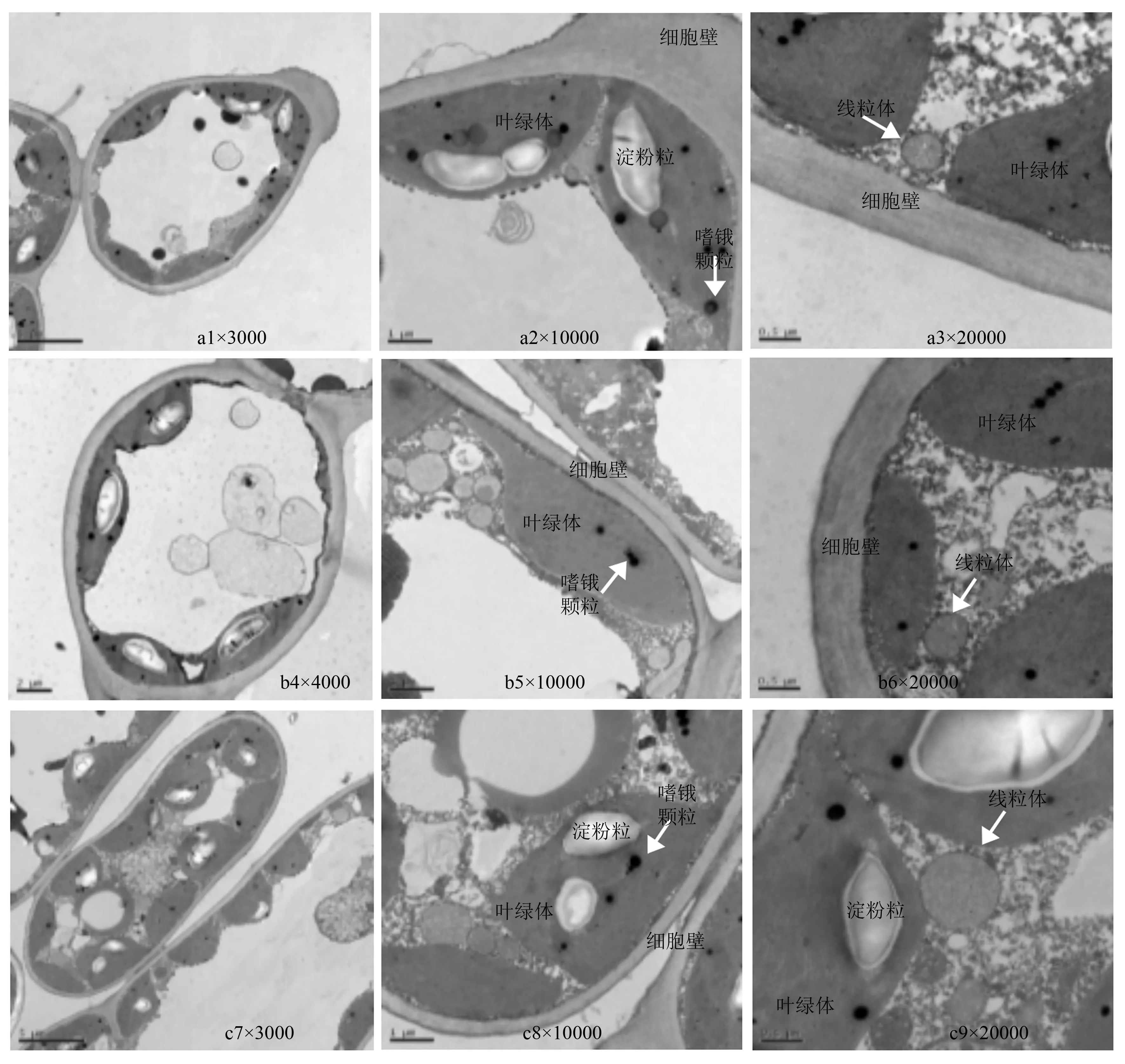
a1~a3分别为CK处理植株的叶肉细胞、叶绿体、线粒体;b4~b6分别为TY29处理植株的叶肉细胞、叶绿体、线粒体;c7~c9分别为TY35处理植株的叶肉细胞、叶绿体、线粒体。
图1正常水分条件下的桃叶杜鹃幼苗叶肉细胞超微结构
2.4 中度胁迫条件下的叶片超微结构
随着胁迫加剧,各处理苗的叶肉细胞形态进一步发生改变,CK处理植株的细胞形态变化最为明显,叶肉细胞因失水严重变形,扭曲,细胞内出现许多深色物质凝聚在细胞边缘(图3,g1),叶绿体进一步肿胀,叶绿体膜系统受到破坏,外膜消失,片层结构模糊不清,有的基粒片层膨胀、溶解或空泡化,类囊体发生断裂,多数淀粉粒降解,嗜锇颗粒增多且有大的嗜锇颗粒出现(图3,g2)。线粒体的外膜破裂,嵴消失,内部结构模糊(图3,g3)。TY29处理植株的叶肉细胞发生质壁分离现象,外部细胞壁出现破损,细胞膜变得模糊,各细胞器之间界限模糊(图3,h1),叶绿体外被膜局部破裂,有部分内含物外流,基粒和基质类囊体膜结构模糊,排列紊乱,嗜锇颗粒增多(图3,h2)。线粒体外膜轮廓变得模糊,细胞着色较浅,内部嵴减少(图3,h3)。中度胁迫下,TY35处理植株的叶肉细胞整体结构未受到破坏,细胞膜基本完整,细胞内有大量纤维状颗粒物质产生(图3,i1),叶绿体肿胀明显,体积变大或近球形,与细胞壁发生分离,类囊体空腔膨大,基粒片层排列散乱,有较多嗜锇颗粒出现(图3,i2)。线粒体外膜结构清晰,内部嵴减少(图3,i3)。

d1~d3为CK处理植株的叶肉细胞、叶绿体、线粒体;e1~e3为TY29处理植株的叶肉细胞、叶绿体、线粒体;f1~f3为TY35处理植株的叶肉细胞、叶绿体、线粒体。
图2轻度胁迫条件下的桃叶杜鹃幼苗叶肉细胞超微结构
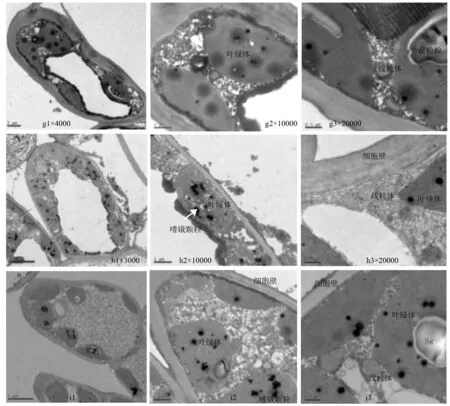
g1~g3为CK处理植株的叶肉细胞、叶绿体、线粒体;h1~h3为TY29处理植株的叶肉细胞、叶绿体、线粒体;i1~i3为TY35处理植株的叶肉细胞、叶绿体、线粒体。
图3中度胁迫条件下的桃叶杜鹃幼苗叶肉细胞超微结构
2.5 重度胁迫条件下的叶片超微结构
重度干旱胁迫下,各处理苗的叶肉细胞均出现一定的空泡化,以CK处理植株的最为严重,大部分细胞器发生降解,细胞呈不规则状(图4,j1),仅有少数叶绿体分布,有的叶绿体已经发生降解,只残存零碎的类囊体片段或降解物,嗜锇颗粒减少(图4,j2)。线粒体内含物流出,部分降解(图4,j3)。TY29处理植株的叶肉细胞也呈不规则状,但细胞内仍有一定数量的叶绿体分布(图4,k1),叶绿体外膜消失,形状扭曲变形,内部结构模糊,细胞内淀粉粒数量较多,但边缘逐渐糊化(图4,k2),线粒体发生膨胀变形,外膜结构已消失,内部嵴减少且结构模糊不清(图4,k3)。相较之下,TY35处理植株的叶肉细胞仍然较为完整,外部没有发生明显变形,膜结构受损,残存有细胞器降解之后的残骸(图4,l1),叶绿体明显肿胀、形态不规则,类囊体片层排列紊乱,但仍有较多嗜锇颗粒分布(图4,l1)。线粒体外膜轮廓变得模糊,细胞着色较浅,内部嵴发生断裂(图4,l1)。

j1~j3为CK处理植株的叶肉细胞、叶绿体、线粒体;k1~k3为TY29处理植株的叶肉细胞、叶绿体、线粒体;l1~l3为TY35处理植株的叶肉细胞、叶绿体、线粒体。
图4重度胁迫条件下的桃叶杜鹃幼苗叶肉细胞超微结构
3 讨论
在水分亏缺条件下,菌根植物能从土壤中吸收更多的水,使菌根植物受到较少的胁迫,比非菌根植物更耐旱,在逆境来临时可提高植株对逆境环境的抵抗能力[7-8]。植物的叶片对环境的反应最为敏感,环境的改变容易改变它的形态结构,植物受到干旱胁迫时,植物细胞中的叶绿体和线粒体是对干旱胁迫比较敏感,所负担的生理功能较为重要的两个细胞器,在逆境胁迫下,它们的正常结构及功能的维持对植物抵抗逆境能力的大小起着至关重要的作用[9]。本试验中,在正常水分条件下,各处理幼苗的细胞形态结构相同,细胞器也无明显差异。在轻度胁迫下,CK苗的叶绿体发生肿胀变形,向内皱缩,类囊体片层开始紊乱,TY29的叶绿体膨胀变圆,而TY35的变化相对较小,表明接种ERM的桃叶杜鹃叶绿体对水分胁迫具有一定的耐受性,叶绿体出现肿胀缩短、体积变大等现象可能是为了减少光线的直接穿透量和受光面积,避免高温缺水的灼伤,这是叶绿体对逆境胁迫的生理适应性反应[10]。随着胁迫程度加重,CK叶肉细胞进一步受损,叶绿体解体并出现空泡化,菌根苗的叶绿体膨胀变形,片层结构断裂,但其受损程度轻于对照。莫言玲[11]对西瓜的研究也有相同的结果,干旱处理下,菌根西瓜叶片的叶绿体超微结构比非菌根植株叶片的排列更整齐、更有序,非菌根植株叶绿体的损伤也更为明显。轻度胁迫时,线粒体的变化并不明显,随着胁迫加剧,叶肉细胞和根系细胞内的线粒体都表现为数量的增加,嵴变少,外膜结构遭到破坏,严重胁迫时线粒体降解并空泡化,但不同菌株处理之间伤害表现具有差异性,CK线粒体的损伤程度均大于菌根苗,在水分胁迫下也较早发生降解,干旱胁迫后线粒体数目增多,可能是对单位线粒体活性降低的补偿,从而保证胁迫过程中能量的供应[12]。在逆境胁迫下,线粒体的结构较叶绿体稳定,且受损伤晚于叶绿体[13],这与徐萍等[14]对银沙槐幼苗,任丽花等对圆叶决明的研究结果相似[15]。
4 结论
干旱胁迫对植物细胞结构的损伤影响是一个渐进的过程,随着胁迫程度的加强,细胞失水加剧,细胞超微结构的变化也会愈加明显,干旱胁迫引起细胞结构的破坏,是植物受到伤害的共同特征,其破坏程度取决于植物的抗旱性强弱[16]。 在不同水分条件下,桃叶杜鹃幼苗接种菌根真菌后,叶肉细胞的结构要比不接菌更加完整,干旱胁迫显著影响桃叶杜鹃幼苗的叶片细胞超微结构。随着胁迫加剧,幼苗的细胞结构损伤不断加重,接种不同的ERM对桃叶杜鹃幼苗抗旱性影响不同,接种TY35的菌根幼苗受旱害程度要小于接种TY29的菌株幼苗,但CK苗叶肉细胞的细胞器的受损程度均较菌根苗严重,即接种ERM真菌在干旱胁迫下能有效的保护桃叶杜鹃的叶肉细胞结构。
[1] AUGÉ R M. Water relations, drought and vesicular-arbuscular mycorrhizal symbiosis[J]. Mycorrhiza,2001,11(1):33-42.
[2] 陈训,巫华美.中国贵州杜鹃花[M].贵阳:贵州科技出版社,2003,21.
[3] 欧静, 刘仁阳, 陈训,等.菌根真菌对桃叶杜鹃种子萌发及幼苗移植的影响[J].南方农业学报,2013,44(2):293-298.
[4] 欧静,韦小丽,何跃军,等.接种ERM真菌对桃叶杜鹃幼苗的促生效应及生理生化影响[J].林业科学,2013,49(7):48-56.
[5] 谌端玉,欧静,王丽娟,等.干旱胁迫对接种ERM真菌桃叶杜鹃幼苗叶绿素含量及荧光参数的影响[J].南方农业学报,2016,47(7):1164-1170.
[6] PHILLIPS J M, HAYMAN D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection[J]. Transactions of the British Mycological Society,1970,55(1):158,158-161.
[7] 马嘉琦.丛枝菌根真菌对植物耐旱性的影响研究进展[J].生物技术世界,2016(3):63-63.
[8] 黄世臣,李熙英.水分胁迫条件下接种菌根菌对山杏实生苗抗旱性的影响[J].东北林业大学学报,2007,35(1):31-36.
[9] 韦丽君.甘蔗干旱胁迫的形态结构及生理机制研究[D].长沙:湖南农业大学,2014.
[10] 万里强,石永红,李向林,等.高温干旱胁迫下三个多年生黑麦草品种叶绿体和线粒体超微结构的变化[J].草业学报,2009,18(1):25-31.
[11] 莫言玲.西瓜对干旱胁迫的响应机制及丛枝菌根真菌的缓解效应[D].杨凌:西北农林科技大学,2016.
[12] 吴凯,周晓阳.环境胁迫对植物超微结构的影响[J].山东林业科技,2007(3):80-83.
[13] 闻志彬,莱孜提·库里库,张明理.干旱胁迫对3种不同光合类型荒漠植物叶绿体和线粒体超微结构的影响[J].西北植物学报,2016,36(6):1155-1162.
[14] 徐萍,李进,吕海英,等.干旱胁迫对银沙槐幼苗叶绿体和线粒体超微结构及膜脂过氧化的影响[J].干旱区研究,2016,33(1):120-130.
[15] 任丽花,黄敏敏,江枝和,等.干旱胁迫对圆叶决明叶片超微结构的影响[J].中国草地学报,2008,30(1):30-34.
[16] 郑敏娜,李向林,万里强,等.水分胁迫对6种禾草叶绿体、线粒体超微结构及光合作用的影响[J].草地学报,2009,17(5):643-649.
EffectsofEricoidMycorrhizaFungionRhododendronannaeSeedlingsLeafUltrastructureunderDroughtStress
Xiong Xianrong, Ou Jing, Long Haiyan, Ouyang Jiahui, Xiong Dan
(Guizhou University, Guiyang 50025, P. R. China)Journal of Northeast Forestry University,2017,45(12):38-43.
Rhododendronannae; ERM; Drought stress; Ultra-structure
1)国家自然科学基金项目(31560223、31460136);贵州省科技计划项目(黔科合支撑[2016]2522号);贵州大学研究生创新基金(研农2017010)。
熊贤荣,女,1992年2月生,贵州大学林学院,硕士研究生。E-mail:907188554@qq.com。
欧静,贵州大学林学院,教授。E-mail:coloroj@126.com。
2017年6月1日。
潘 华。
S688.9
An experiment was conducted to study the effects of Ericoid Mycorrhiza Fungi on leaf ultrastructure of 1-a seedlings ofRhododendronannaeunder water stress by soil culture experiment. Under drought stress in the greenhouse, the effects on root cells ultrastructures ofR.annaemycorrhizal seedlings were studied. Under normal water condition, the ultrastructure of mesophyll cells was complete. All cell chloroplasts and mitochondria damage were increased gradually, but under the same water stress, inoculated seedlings of cell organelles such as mitochondria and chloroplasts were more stable than control, and TY35 was more apparent in the role of the mesophylls.

