PPRV中国新疆南疆株F基因遗传演化分析
(1.巴里坤哈萨克自治县畜牧兽医工作站,新疆哈密 839200;2.塔里木大学动物科学学院/新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300;3. 新疆阿克苏地区动物疫病控制诊断中心,新疆阿克苏 843000)
doi:10.6048/j.issn.1001-4330.2017.11.020
PPRV中国新疆南疆株F基因遗传演化分析
张路瑶1,2,李 飞2,3,焦海宏2,赵 丽2,刘永宏2
(1.巴里坤哈萨克自治县畜牧兽医工作站,新疆哈密 839200;2.塔里木大学动物科学学院/新疆生产建设兵团塔里木畜牧科技重点实验室,新疆阿拉尔 843300;3. 新疆阿克苏地区动物疫病控制诊断中心,新疆阿克苏 843000)
目的分析中国新疆南疆2014年PPRV毒株来源,为中国新疆南疆PPR防控提供理论依据。方法调查中国新疆南疆阿克苏地区某羊场发病羊发病情况、临床症状观察及病理学检查,实验室进行PPRVF基因RT-PCR和F基因测序,进一步对PPRVF基因序列分析。结果毒株与国内PPRV毒株F基因核苷酸同源性最高的是中国新疆China/XJYL/2013毒株,与国外的毒株F基因核苷酸同源性最高的是印度Izatnagar/94毒株及Izatnagar-94毒株;此次毒株与国内PPRV毒株F蛋白氨基酸同源性最高的是中国新疆China/XJYL/2013毒株,与国外的PPRV毒株F蛋白氨基酸同源性最高的是印度Izatnagar/94毒株。PPRV毒株F基因进化树分析显示:PPRV毒株与北京PPRV毒株进化关系最近,与中国新疆伊犁PPRV毒株同属一个分支,与国外印度及孟加拉国毒株的进化关系较近。结论2014年中国新疆南疆存在PPR疫情,该疫情毒株与此次疫情前后国内的PPR毒株及印度PPR毒株进化关系较近。
小反刍兽疫;诊断;F基因;序列分析
0 引 言
【研究意义】小反刍兽疫(Peste Des Petits Ruminants, PPR)是由副粘病毒科麻疹病毒属的小反刍兽疫病毒(Peste Des Petits Ruminants Virus, PPRV)引起小反刍动物的一种急性烈性高度接触性传染病[1]。中国2013~2014年PPR疫情起始于中国新疆,并在中国形成了大流行,对中国养羊业造成了极其严重的危害,目前该病仍然威胁着中国小反刍兽的健康,调查清楚各地PPR流行毒株及其特征,对该病的防治具有重要意义。【前人研究进展】1942年,科特迪瓦报道全球首次PPR疫情[2],并逐渐扩散到非洲中部、阿拉伯半岛、中东[3-6]和亚洲的印度[7]、巴基斯坦[8-9]等地。2007年7月,PPRV传入中国西藏阿里地区[10];2007年11月,中国西藏阿里地区有4个县报道PPR疫情的发生[11];2008年2月,西藏野生岩羊发生PPRV感染[12];2008年6月,西藏那曲地区发生PPR疫情[13];2010年5月,西藏日土县发生PPR疫情[14]。2013年11月,中国新疆伊犁地区霍城县暴发PPR疫情[15]。2013年11月~2014年9月,中国有20多个省份相继发生PPR疫情。2015年中国有8个省份报道PPR疫情的发生,2016年中国有6个省份报道PPR疫情的发生[16]。PPRV为单股负链RNA病毒,从3′到5′依次为:N-P-M-F-H-L 6个基因。PPRVF基因全长2 321 bp,共编码546个氨基酸,F蛋白作为病毒表面的纤突蛋白,起着破坏靶细胞膜的作用[17-19]。PPRV主要感染小反刍动物,以发热、口鼻分泌物增多、口鼻黏膜糜烂坏死、肠炎和肺炎为主要特征[20]。胃肠道及呼吸道的出血、坏死[21-22],结肠与直肠结合部有斑马条纹状出血,病羊多组织出现嗜酸性胞浆包涵体的多核巨细胞[23]。【本研究切入点】通过对PPRVF基因系统进化分析,可以反映PPRV以时间为轴线的演变过程。研究通过对中国新疆南疆阿克苏地区某羊场发病羊的流行病学调查作出初步诊断,结合分子生物学手段对PPRVF基因片段进行系统进化分析,从而为PPRV在不同地域之间的传播途径提供线索。【拟解决的关键问题】通过流行病学调查、临床症状观察和病理学剖检对中国新疆南疆阿克苏地区某羊场发病羊进行病例分析,进一步通过分子生物学手段对PPRVF基因进行RT-PCR扩增、测序及基因序列分析,确定中国新疆南疆PPR疫情来源及PPRV随时间的演变特征,为PPR疫情防控提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 病料
实验地点为新疆阿拉尔市塔里木大学动物科学学院和新疆生产建设兵团塔里木畜牧科技重点实验室。病料获得时间为2014年5月。
10%福尔马林液固定的病死羊组织,来自中国新疆南疆阿克苏地区某羊场。阳性对照为新疆天康畜牧生物技术股份有限公司Nigeria 75/1株弱毒疫苗。
1.1.2 引物
按照引物的设计原则,利用Primer Premier 5.0分子生物学软件,以GenBank数据库中登录的PPRV基因序列作为参照,设计PPRVF基因特异性引物,由生工生物工程(上海)有限公司合成。上游引物为3'-GCTCCGGCAAGGTCCCTC-5′,下游引物为3'-CTGAGTTTCTTGCGTCCT-5′,预期扩增大小1 808 bp。
1.1.3 主要试剂及仪器
AllPrep DNA/RNA FFPE Kit(Code No. 80234),购自凯杰企业管理(上海)有限公司;TaKaRa RNA LA PCRTMKit(AMV)Ver.1.1(Code No.: RR012A),购自宝生物工程(大连)有限公司;DNA marker Ⅲ(Code No.: MD103),购自天根生化科技(北京)有限公司;Gold view、6×Loading Buffer。PCR仪(TC-5000, Bibby scientific Ltd),小型高速冷冻离心机(R134a, Hermetically sealed refigeration system),电泳仪(DYY-12,北京市六一仪器厂),紫外分析仪(JY02S,北京君意东方电泳仪设备有限公司),购自上海珂淮仪器有限公司等。
1.2 方 法
1.2.1 中国新疆南疆PPR病例分析
对中国新疆南疆阿克苏地区某羊场发病羊进行发病情况调查、临床症状观察及病理学剖检,分析病例。
1.2.2 中国新疆南疆PPRV F基因序列分析
按照AllPrep DNA/RNA FFPE Kit试剂盒,从福尔马林固定组织提取总RNA;用自行设计合成的引物,按照TaKaRa RNA LA PCRTM Kit(AMV)Ver.1.1试剂盒进行一步法RT-PCR扩增PPRVF基因,退火温度为52.7℃。扩增产物用1%的琼脂糖凝胶进行电泳鉴定后,将特异性扩增产物送生工生物工程(上海)有限公司测序。用DNAStar和DNAMAN分子生物学软件,对PPRVF基因测序片段进行拼接,并对其进行序列比对和遗传演化分析,列出参考毒株。表1
表1 参考毒株
Table 1 Reference strai
序号No.Genebank登录名GenebankAccessionNumbers毒株名StrainName序列名SequenceName备注Remarks1KC812765BD/PPR/Dhaka-1/2010Bangladesh2010孟加拉国2010Bangladesh20102KR781450Benin/B1/1969Benin1969贝宁1969Benin19693KR781449Benin/10/2011Benin2011贝宁2011Benin20114KP868655CH/GDDG/2014CHGDDG2014中国广东2014Guangdong,China20145KM089830CH/HNNY/2014CHHNNY2014中国河南2014Henan,China20146KM089831CH/HNZK/2014CHHNZK2014中国河南2014Henan,China20147KM089832CH/HNZM/2014CHHNZM2014中国河南2014Henan,China20148KP260624China/BJ/2014ChinaBJ2014中国北京2014Beijing,China20149KM816619GZL-14ChinaJilin2014中国吉林2014Jilin,China201410EU364809China/Tibet/0701ChinaTibet0701中国西藏2007Tibet,China200711FJ905304China/Tibet/Geg/07-30ChinaTibet0730中国西藏2007Tibet,China200712JF939201China/Tib/07ChinaTibet2007中国西藏2007Tibet,China200713JX217850Tibet/Bharal/2008ChinaTibet2008中国西藏2008Tibet,China200814KT633939China/XJBZ/2015ChinaXJBZ2015中国新疆巴州2015BazhouofXinjiang,China201515KX951414China/XJNJ/2014ChinaXJNJ2014实验株experimentalstrains16KM091959China/XJYL/2013ChinaXJYL2013中国新疆伊犁2013YiliofXinjiang,China201317KX354359PPRV-FYChinaZheJiang2015中国浙江2015Zhejiang,China201518EU267273ICV89Coted'Ivoire1989科特迪瓦1989Coated'Ivoire198919KR781451CIV/01P/2009Coted'Ivoire2009科特迪瓦2009Coated'Ivoire200920KJ867540Ethiopia1994Ethiopia1994埃塞俄比亚1994Ethiopia199421KJ867541Ethiopia2010Ethiopia2010埃塞俄比亚2010Ethiopia201022KJ466104Ghana/NK1/2010Ghana2010加纳2010Ghana201023KR140086Izatnagar/94India1994印度1994India199424KJ867542Sungri1996MSDIndia1996印度1996India199625KR261605India/TN/Gingee/2014India2014印度2014India201426KT270355IND/TN/GIN/2014/01India201401印度2014India201427KX033350IND/Delhi/2016/05India2016印度2016India201628FJ750562Bhopal2003IndiaBhopal2003印度2003India200329JN632534Guj/2007IndiaGuj2007印度2007India200730KF752444Izatnagar-94IndiaIzatnagar-94印度1994India199431GQ410434Jhansi/2003IndiaJhansi2003印度2003India200332GQ410435Revati/2006IndiaRevati2006印度2006India200633GQ452015Sungri-96IndiaSungri96印度1996India199634KF648287Kurdistan2011IraqKurdistan2011伊拉克2011Iraq201135KM463083KN5/2011Kenya2011肯尼亚2011Kenya201136KU236379Lib/2015Liberia2015利比里亚2015Liberia201537KC594074Morocco2008Morocco2008摩洛哥2008Morocco200838KC609746Morocco-2008Morocco-2008摩洛哥2008Morocco200839HQ197753Nigeria/75/1Nigeria1975尼日利亚1975疫苗株Nigeria1975Vaccinestrain
续表
表1 参考毒株
Table 1 Reference strai
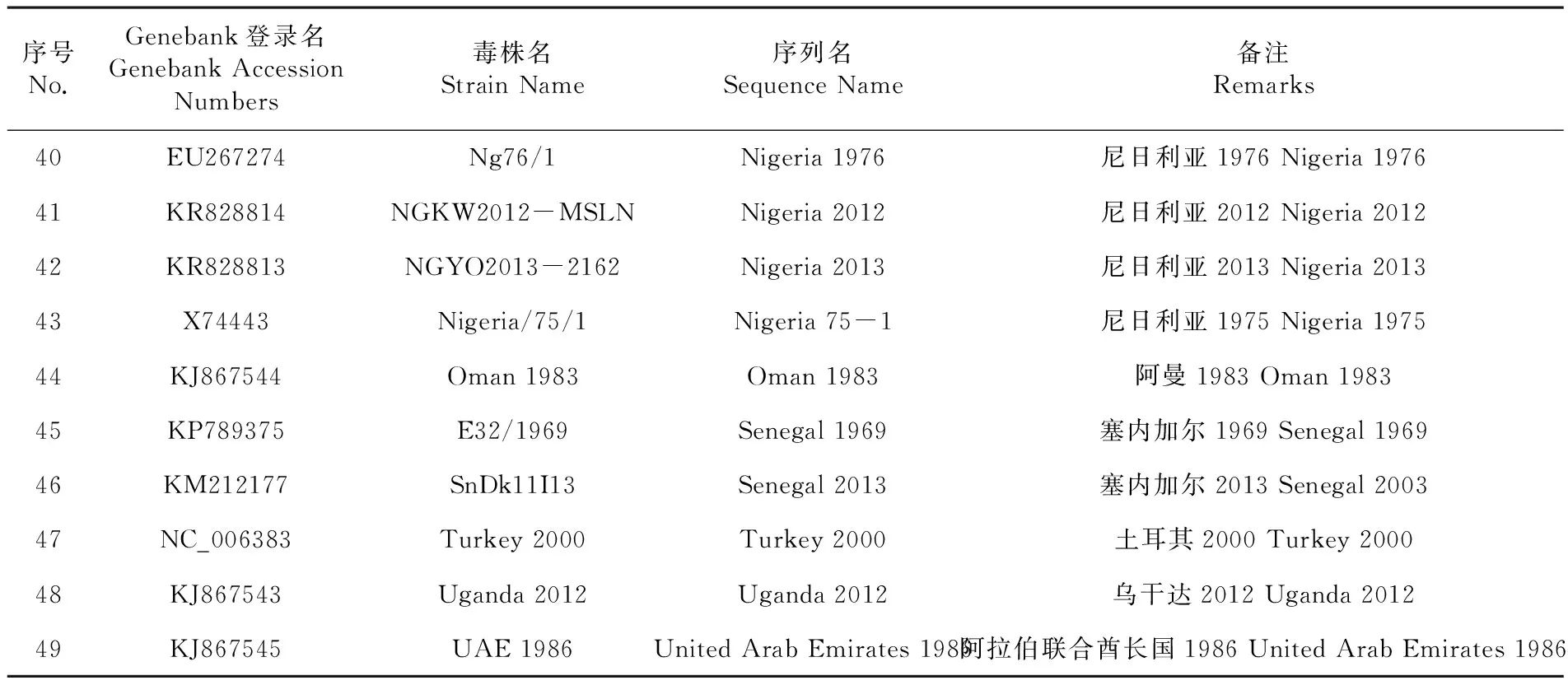
序号No.Genebank登录名GenebankAccessionNumbers毒株名StrainName序列名SequenceName备注Remarks40EU267274Ng76/1Nigeria1976尼日利亚1976Nigeria197641KR828814NGKW2012-MSLNNigeria2012尼日利亚2012Nigeria201242KR828813NGYO2013-2162Nigeria2013尼日利亚2013Nigeria201343X74443Nigeria/75/1Nigeria75-1尼日利亚1975Nigeria197544KJ867544Oman1983Oman1983阿曼1983Oman198345KP789375E32/1969Senegal1969塞内加尔1969Senegal196946KM212177SnDk11I13Senegal2013塞内加尔2013Senegal200347NC_006383Turkey2000Turkey2000土耳其2000Turkey200048KJ867543Uganda2012Uganda2012乌干达2012Uganda201249KJ867545UAE1986UnitedArabEmirates1986阿拉伯联合酋长国1986UnitedArabEmirates1986
2 结果与分析
2.1 病例调查
中国新疆南疆阿克苏地区某羊场养羊580只,均为绵羊。2014年5月,该羊场89只羊发病,病情严重者50余只,其中27只死亡,发病羊日龄段以2月龄左右为主,雌性和雄性均有。该群羊PPR疫苗免疫情况参差不齐,成年羊全部强制免疫新疆天康畜牧生物技术股份有限公司Nigeria 75/1株弱毒疫苗,羔羊未免疫。
发病急,病羊表现为高热,精神沉郁,食欲减退或废绝,口鼻大量灰白色恶臭状分泌物,可见泪斑,咳嗽,呼吸困难,拉稀,消瘦。
病死羊眼、口、鼻、肛门周围粘有饲草料等;鼻孔周围、牙龈、舌头、唇部可见糜烂和溃疡;肺脏不同区域颜色不一,表面富有光泽,间质增宽,出现多处暗红色、质度较实区域,切面有红色泡沫性液体流出(图1a);肠黏膜面有暗红色纹理(图1b);淋巴结灰红色,切面不平整;肾脏表面有灰黄色斑块;其他脏器无明显眼观病变。图1

(a)肺表面富有光泽,出现大面积暗红色或紫色区域,质度较硬;(b)肠黏膜面见红色条纹
(a) The surface of the lung is full of luster, there is a large area of dull red or purple area, and the quality is hard; (b) Intestinal mucosal surface appear red stripe.
图1 绵羊小反刍兽疫尸体剖检
Fig.1 Post mortem in sheep with peste des petits ruminants (PPR)
2.2 RT-PCR结果
按照AllPrep DNA/RNA FFPE Kit试剂盒对福尔马林固定组织样品提取总RNA,根据PPRVF基因特异性引物进行RT-PCR扩增,获得片段产物大小约为1 808 bp的条带,与预期目的条带大小一致,对照成立。图2
2.3 F基因核苷酸序列分析
研究通过对福尔马林固定组织样品提取总RNA、RT-PCR及测序获得的中国新疆南疆PPRV毒株F基因命名为China/XJNJ/2014,其与来自于Genbank数据库的48个F基因全序列进行核苷酸序列比对。核苷酸同源性分析结果显示:试验China/XJNJ/2014毒株与西藏4个PPRV毒株F基因核苷酸同源性范围为97.6%~97.7%;与此次PPR疫情报道的第一株,即新疆伊犁China/XJYL/2013毒株F基因核苷酸同源性为99.9%,与中国新疆巴州China/XJBZ/2015毒株F基因核苷酸同源性为98.4%;同中国内地毒株F基因核苷酸同源性范围为99.6%~99.9%,其中同源性最低的是河南CH/HNZM/2014毒株,同源性为99.9%的有北京China/BJ/2014毒株、吉林GZL-14毒株和浙江PPRV-FY毒株;与国外PPRV毒株的F基因核苷酸同源性范围为87.9%~98.2%,其中同源性最低的为肯尼亚KN5/2011毒株和乌干达Uganda 2012毒株,同源性最高的为印度Izatnagar/94毒株和Izatnagar-94毒株均达98.2%;与印度2014年毒株India/TN/Gingee/2014和IND/TN/GIN/2014/01毒株F基因核苷酸同源性分别为97.3%和97.1%,与印度2016年毒株IND/Delhi/2016/05毒株F基因核苷酸同源性为97.1%;试验PPRV China/XJNJ/2014毒株F基因与中国目前使用的疫苗株Nigeria/75/1毒株的F基因核苷酸同源性为92.7%。表2
进化树构建结果显示:China/XJNJ/2014毒株与北京China/BJ/2014毒株进化关系最近,与中国2013年以后的9个毒株共同构成一个小分支;与国外毒株对比分析,2013~2014年PPR疫情毒株与印度IND/TN/GIN/2014/01毒株、IND/TN/GIN/2014/01毒株、IND/Delhi/2016/05毒株及孟加拉国BD/PPR/Dhaka-1/2010毒株关系最近;中国14个毒株、印度11个毒株、孟加拉国1个毒株、摩洛哥2个毒株、伊拉克1个毒株、土耳其1个毒株、埃塞俄比亚Ethiopia 2010毒株和尼日利亚NGYO2013-2162毒株共同构成第Ⅳ谱系;阿曼1个毒株、阿拉伯联合酋长国1个毒株、肯尼亚1个毒株、乌干达1个毒株和埃塞俄比亚Ethiopia 1994毒株共同构成PPRV第Ⅲ谱系;贝宁2个毒株、加纳1个毒株、利比里亚1个毒株、科特迪瓦CIV/01P/2009毒株和塞内加尔SnDk11I13毒株,包括尼日利亚的Nigeria/75/1毒株、Ng76/1毒株、NGKW2012-MSLN毒株和Nigeria/75/1毒株,共同构成PPRV第Ⅱ谱系;PPRV谱系Ⅰ由科特迪瓦ICV89毒株和塞内加尔E32/1969毒株构成。图3
2.4 F蛋白氨基酸序列
将试验获得的PPRV China/XJNJ/2014毒株 F蛋白氨基酸序列与NCBI数据库中下载的48个PPRV F蛋白氨基酸序列进行比对,结果显示:试验China/XJNJ/2014毒株F蛋白氨基酸与西藏的4个毒株F蛋白氨基酸同源性范围为98.7%~98.9%;与2个中国新疆毒株,即中国新疆伊犁China/XJYL/2013毒株和中国新疆巴州China/XJBZ/2015毒株F蛋白氨基酸同源性分别为100%和98.7%;同中国内地毒株F蛋白氨基酸同源性范围为99.8%-100%,其中与河南CH/HNZK/2014毒株、北京China/BJ/2014毒株、吉林GZL-14毒株和浙江PPRV-FY毒株F蛋白氨基酸同源性均为100%;与国外PPRV毒株F蛋白氨基酸同源性范围为94.1%~99.3%,其中同源性最低的为科特迪瓦ICV89毒株,同源性最高的为印度Izatnagar/94毒株为99.3%,与印度2014年毒株India/TN/Gingee/2014和IND/TN/GIN/2014/01毒株及2016年IND/Delhi/2016/05毒株F蛋白氨基酸同源性均为98.7%;与中国目前使用的疫苗株Nigeria/75/1的F蛋白氨基酸同源性为96.7%。表2

M:Maker Ⅲ;1:XJNJ-F;2:阳性对照(弱毒疫苗);3:阴性对照
M: Maker Ⅲ; 1: XJNJ-F; 2: Positive control (Attenuated vaccine); 3: Negative control
图2 PPRV F基因PCR扩增
Fig.2 Amplification of PPRV F gene by PCR

图3 来自不同地区和不同年代的小反刍兽疫病毒毒株F基因系统进化树
Fig.3 Phylogenetic tree of F gene of PPRV isolated from different regions and different ages


3 讨 论
3.1 PPR临床病例
根据对中国新疆南疆阿克苏地区某羊场发病情况的调查发现,发病羊主要集中为未免疫PPR的2月龄左右的羔羊,呼吸道和消化道病变明显,同时结合发病情况、临床症状及眼观病理变化分析,初步疑似该群羊感染PPRV。实验室进一步从福尔马林固定组织病料提取RNA进行RT-PCR及F基因序列分析。
3.2 F基因核苷酸序列
根据PPRVF基因核苷酸同源性结果分析,试验所获得China/XJNJ/2014毒株与中国西藏的4个毒株F基因核苷酸同源性较中国其他省份PPRV毒株F基因核苷酸同源性低,与中国新疆伊犁2013年毒株的进化关系最高。2013年中国新疆伊犁暴发PPR疫情之后,由于国家采取强有力的防制措施,使得中国新疆表象上控制了该疫情,但中国新疆仍然存在隐性感染PPRV的羊。中国新疆南北疆养羊业均较发达,羊产品贸易及活羊调运频繁,加之南北疆羊肉价格存在显著差异,这样隐性感染PPRV的羊很有可能从北疆被调运入南疆,并在南疆长期存在PPR病原,当环境因素发生较大变化时,隐性感染的羊则很容易出现显性症状,导致南疆发生PPR疫情。试验毒株与此次疫情中国内地毒株核苷酸同源性较高。中国新疆作为中国的养羊大省,其羊产品远销北京、浙江、广东等内地省份,以及活羊调运使PPRV传播风险也较高,所以导致中国新疆PPR疫情传入内地。
试验所获得的PPRV毒株F基因与国外PPRV毒株F基因核苷酸同源性最高的是印度Izatnagar/94毒株,印度与中国相邻且PPR疫情多发[24],有文献报道2013年中国新疆伊犁PPR疫情可能由中国周边国家传入[25]。另外,试验毒株与印度近年发生的PPR毒株India/TN/Gingee/2014、IND/TN/GIN/2014/01和IND/Delhi/2016/05F基因核苷酸同源性也较高。研究发现中国新疆南疆PPRV毒株与中国新疆伊犁PPRV毒株F基因核苷酸同源性最高,推测中国新疆南疆PPR疫情可能是由于印度PPR疫情传入中国新疆伊犁后,延续到中国新疆南疆地区。试验毒株与国外肯尼亚KN5/2011毒株F基因核苷酸同源性最低,肯尼亚地处非洲东部,与中国相距较远,PPRV的地区差异及各毒株的地域分布导致试验毒株与肯尼亚毒株F基因同源性最低。China/XJNJ/2014毒株与中国目前所使用的PPRV弱毒疫苗毒株F基因核苷酸同源性仅为92.7%,所以中国新疆南疆该次疫情是由于接种PPR疫苗后毒力返强而导致发病的可能性较低。
PPRVF基因作为麻疹病毒属中高度保守的基因,在PPRVF基因全序列中其5′端的序列具有PPRV的病毒特异性,前人的研究发现PPRVF基因序列能反映出PPRV随时间的演变规律,有利于分析PPRV在不同的地理区域的传播规律[26]。并根据PPRVF基因的特异性将PPRV分成4个分支依次为Ⅰ、Ⅱ、Ⅲ和Ⅳ[27],虽然PPRV被分为4个谱系,但只有一个血清型[28]。根据试验获得的PPRV毒株F基因核苷酸序列与NCBI数据库中下载的48个PPRV毒株F基因核苷酸序列进化树构建结果表明,试验毒株F基因进化关系与中国2013年之后的PPR疫情毒株进化关系较近,与西藏毒株进化关系较远,与中国周边国家中印度及孟加拉国的毒株进化关系较近。Kwiatek等[29]利用PPRVN基因进行系统进化树分析显示,第Ⅳ谱系均来自于亚洲,而研究发现位于西非尼日利亚2013年NGYO2013-2162毒株被划分为第Ⅳ谱系。这与前人的报道不一致,可能与尼日利亚毒株的变异有关,也可能是不同的基因片段分析结果存在差异。刘永宏等[30]根据PPRV毒株F基因核苷酸序列进行进化树构建也发现非洲西北部的摩洛哥毒株属于第Ⅳ谱系,这与研究的结果一致。前人的研究中塞内加尔毒株只属于第Ⅰ谱系,研究发现塞内加尔的2个毒株属于不同的谱系,如SnDk11I13毒株属于第Ⅱ谱系,E32/1969毒株属于第Ⅰ谱系,这也说明目前一个国家或一个地区存在多个谱系的PPRV毒株。
3.3 F蛋白氨基酸序列
PPRV F蛋白C末端有一个结构域,长32个氨基酸,为一个易变结构域。其经过纯化了的F蛋白在病毒感染宿主体的初期有导致宿主机体溶血、细胞融合及启动感染的生物学活性[31]。F蛋白是一种包膜表面糖蛋白,其序列高度保守,保守性仅次于M蛋白[32]。根据试验获得的PPRV F蛋白氨基酸序列与NCBI数据库中下载的48个PPRV毒株F蛋白氨基酸序列比对结果发现,试验毒株与西藏的4株PPRV毒株F蛋白氨基酸同源性介于98.7%~98.9%,低于试验毒株与中国新疆伊犁China/XJYL/2013毒株F蛋白氨基酸同源性。这也体现此次PPR疫情是早年西藏疫情的传入和延续的可能性较小,而由中国新疆北疆传入的可能性较大。试验毒株与中国2013年以后的内地毒株F蛋白氨基酸同源性较高,这可能与中国新疆养羊业的羊肉销售及羊只调运有关。试验毒株与国外PPRV毒株F蛋白氨基酸同源性最高的是印度毒株,同源性最低的是科特迪瓦ICV89毒株,这也表明中国此次疫情毒株可能为印度等周边国家传入。试验PPRV毒株F蛋白氨基酸序列与中国目前使用的疫苗毒株F蛋白氨基酸序列同源性较低,这与PPRVF基因核苷酸序列比对结果一致,说明试验毒株为接种疫苗毒毒力返强的可能性较低。
4 结 论
2014年,中国新疆南疆存在PPR疫情;新疆南疆PPR疫情毒株与中国2013~2014年PPR疫情国内毒株及此次疫情报道的PPRV第1株(China/XJYL/2013)所在地的周临国印度PPR毒株(Izatnagar/94)进化关系较近。
参考文献(References)
[1] 吴国珍.西藏小反刍兽疫疫情流行及防控对策研究[D].扬州:扬州大学硕士学位论文, 2010.
WU Guo-zhen.(2010).StudyontheprevalenceandcontrolmeasuresofTibetPestedesPetitsRuminants[D]. Master Thesis. Yangzhou University, Yangzhou. (in Chinese)
[2] Banyard, A. C., Parida, S., Batten, C., Oura, C., Kwiatek, O., & Libeau, G. (2010). Global distribution of peste des petits ruminants virus and prospects for improved diagnosis and control.JournalofGeneralVirology, 91(Pt 12): 2,885-2,897.
[3] Elzein, E. A., Hassanien, M. M., Alafaleq, A. I., Abd Elhadi, M. A., & Housawi, F. M. (1990). Isolation of peste des petits ruminants from goats in saudi arabia.VeterinaryRecord, 127(12):309-310.
[4] Kumar, N., Maherchandani, S., Kashyap, S. K., Singh, S. V., Sharma, S., & Chaubey, K. K., et al. (2014). Peste des petits ruminants virus infection of small ruminants: a comprehensive review.Viruses, 6(6): 2,287-2,327.
[5] Taylor, W. P., Al, B. S., & Barrett, T. (1990). The epidemiology of peste des petits ruminants in the sultanate of oman.VeterinaryMicrobiology,22(4): 341-352.
[6] Obi, T. U., Rowe, L. W., & Taylor, W. P. (1984). Serological studies with peste des petits ruminants and rinderpest viruses in nigeria.TropicalAnimalHealth&Production, 16(2):115-118.
[7] Balamurugan, V., Saravanan, P., Sen, A., Rajak, K. K., Venkatesan, G., & Krishnamoorthy, P., et al. (2012). Prevalence of peste des petits ruminants among sheep and goats in india.JournalofVeterinaryScience, 13(3): 279-285.
[8] Anees, M., Shabbir, M. Z., Muhammad, K., Nazir, J., Shabbir, M. A. B., & Wensman, J. J., et al. (2013). Genetic analysis of peste des petits ruminants virus from pakistan.BmcVeterinaryResearch, 9(1):1-5.
[9] Amjad, H., Qamar-ul-Islam, Forsyth, M., Barrett, T., & Rossiter, P. B. (1996). Peste des petits ruminants in goats in pakistan.VeterinaryRecord, 139(5): 118-119.
[10] 王志亮, 包静月, 吴晓东, 等. 我国首例小反刍兽疫诊断报告[J]. 中国动物检疫, 2007, 24(8): 24-26.
WANG Zhi-liang, BAO Jing-yue, WU Xiao-dong, et al.(2007). The first report on the diagnosis of peste des petits ruminants in China [J].ChineseJournalofAnimalHealthInspection, 24(8): 24-26. (in Chinese)
[11] 次仁罗布. 西藏阿里地区小反刍兽疫的流行情况与综合防控[J]. 山东畜牧兽医, 2013, 34(5): 44-45.
Cirenluobu.(2013). The epidemic situation and comprehensive prevention and control of Tibet Ali region of peste des petits ruminants [J].ShandongJournalofAnimalScienceandVeterinaryMedicine, 34(5): 44-45. (in Chinese)
[12] Bao, J., Wang, Z., Li, L., Wu, X., Sang, P., & Wu, G., et al. (2011). Detection and genetic characterization of peste des petits ruminants virus in free-living bharals (pseudois nayaur) in Tibet, China.ResearchinVeterinaryScience, 90(2): 238-240.
[13] 王乐元, 次真, 吴国珍, 等. 中国西藏小反刍兽疫的发生状况与防控[J]. 畜牧兽医学报, 2011, 42(5): 717-720.
WANG Le-yuan, CI Zhen, WU Guo-zhen, et al.(2011). Occurrence and control strategy of peste des petits ruminants in Tibet autonomous region of China [J].ActaVeterinariaetZootechnicaSinica, 42(5): 717-720. (in Chinese)
[14] 吴锦艳, 尚佑军, 田宏,等. 2007-2014年国内外小反刍兽疫流行现状及分析[J]. 中国兽医学报, 2016, 36(4): 687-693.
宇晴点头称是,环顾着四围诸峰:“我喜欢这个栽花种草的好地方,改天我带你们去晴昼海看花去,几千几万的花,每一天都不同,都是我种的!”黑衣人也在一旁含笑点头,一脸的怜爱,好像看着小妹献宝的大哥似的。
WU Jin-yan, SHANG You-jun, TIAN Hong, et al.(2016). The epidemic situation and analysis of peste des petits ruminants in China and worldwide from 2007 to 2014[J].ChineseJournalofVeterinaryScience, 36(4): 687-693. (in Chinese)
[15] Bao, J., Wang, Q., Zhang, Y., Liu, C., Li, L., & Wang, Z. (2014). Complete genome sequence of a novel variant strain of peste des petits ruminants virus, china/xjyl/2013.GenomeAnnouncements, 2(5):65-73.
[16] 中华人民共和国农业部. 10月16日全国小反刍兽疫确诊疫情情况[EB/OL]. http://www.syj.moa.gov.cn/dwyqdt/qt/201610/t20161018_5308509.htm.
Ministry of Agriculture of the People's Republic of China. (2016). Epidemic situation of confirmed ruminants in China [EB/OL]. http://www.syj.moa.gov.cn/dwyqdt/qt/201610/t20161018_5308509.htm.
[17] 杨香坊. 小反刍兽疫病毒F蛋白与H蛋白相互作用及F蛋白免疫原性研究[D]. 兰州: 甘肃农业大学硕士学位论文, 2013.
YANG Xiang-Fang.(2013).ThestudyofFproteinimmunogenicityandinteractionofFandHproteinofPPRV[D]. Master Thesis. GanSu Agricultural University, Lanzhou. (in Chinese)
[18] Brindha, K., Raj, G. D., Ganesan, P. I., Thiagarajan, V., Nainar, A. M., & Nachimuthu, K. (2001). Comparison of virus isolation and polymerase chain reaction for diagnosis of peste des petits ruminants.ActaVirologica, 45(3):169-172.
[19] Rahman, M. M., Shaila, M. S., & Gopinathan, K. P. (2003). Baculovirus display of fusion protein of peste des petits ruminants virus and hemagglutination protein of rinderpest virus and immunogenicity of the displayed proteins in mouse model.Virology, 317(1):36-49.
[20] 王春霞. 一起小反刍兽疫的诊断及病原分离鉴定[D]. 长春: 吉林大学硕士学位论文, 2015.
WANG Chun-xia.(2015).Diagnosisofpestedespetitsruminantsandidentificationofpestedespetitsruminantsvirus[D]. Master Thesis. Jilin University, Changchun. (in Chinese)
[21] Rowland, A. C., Scott, G. R., Ramachandran, S., & Hill, D. H. (1971). A comparative study of peste des petits ruminants and kata in west african dwarf goats.TropicalAnimalHealth&Production, 3(4): 241-247.
[22] Brown, C. C., Mariner, J. C., & Olander, H. J. (1991). An immunohistochemical study of the pneumonia caused by peste des petits ruminants virus.VeterinaryPathology, 28(2):166-170.
[23] 王光祥, 贾宁, 方梅, 等. 绵羊小反刍兽疫临床病例的病理学观察[J]. 畜牧兽医学报, 2015, 46(6): 1 011-1 017.
WANG Guang-xiang, JIA Ning, FANG Mei, et al.(2015) Studies on the pathology of the peste des petits ruminants of sheep [J].ActaVeterinariaetZootechnicaSinica, 46 (6): 1,011-1,017. (in Chinese)
[24] Singh, B., Bardhan, D., Verma, M. R., Prasad, S., & Sinha, D. K. (2014). Estimation of economic losses due to peste de petits ruminants in small ruminants in india.VeterinaryWorld, 7(4):194-199.
[25] 王清华, 刘春菊, 吴晓东,等.新疆小反刍兽疫疫情诊断[J]. 中国动物检疫, 2014, 31(1): 72-75.
WANG Qing-hua, LIU Chun-ju, WU Xiao-dong, et al.(2014). Diagnosis of peste des petits ruminants in goats in Xinjiang China [J].ChinaAnimalHealthInspection, 31(1): 72-75. (in Chinese)
[26] 包静月, 王志亮, 李林, 等.我国西藏小反刍兽疫病毒China/Tib/Gej/07-30核衣壳蛋白基因和基因组启动子区的分子特征分析[J]. 病毒学报, 2008, 24(6): 464-471.
BAO Jing-yue, WANG Zhi-liang, LI Lin, et al (2008).Sequence analysis of the nucleocapsid gene and genome promoter region of peste des petits ruminants virus of Chinese origin [J].ChineseJournalofVirology, 24(6): 464-471. (in Chinese)
[27] Mahapatra, M., Parida, S., Baron, M., & Barrett, T. (2006). Matrix protein and glycoproteins f and h of peste-des-petits-ruminants virus function better as a homologous complex.JournalofGeneralVirology, 87(7): 2,021-2,029.
[28] Shaila, M. S., Shamaki, D., Forsyth, M. A., Diallo, A., Goatley, L., & Kitching, R. P., et al. (1996). Geographic distribution and epidemiology of peste des petits ruminants viruses.VirusResearch, 43(2):149-153.
[29] Kwiatek, O., Minet, C., Grillet, C., Hurard, C., Carlsson, E., & Karimov, B., et al. (2007). Peste des petits ruminants (ppr) outbreak in tajikistan.JournalofComparativePathology, 136(2-3):111-119.
[30] 刘永宏, 曹胜波, 赵丽, 等.中国小反刍兽疫疫情分析[J]. 西北农业学报, 2014, 2(9): 19-26.
LIU Yong-hong, CAO Sheng-bo, ZHAO Li, et al.(2014). Analysis of epidemic Chinese peste des petits ruminants [J].ActaAgriculturaeAoreali-occidentalisAinica, 2(9): 19-26. (in Chinese)
[31] 阮洋. 小反刍兽疫病毒F、H基因的核酸疫苗及N蛋白的原核表达研究[D]. 长春: 吉林农业大学硕士学位论文, 2011.
RUAN Yang.(2011).ExperimentalstudyonDNAvaccineofPPRVFHgeneandprokaryoticexpressionofNgene[D]. Master Thesis. Jilin Agricultural University, Changchun. (in Chinese)
[32] 罗静, 何宏轩. 小反刍兽疫病毒的分子生物学特性及其在全球的流行[J]. 河北师范大学学报, 2009, 4(33): 543-549.
LUO Jing, HE Hong-xuan.(2009). The molecular biological characterization of peste des petits ruminants virus and its prevalence in the world [J].JournalofHebeiNormalUniversity, 4(33): 543-549. (in Chinese)
GeneticEvolutionAnalysisofFgeneofPPRVinSouthernXinjiang
ZHANG Lu-yao1, 2, LI Fei2, 3, JIAO Hai-hong2, ZHAO Li2, LIU Yong-hong2
(1.nimalHusbandryandVeterinaryWorkstationsofBarkolKazakAutonomousCounty,KumulXinjiang839200,China; 2.CollegeofAnimalScience,TarimUniversity,KeyLaboratoryofTarimAnimanlHusbandryScienceandTechnologyofXinjiangProduction&ConstructionCorps,AlarXinjiang843300China; 3.AksuAnimalLoimiaControllingandDiagnosticCenter,AksuXinjiang843300,China)
ObjectiveIn order to provide a theoretical basis for the prevention and control of PPR in southern Xinjiang, the PPRV strains in 2014 was analyzed.MethodThe incidence of sheep in a sheep farm in Akesu Prefecture of southern Xinjiang was investigated. The clinical symptoms and pathological examination were performed. The PPRVFgene RT-PCR andFgene sequencing were carried out in the laboratory, and the sequence analysis of PPRVFgene was further carried out.ResultPPRVFgene sequence analysis showed that the test China/XJYL/2013 in Xinjiang had the highest homology with domestic PPRV strainFgene nucleotide. Compared with the Foreign strains, the highest homology of nucleotide is India strains Izatnagar/94 and Izatnagar-94 strains; PPRV strainFgene phylogenetic tree analysis in this study showed that the relationship of this PPRV strain had recently evolved from Beijing PPRV strain and belonged to the same branch of Ili PPRV strain, which had close evolutionary relationship with foreign strains in India and Bangladesh.ConclusionThere existed PPR epidemic in southern Xinjiang in 2014, and the epidemic strains and the domestic PPR before and after the outbreak of the PPR strains and the surrounding countries strains were relatively close to the evolution.
PPR; diagnosis;Fgene; sequence analysis
Supported by: Tarim University and Huazhong Agricultural University Scientific Research Funds "Peste-des-petits Ruminants Epidemiological Investigation in Southern Xinjiang"(HNTDLH1404)
LIU Yong-hong(1981-), male, native place: Wuchuan Inner Mongolia, Associate professor, doctoral, The research direction for infectious diseases and immune pathology, (E-mail)lyhdky@126.com
S852.6
A
1001-4330(2017)11-2118-12
2017-08-24
华中农业大学塔里木大学科研联合基金“新疆南疆小反刍兽疫流行病学调查”(HNTDLH1404)
张路瑶(1991-),男,陕西礼泉人,硕士,研究方向为动物群发性疾病的防控检测,(E-mail)875793428@qq.com
刘永宏(1981-),男,内蒙古武川人,副教授,博士,研究方向为传染病与免疫病理学,(E-mail)lyhdky@126.com

