聚乙二醇沉淀蛋清蛋白质的规律及在卵白蛋白分离中的应用
闻崇炜,赵烨清,石 莉,欧阳臻
(江苏大学药学院,江苏 镇江 212013)
聚乙二醇沉淀蛋清蛋白质的规律及在卵白蛋白分离中的应用
闻崇炜,赵烨清,石 莉,欧阳臻
(江苏大学药学院,江苏 镇江 212013)
研究3 种pH值条件下4 种聚乙二醇(polyethylene glycol,PEG)对卵白蛋白(ovalbumin,OVA)、卵转铁蛋白(ovotransferrin,OVT)与溶菌酶(lysozyme,LYZ)的沉淀效率,根据变化规律建立无需后续脱盐的OVA分离新工艺。结果表明:PEG 4000、6000、8000及10000均可有效沉淀OVA、OVT及LYZ,沉淀率受PEG质量分数及pH值影响。其中pH 7.5、PEG 4000质量分数12%时,OVA、OVT及LYZ的沉淀率相差最大,当pH值从7.5调至5.5时,3 种蛋白质沉淀率的变化幅度相差也最大。由此建立如下分离工艺:首先向pH 7.5的蛋清液中加PEG 4000至质量分数为12%,离心收集上清液,即得纯度88.1%的OVA,提取率为95.1%;再将所得上清液pH值调至5.5,离心收集上清液,所得OVA纯度提高至99.7%,提取率为87.3%。该工艺简便易行,有利于OVA的大规模制备及在食品及医药领域的应用。
聚乙二醇沉淀;相对分子质量;卵白蛋白;卵转铁蛋白;溶菌酶
鸡蛋含有多种活性蛋白质,这些蛋白质在食品及医药领域具有广泛用途[1]。例如,占蛋清总蛋白质含量54%的卵白蛋白(ovalbumin,OVA),既可提供各种人体必需氨基酸,还可与Fe3+反应形成复合物,用于制备新型补铁剂[2],也可经胰凝乳蛋白酶等处理后获得血管紧张素转化酶抑制肽、抗氧化肽等生物活性肽[3-6];占12%的卵转铁蛋白(ovotransferrin,OVT),具有与人转铁蛋白和乳铁蛋白相似的抗菌、抗病毒和抗真菌活性,有望开发为新型免疫功能因子或化疗药物的载体[7-8];占3.5%的溶菌酶(lysozyme,LYZ)可以破坏微生物细胞壁N-乙酰氨基葡萄糖胺和N-乙酰胞壁酸之间的β-1,4糖苷键,可作为肉及海鲜等食品的天然防腐剂或用于生产母乳化乳粉以提高婴幼儿的免疫力[9-11]。
这些蛋白质目前主要采用盐析法、离子交换法进行制备。傅冰等[12-13]对盐析法与离子交换法制备高纯度OVA与OVT的工艺进行了优化研究;赵哲勋[14]与张文会[15]等对盐析法与离子交换法制备LYZ的工艺进行了优化研究。此外,郅文波等[16]研究了以高速逆流色谱法制备OVA的工艺。Croguennec等[17]研究了利用两步层析法制备OVT的工艺。膜分离在蛋白质分离纯化中有广阔的应用[18]。Wan Yinhua[19]与Datta等[20]研究了用超滤法分离LYZ及OVA的工艺。为了提高鸡蛋利用率,Roy[21]、Guérin-Dubiard[22]与麻小娟[23]等还研究了OVA、OVT及LYZ的综合分离工艺。然而上述工艺通常需要贵重设备,所得产物还需要后续脱盐处理。
聚乙二醇(polyethylene glycol,PEG)是一种非离子型直链大分子聚合物,具有很强的亲水性,因而可以破坏水化层使蛋白质分子发生脱水,同时通过空间排斥作用挤压及依靠链长缠绕蛋白质分子而使其发生沉淀。PEG沉淀法操作简便、易于放大、条件温和,所得蛋白质无需脱盐,且不变性,现已备受关注[24]。郑明奇[25]、余武英[26]与Fontes[27]等分别用PEG沉淀法制得了棉铃虫幼虫中肠及脂肪体微粒体蛋白、猪胰蛋白酶与牛轮状病毒。此外,该法还广泛用于纯化重组抗体[28-31]。Geng Fang等[32]也尝试了以PEG法处理pH 6.0的鸡蛋清,但还需结合离子交换法才能制得多种活性蛋白质,分离工艺尚不够简便。鉴于目前对PEG法沉淀OVA、OVT、LYZ的规律鲜见报道,本实验因此进行了系统研究,并据此建立了简便的OVA分离工艺。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋 江苏大学恺源旅游超市;PEG 4000、6000、10000、丙烯酰胺、N,N’-亚甲基双丙烯酰胺、三羟甲基氨基甲烷、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、甘氨酸、过硫酸铵(均为分析纯)国药集团化学试剂有限公司;PEG 8000、OVA标准品(ovalbumin flake from egg white,BR级) 上海生工生物工程有限公司;N,N,N’,N’-四甲基乙二胺 美国Amresco公司;巯基乙醇 加拿大Bio Basic公司;蛋白分子质量标准品 日本Takara公司。
1.2 仪器与设备
Micro Pico17微量台式离心机 美国Thermo Scientific公司;Biofuge Stratos台式高速冷冻离心机美国Kendro(原Heraeus)公司;FE20型实验室pH计瑞士Mettler Toledo公司;TE601-L型电子天平 德国Sartorius公司;Mini-Protean3型电泳槽 美国Bio-Rad公司;DYY-6C型稳流稳压电泳仪 南京驰顺科技发展有限公司;RCT basic加热型磁力搅拌器 德国IKA公司;LC 1200液相色谱仪 美国Agilent公司;Avatar-370型傅立叶变换红外光谱仪 美国Nicolet公司;J-815型圆二色谱(circular dichroism,CD)仪 日本Jasco公司。
1.3 方法
1.3.1 蛋清液与PEG贮存液制备
手工方式分离足量鸡蛋清,两倍体积ddH2O稀释,低速搅拌均匀,随后在搅拌中调节蛋清液至预设pH值(7.5、6.5及5.5),-20 ℃保存备用。
精密称取适量PEG,加入等质量ddH2O,搅拌至PEG充分溶解,即得质量分数50%的PEG贮存液,贮存液至少静置1 d后再用于PEG沉淀。准备PEG 4000、6000、8000、10000共4 种贮存液。
1.3.2 PEG沉淀
取冻存蛋清液,化冻后以9 600×g离心20 min,称取澄清的上清液,搅拌中滴加PEG贮存液至预设质量分数,取适量样品以9 600×g离心20 min,分别收集上清液与沉淀,待后续检测。
1.3.3 蛋白质电泳
将1.3.2节所得沉淀及上清液分别加适量ddH2O溶解,取少量溶解液加等体积2×上样缓冲液,沸水浴处理15 min。SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electropheresis,PAGE)按Laemmli法[33]所述操作,12%分离胶、5%浓缩胶,70 V恒压进行电泳,待溴酚蓝指示条带到达分离胶底部后终止电泳,剥下凝胶,考马斯亮蓝R250染色。
1.3.4 蛋白质沉淀率及纯度分析
根据样品中蛋白质含量与SDS-PAGE后凝胶对应条带灰度值呈线性相关的原理进行计算[34]。采集SDS-PAGE图像,以Quantity One软件定量各条带灰度值,按公式(1)、(2)计算各样品中各蛋白质的沉淀率(PR)及纯度(PU)。
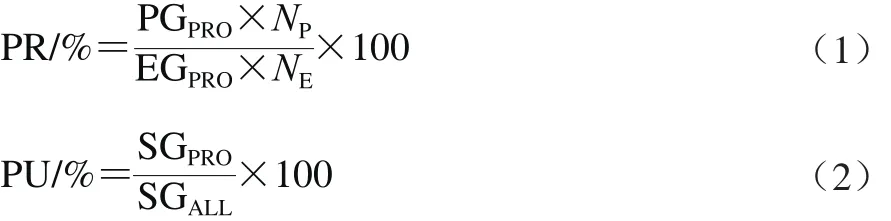
式中:PGPRO代表沉淀中待测蛋白质灰度值;EGPRO代表蛋清中待测蛋白质灰度值;NP与NE分别代表沉淀及蛋清稀释倍数;SGPRO代表样品中待测蛋白质灰度值;SGALL代表沉淀中所有蛋白质总灰度值。
1.3.5 PEG沉淀法制备OVA
称取澄清的pH 7.5蛋清液,搅拌中加PEG 4000贮存液至终质量分数为12%,9 600×g离心20 min,收集得上清液Ⅰ;将上清液Ⅰ的pH值再调至5.5,9 600×g离心20 min,收集得上清液Ⅱ。上清液Ⅰ、Ⅱ适当留样,备检测OVA含量及纯度。
1.3.6 高效液相色谱测定
采用LC 1200液相色谱仪,色谱柱为Eclipse Plus C18(100 mm×4.6 mm),流动相A:0.1%甲酸水溶液,流动相B:0.1%甲酸的乙腈溶液,OVA样品及标准品用B液溶解,0.45 μm滤膜过滤后进样。流速:1.0 mL/min(0~5 min 10% B液;7~17 min 30% B液;19~29 min 50% B液),柱温为30 ℃,进样量为20 μL,样品质量浓度为10 mg/mL,检测波长280 nm。同时再取OVA对照品及样品各一份,溶解后分别加巯基乙醇至终体积分数为10%,混匀后室温放置2 h,加适量乙腈及甲酸至高效液相色谱(high performance liquid chromatography,HPLC)初始浓度,13 000 r/min离心15 min,取上清液按上述检测条件进行HPLC分析。
1.3.7 傅里叶变换红外光谱测定
采用Avatar-370型傅里叶变换红外光谱仪,将冻干样品(约2 mg)与KBr(200 mg)充分混匀、压片,置于傅里叶变换红外光谱仪的变温附件中于4 000~400 cm-1范围内扫描。
1.3.8 CD测定
采用J-815型CD仪检测分析样品二级结构。取OVA冻干品粉末,溶于ddH2O中,比色池光径0.1 cm,远紫外区(190~250 nm)扫描,谱带宽度1.0 nm,扫描速率100 nm/min,连续扫描3 次取平均值。用平均摩尔椭圆率表示CD数据,单位为deg•cm2/dmol。通过K2D软件计算各二级结构含量。
1.3.9 PEG质量浓度测定
依据PEG可与钡离子和碘离子形成有色复合物的原理,按《中国药典》所述以比色法测定样品中PEG含量[35]。基本流程如下:精密量取样品溶液1 mL(蛋白质质量浓度不高于1 g/100 mL),加入0.5 mol/L高氯酸溶液5.0 mL,混匀,室温放置15 min,4 000 r/min离心10 min;取上清液4 mL,加入氯化钡溶液1.0 mL和0.1 mol/L碘溶液0.5 mL,混匀,室温反应15 min;535 nm波长处测定吸光度。以ddH2O代替样品溶液,同法操作作为空白对照组;精密配制10~50 μg/mL PEG 4000标准品溶液,同法操作,以标准品质量浓度对吸光度作回归直线。将样品溶液吸光度代入,计算其中PEG的质量浓度。
1.4 数据统计分析
用Microsoft Excel进行数据整理,采用GraphPad Prism 6进行作图分析,选择Two-way ANOVA采用t检验进行显著性检验。
2 结果与分析
2.1 PEG法沉淀OVA

图1 4 种PEG处理pH 7.5、6.5、5.5蛋清液时OVA沉淀率Fig. 1 Precipitation rates of OVA with four PEG fractions at different pH levels
按1.3.2节所述,取多份澄清的pH 7.5、6.5、5.5蛋清液,100 r/min低速搅拌中分别缓慢滴加PEG 4000贮存液至预设质量分数,离心收集各样品的上清液与沉淀,进行SDS-PAGE并计算OVA的沉淀率。结果表明:无论何种pH值的蛋清液,PEG 4000均可有效沉淀其中的OVA;OVA沉淀率随PEG 4000质量分数的递增而逐步上升,当其质量分数为9%~24%时,OVA沉淀率最低为1.8%,最高达94.8%;同时,以相同质量分数的PEG 4000处理3 种蛋清液,结果表明pH 5.5样品中OVA沉淀率最高,pH 6.5样品中次之,pH 7.5样品中最低(图1A)。继续用PEG 6000、8000、10000分别处理上述3 种蛋清液,结果也表明,无论何种pH值的蛋清液,这3 种PEG均可以有效沉淀其中的OVA;OVA沉淀率均随PEG质量分数的递增而逐步上升;同时相同质量分数的PEG,总体在pH 5.5蛋清液中OVA沉淀率最高,pH 7.5蛋清液中最低,这一结果可能与OVA的等电点为4.5有关(图1B~D)。
此外,PEG 10000 OVA的沉淀率总体高于相同质量分数的PEG 8000、6000、4000(图1),这是因为PEG相对分子质量越大,即链越长,越有利于发挥PEG分子的脱水、缠绕及空间排斥作用,从而越有利于沉淀OVA。分析OVA沉淀率的变化趋势还可看出,PEG 4000质量分数为12%,蛋清液pH值为7.5时,OVA沉淀率较低,即上清液中可保留较多OVA;此时,蛋清液pH值调至5.5,沉淀率增幅(7.9%)也较低,上清液中因pH值变化损失的OVA也最少。
2.2 PEG法沉淀OVT
按2.1节所述,以PEG 4000、6000、8000、10000处理pH 7.5、6.5、5.5蛋清液,计算并分析OVT沉淀率。结果表明,4 种PEG均可以有效沉淀3 种蛋清液中的OVT,OVT沉淀率均随PEG质量分数的递增而快速上升,直至OVT被完全沉淀;当PEG质量分数相同时,pH值越低的蛋清液中OVT沉淀率越高;此外,当蛋清液pH值相同且所加PEG质量分数相同时,OVT沉淀率随PEG相对分子质量增加而升高,直至被完全沉淀(图2)。


图2 4 种PEG处理pH 7.5、6.5、5.5蛋清液时OVT沉淀率Fig. 2 Precipitation rates of OVT with different PEG fractions at different pH levels
图1、2对比分析可知,同一相对分子质量PEG以相同质量分数处理相同pH值的蛋清液,OVT沉淀率均高于OVA,即相同条件下,OVT比OVA更易发生沉淀,尤其PEG 4000处理时差异高度显著。其中,质量分数12%的PEG 4000处理pH 7.5蛋清液时,OVA、OVT的沉淀率分别为1.8%、54.6%(P<0.001),同样处理pH 5.5蛋清液,OVA、OVT的沉淀率分别为9.7%、98.1%(P<0.001)。对比分析图1、2还可知,同一相对分子质量PEG以相同质量分数处理不同pH值的蛋清液,OVT沉淀率的变化幅度显著高于OVA,因此PEG法处理蛋清液后再调节其pH值,OVT比OVA更容易发生沉淀。其中,PEG 4000处理pH 7.5蛋清液至质量分数为12%后再调节pH值至5.5后,OVA、OVT的沉淀率增幅分别为7.9%(P<0.001)、43.5%(P<0.001)。
2.3 PEG法沉淀LYZ

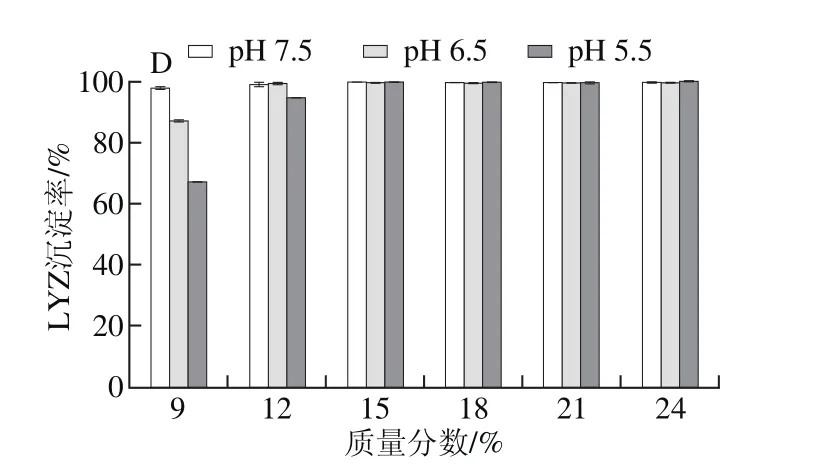
图3 4 种PEG处理pH 7.5、6.5、5.5蛋清液时LYZ沉淀率Fig. 3 Precipitation rates of LYZ with different PEG fractions at different pH levels
按2.1节所述,以PEG 4000、6000、8000、10000分别处理pH 7.5、6.5、5.5蛋清液,计算并分析LYZ沉淀率。结果表明,PEG沉淀LYZ具有与OVT相似的规律,即4 种PEG均可以有效沉淀3 种蛋清液中的LYZ,LYZ沉淀率均随PEG质量分数的递增而快速上升,直至LYZ被完全沉淀;当PEG质量分数相同时,pH值越低的蛋清液中LYZ沉淀率越高;此外,当蛋清液pH值相同且所加PEG质量分数相同时,LYZ沉淀率随PEG相对分子质量增加而升高,直至被完全沉淀(图3)。
对比分析图1、3可知,同一相对分子质量PEG以相同质量分数处理相同pH值的蛋清液,LYZ沉淀率均高于OVA,即相同条件下,LYZ比OVA更易发生沉淀,尤其PEG 4000处理时差异高度显著。其中,PEG 4000处理pH 7.5蛋清液至质量分数为12%时,OVA、LYZ的沉淀率分别为1.8%、68.3%(P<0.001),同样处理pH 5.5蛋清液,OVA、LYZ的沉淀率分别为9.7%、90.2%(P<0.001)。对比分析图1、3还可知,同一种PEG以相同质量分数处理不同pH值的蛋清液,LYZ沉淀率变化幅度显著高于OVA,因此PEG法处理蛋清液后再调节其pH值,LYZ比OVA更容易发生沉淀。其中,PEG 4000处理pH 7.5蛋清液至质量分数为12%后再调节pH值至5.5后,OVA、LYZ的沉淀率增幅分别为7.9%(P<0.001)、21.9%(P<0.001)。2.4 PEG法制备OVA
综上所述,4 种PEG在3 种pH值的蛋清液中均可有效沉淀OVA、OVT及LYZ。PEG质量分数越高,脱水及排斥作用越强,沉淀效率越高;高相对分子质量的PEG具有更长直链,缠绕作用更强,沉淀效率高于相同质量分数的低相对分子质量PEG;同时pH值可通过改变蛋白质分子表面电荷而影响其沉淀率。以蛋清蛋白质而言,OVT及LYZ比OVA更容易被PEG沉淀,鉴于以质量分数12%的PEG 4000处理pH 7.5蛋清液时,OVA、OVT及LYZ的沉淀率差异最大,当相应蛋清液pH值调至5.5时,OVA、OVT及LYZ沉淀率的变化幅度差异也最大,由此设计如下分离工艺。


图4 OVA样品的SDS-PAGE结果Fig. 4 SDS-PAGE pattern of OVA

图6 还原OVA样品的HPLC分析结果Fig. 6 HPLC prof i le of reduced OVA

图7 OVA样品的傅里叶变换红外光谱分析结果Fig. 7 Fourier transform infrared spectra of OVA

图8 OVA样品的CD分析结果Fig. 8 CD spectrum of OVA
结果表明,以质量分数12%的PEG 4000处理pH 7.5蛋清液,可以沉淀绝大多数OVT及LYZ,大部分OVA被保留在上清液中,所得上清液Ⅰ样品中OVA纯度为88.1%,提取率为95.1%;再将上清液Ⅰ的pH值调至5.5,可以进一步除去OVT及LYZ,同时只沉淀损失少量OVA,所得上清液Ⅱ样品中OVA纯度为99.7%,提取率为87.3%。SDS-PAGE检测表明所得上清液Ⅰ、Ⅱ样品中OVA纯度远高于BR级OVA标准品(图4)。HPLC检测表明,OVA样品中主峰O的保留时间为7.959 min,与标准品主峰保留时间基本一致。此外,标准品主峰中可见肩峰,样品中未见相应肩峰,表明样品纯度高于目前BR级标准品(图5)。以巯基乙醇还原OVA样品及标准品后再进行HPLC检测,可见原主峰O均消失,出现保留时间2.808 min附近的新主峰O’(图6)。收集HPLC样品进行SDS-PAGE检测,表明样品主峰O及新主峰O’均为OVA,另外两个峰为残留的少量OVT及LYZ等蛋白质。红外吸收光谱图中可见样品吸收峰(3 411、2 245、1 635、1 551 cm-1等)及峰型均与OVA标准品相吻合(图7)。CD检测表明OVA样品在222、208 nm波长处有两个负峰,195 nm波长处有一个正峰(图8),软件分析表明α-螺旋比例为28.8%,β-折叠比例为19.1%。此外,比色法测定表明1 mg精制OVA样品中PEG 4000的残留量为20.36 μg,97.32%的PEG 4000都随OVT及LYZ进入黏稠的沉淀中。因为PEG 4000具有良好的生物安全性,因此PEG的微量残留不会影响所得OVA在食品工业中的应用。
3 讨 论
我国早已成为世界上第一鸡蛋生产大国,由于鸡蛋深加工水平仍然不高,蛋清源活性蛋白质的开发应用仍有诸多不足。OVA具有很高的营养价值,又具有良好的起泡性、胶凝性、持水性等功能特性,是食品加工中重要的原辅料。目前虽然已有多项研究以改进盐析法、等电点沉淀法、离子交换法、超滤法等常用的OVA制备工艺,但因为设备贵重、产物通常仍需脱盐而影响了推广。
本实验系统研究了4 种PEG在不同质量分数及不同pH值时对OVA、OVT及LYZ沉淀率的影响,并根据PEG 4000处理pH 7.5与pH 5.5的蛋清液时,OVA、OVT及LYZ的沉淀率及沉淀率变化幅度的差异建立了新的OVA分离工艺:即首先以质量分数为12%的PEG 4000处理pH 7.5蛋清液获得纯度为88.1%的OVA,再调节样品的pH值至5.5后获得纯度为99.7%的OVA。该工艺仅需适量PEG沉淀及适当调节样品pH值,操作非常简便、无需贵重设备、易于放大,同时产物无需脱盐、具有很高的生物安全性,为OVA在食品工业的应用提供了便利。本研究所得PEG沉淀规律还为后续建立以该法为基础的综合分离利用蛋清源活性蛋白质的工艺提供了理论依据。
[1] 杨万根, 王璋, 徐玉娟, 等. 蛋清利用研究进展[J]. 食品科学, 2009,30(23): 456-459. DOI:10.3321/j.issn:1002-6630.2009.23.103.
[2] 聂珍媛, 夏金兰, 潘佳民. 卵白蛋白的分离及卵白蛋白铁的制备与表征[J]. 天然产物研究与开发, 2008, 20(5): 870-875. DOI:10.3969/j.issn.1001-6880.2008.05.028.
[3] 刘丽莉, 王焕, 李丹, 等. 鸡蛋清卵白蛋白酶解工艺优化及其结构性质[J]. 食品科学, 2016, 37(10): 54-61. DOI:10.7506/spkx1002-6630-201610010.
[4] DÁVALOS A, MIGUEL M, BARTOLOMÉB, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67(9): 1939-1944.DOI:10.4315/0362-028X-67.9.1939.
[5] XU M S, SHANGGUAN X C, WANG W J, et al. Antioxidative activity of hen egg ovalbumin hydrolysates[J]. Asia Pacific Journal of Clinical Nutrition, 2007, 16(1): 178-182. DOI:10.6133/apjcn.2007.16.s1.34.
[6] 程缘, 赵英, 迟玉杰, 等. 脱盐、超滤处理卵白蛋白源ACE抑制肽及其理化性质的研究[J]. 现代食品科技, 2015, 31(10): 203-209.DOI:10.13982/j.mfst.1673-9078.2015.10.034.
[7] 郭立华, 刘文营, 卢晓明. 卵转铁蛋白研究现状[J]. 食品工业, 2013,34(8): 188-191.
[8] 林日新, 徐明生, 杜华英, 等. 卵转铁蛋白对免疫低下小鼠Th1/Th2细胞平衡的影响[J]. 食品科学, 2011, 32(21): 243-246.
[9] 张鹏, 江明锋, 王永. 动物源溶菌酶研究进展[J]. 中国生物工程杂志,2012, 32(8): 87-93. DOI:10.13523/j.cb.20120815.
[10] 马美湖, 林亲录, 张凤凯. 冷却肉生产中保鲜技术的初步研究: 溶菌酶、Nisin、Gna液保鲜效果的比较试验[J]. 食品科学, 2002, 23(8):235-241. DOI:10.3321/j.issn:1002-6630.2002.08.072.
[11] 肖怀秋, 林亲录, 李玉珍, 等. 溶菌酶及其在食品工业中的应用[J].中国食物与营养, 2005(2): 32-34. DOI:10.13995/j.cnki.11-1802/ts.1995.05.018.
[12] 傅冰, 季秀玲, 俞汇颖, 等. 盐析法快速分离鸡蛋清卵白蛋白[J]. 江苏农业科学, 2013, 41(6): 229-230. DOI:10.15889/j.issn.1002-1302.2013.06.037.[13] 傅冰, 季秀玲, 俞汇颖, 等. 鸡蛋清中卵转铁蛋白的分离提取研究[J]. 河南农业科学, 2014, 43(3): 158-160. DOI:10.15933/j.cnki.1004-3268.2014.03.010.
[14] 赵哲勋. 从鸡蛋壳中提取分离溶菌酶[J]. 食品科学, 1993, 14(1): 45-46.[15] 张文会, 王艳辉, 马润宇. 离子交换法提取鸡蛋清溶菌酶[J]. 食品工业科技, 2003, 24(6): 57-59. DOI:10.13386/j.issn1002-0306.2003.06.023.
[16] 郅文波, 邓秋云, 宋江楠, 等. 高速逆流双水相色谱法纯化卵白蛋白[J].生物工程学报, 2005, 21(1): 129-134. DOI:10.13345/j.cjb.2005.01.027.
[17] CROGUENNEC T, NAU F, PEZENNEC S, et al. Two-step chromatographic procedure for the preparation of hen egg white ovotransferrin[J]. European Food Research and Technology, 2001,212(3): 296-301. DOI:10.1007/s002170000242.
[18] 姚红娟, 王晓琳, 丁宁. 膜分离在蛋白质分离纯化中的应用[J]. 食品科学, 2003, 24(1): 167-171. DOI:10.3321/j.issn:1002-6630.2003.01.046.
[19] WAN Yinhua, LU Junren, CUI Zhanfeng. Separation of lysozyme from chicken egg white using ultrafiltration[J]. Separation and Purification Technology, 2006, 48(2): 133-142. DOI:10.1016/j.seppur.2005.07.003.
[20] DATTA D, BHATTACHARJEE S, NATH A, et al. Separation of ovalbumin from chicken egg white using two-stage ultrafiltration technique[J]. Separation and Purification Technology, 2009, 66(2):353-361. DOI:10.1016/j.seppur.2008.12.016.
[21] ROY I, RAO M V S, GUPTA M N. An integrated process for purification of lysozyme, ovalbumin, and ovomucoid from hen egg white[J]. Applied Biochemistry and Biotechnology, 2003, 111(1): 55-63. DOI:10.1385/ABAB:111:1:55.
[22] GUÉRIN-DUBIARD C, PASCO M, HIETANEN A, et al. Hen egg white fractionation by ion-exchange chromatography[J]. Journal of Chromatography A, 2005, 1090(1/2): 58-67. DOI:10.1016/j.chroma.2005.06.083.
[23] 麻小娟, 习斌蓉, 陈红兵, 等. 一步法分离鸡蛋清中三种主要过敏原的研究[J]. 食品科学, 2009, 30(22): 40-43. DOI:10.3321/j.issn:1002-6630.2009.22.005.
[24] KUMAR V, SHARMA V K, KALONIA D S. Effect of polyols on polyethylene glycol (PEG)-induced precipitation of proteins:impact on solubility, stability and conformation[J]. International Journal of Pharmaceutics, 2009, 366(1/2): 38-43. DOI:10.1016/j.ijpharm.2008.08.037.
[25] 郑明奇, 张文吉, 邱星辉, 等. 聚乙二醇8000对棉铃虫微粒体蛋白沉淀作用的研究[J]. 农药学学报, 2005, 7(1): 81-84. DOI:10.3321/j.issn:1008-7303.2005.01.017.
[26] 余武英, 赵金梅, 肖青虎, 等. 聚乙二醇沉淀猪胰蛋白酶的研究[J].西华大学学报(自然科学版), 2011, 30(5): 96-99. DOI:10.3969/j.issn.1673-159X.2011.05.026.
[27] FONTES L V Q, CAMPOS G S, BECK P A, et al. Precipitation of bovine rotavirus by polyethylen glycol (PEG) and its application to produce polyclonal and monoclonal antibodies[J]. Journal of Virological Methods, 2005, 123(2): 147-153. DOI:10.1016/j.jviromet.2004.09.023.
[28] GIESE G, MYROLD A, GORRELL J, et al. Purif i cation of antibodies by precipitating impurities using Polyethylene Glycol to enable a two chromatography step process[J]. Journal of Chromatography B, 2013,938: 14-21. DOI:10.1016/j.jchromb.2013.08.029.
[29] SOMMER R, SATZER P, TSCHELIESSNIG A, et al. Combined polyethylene glycol and CaCl2precipitation for the capture and purif i cation of recombinant antibodies[J]. Process Biochemistry, 2014,49(11): 2001-2009. DOI:10.1016/j.procbio.2014.07.012.
[30] HU X T, LIU C M, JIN Z Y, et al. Fractionation of dextrin by gradient polyethylene glycol precipitation[J]. Journal of Chromatography A,2016, 1434: 81-90. DOI:10.1016/j.chroma.2016.01.021.
[31] HAMMERSCHMIDT N, HOBIGER S, JUNGBAUER A. Continuous polyethylene glycol precipitation of recombinant antibodies: sequential precipitation and resolubilization[J]. Process Biochemistry, 2016,51(2): 325-332. DOI:10.1016/j.procbio.2015.11.032.
[32] GENG Fang, HUANG Qun, WU Xiaofen, et al. Co-purification of chicken egg white proteins using polyethylene glycol precipitation and anion-exchange chromatography[J]. Separation and Purification Technology, 2012, 96: 75-80. DOI:10.1016/j.seppur.2012.05.021.
[33] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685.DOI:10.1038/227680a0.
[34] 闻崇炜, 毛春友, 胡萍萍, 等. Tricine 蛋白质电泳定量检测溶菌酶方法的研究[J]. 江苏农业科学, 2012, 40(5): 290-292. DOI:10.15889/j.issn.1002-1302.2012.05.001.
[35] 国家药典委员会. 中华人民共和国药典三部[M]. 北京: 化学工业出版社, 2005: 附录32.
Protein Precipitation from Egg White with Polyethylene Glycol and Its Application for Ovalbumin Separation
WEN Chongwei, ZHAO Yeqing, SHI Li, OUYANG Zhen
(School of Pharmacy, Jiangsu University, Zhenjiang 212013, China)
This work was carried out to investigate the effect of polyethylene glycol (PEG) molecular weight, PEG dosage and pH value of egg white on the precipitation rate of ovalbumin (OVA), ovotransferrin (OVT) and lysozyme (LYZ), and further to establish a new procedure for the separation of OVA from egg white. It was found that OVA, OVT and LYZ could be precipitated by PEG 4000, 6000, 8000 or 10000. In addition, the precipitation rate of OVA, OVT and LYZ was signif i cantly inf l uenced by PEG dosage and pH. By addition of 12% PEG and at pH 7.5, the maximum difference between the precipitation rates of OVA, OVT and LYZ was observed. This result was also obtained when pH was adjusted to 5.5.Therefore, OVA could be produced by the following procedure. PEG 4000 was added into egg white (pH 7.5) until its concentration reached 12%, and then the supernatant was collected after centrifugation as OVA with a recovery of 95.1%and a purity of 88.1%. The purity was increased to 99.7%, while the recovery was decreased to 87.3% by adjusting the pH to 5.5 and collecting centrifugal supernatant. This purif i cation procedure was simple and easy to operate and could facilitate large-scale production and application of OVA in food and medicinal fi elds.
polyethylene glycol precipitation; relative molecular weight; ovalbumin; ovotransferrin; lysozyme
10.7506/spkx1002-6630-201801004
TS253.4;Q503
A
1002-6630(2018)01-0029-07
闻崇炜, 赵烨清, 石莉, 等. 聚乙二醇沉淀蛋清蛋白质的规律及在卵白蛋白分离中的应用[J]. 食品科学, 2018, 39(1):29-35.
10.7506/spkx1002-6630-201801004. http://www.spkx.net.cn
WEN Chongwei, ZHAO Yeqing, SHI Li, et al. Protein precipitation from egg white with polyethylene glycol and its application for ovalbumin separation[J]. Food Science, 2018, 39(1): 29-35. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801004. http://www.spkx.net.cn
2016-10-05
国家自然科学基金面上项目(81573529);江苏省普通高校研究生实践创新计划项目(SJLX15_0512)
闻崇炜(1971—),男,副教授,博士,主要从事生物活性蛋白质分离及功能研究。E-mail:wenchw@ujs.edu.cn

