高溶氧对西伯利亚鲟幼鱼非特异性免疫指标的影响
王晓雯,朱 华,马国庆
(北京市水产科学研究所,渔业生物技术北京市重点实验室,北京 100068)
高溶氧对西伯利亚鲟幼鱼非特异性免疫指标的影响
王晓雯,朱 华*,马国庆
(北京市水产科学研究所,渔业生物技术北京市重点实验室,北京 100068)
【目的】为揭示高溶解氧对西伯利亚鲟幼鱼非特异性免疫指标的影响。【方法】分别设置了5个溶氧水平组(为6、8、10、12、14mg/L),在养殖试验第100d分析了西伯利亚鲟外周血白细胞的吞噬活力、脾脏细胞吞噬活性、血清与黏液中溶菌酶活性、碱性磷酸酶活性和酸性磷酸酶活性以及血清杀菌活力。【结果】西伯利亚鲟的血清杀菌活力、脾脏巨噬细胞的呼吸爆发活力和外周血白细胞吞噬活力分别在10、10、12mg/L下达到峰值,而肝脏酸性磷酸酶活力无明显差异,8、10、12、14mg/L下鲟鱼碱性磷酸酶活力略微低于6mg/L组。【结论】在6~12mg/L范围内适当提高溶解氧含量可刺激西伯利亚鲟鱼血清和脾脏的杀菌活力,但肝脏中碱性磷酸酶参与的免疫防御功能受到略微影响。
西伯利亚鲟;高溶氧;吞噬活力;碱性磷酸酶;酸性磷酸酶;杀菌活力
西伯利亚鲟(Acipenser baeri)属鲟科(Acipenseridae),鲟属(Acipenser),属于软骨硬鳞类[1],是我国引自欧洲的鲟鱼种类,由于其食谱广、易驯养、生长快[2],现已成为我国常见的养殖品种,具有较高的经济价值和研究价值。近年来,我国逐渐开展了循环水工厂化养殖模式的研究,为追求高产,人们往往采取高密度养殖,传统的充氧方式很难保证高密度养殖鱼类的健康成长,生产中常用补充液氧的方式来维持水体较高溶解氧水平。
溶解氧是水产养殖的一个重要环境因子,水体溶解氧浓度直接关系到鱼类的生存、生长和代谢水平[3]。目前已有一些研究表明高溶解氧可提高鱼类的生长速度、调节鱼类生理平衡[4-5]。但是在超饱和溶氧条件下产生的过多氧自由基(ROS)会攻击生物细胞中蛋白质、脂肪和核酸等细胞结构及组织,导致机体损伤[6]。况新宇等[7]研究表明,高溶解氧可刺激西伯利亚鲟肝脏提高抗氧化应激酶活力,短期内肝脏功能受到一定影响,然而30d后鱼体得到恢复。目前,有关温度、免疫添加剂和养殖密度等对鲟鱼的免疫力影响的研究比较多[8-14],但高溶解氧对鲟鱼免疫力影响的研究尚无报道。为探究高溶解氧的养殖条件是否对鲟鱼免疫力造成影响,本文以西伯利亚鲟(Acipenser baeri)作为试验对象,从非特异性免疫途径,研究不同溶解氧浓度对鱼体的影响,从而为环境因子对鱼类免疫机能的研究提供数据,并以期为鲟鱼高密度养殖的进一步发展提供理论依据。
1 材料和方法
1.1 试验用鱼及饲养
实验用西伯利亚鲟幼鱼来自北京市十渡鲟鱼繁殖基地,运至实验室后,在循环水系统中暂养7d,水温(20±2)℃。养殖容器为蓝色平底圆柱形PP水槽,内径约1m,水深0.5m。其初始体长(L)和体重(W)分别为(17.9±0.36)cm 和(20.83±0.21)g,挑选规格统一的健康西伯利亚鲟进行实验。
实验用水为曝气和过滤后的自来水。实验期间,水温为(18±4)℃,每天投喂3次,日投饵量为鱼体质量的2%,定期排污。取样前24h内停止投喂。
1.2 饲养试验
饲养试验分4组,分别为对照组A,高溶氧组B、C、D,每组3个平行,每平行100尾。试验在一个循环养殖系统内进行,投喂方式、饲养管理相同。循环系统内气泵增氧,溶氧达(6.2±0.3)mg/L。试验期间,高溶氧组用纳米气盘充入液氧,通过调节每个气盘的阀门,控制 B组缸内均溶氧(8.5±0.3)mg/L;C组缸内均溶氧(10.35±0.4)mg/L;D组缸内均溶氧(12.2±0.5)mg/L。试验期间水温(18±1)℃。饲养试验共100d。在饲养结束时,每平行组随机取3尾鱼进行样品的采集。
1.3 样品的提取和制备
血清的制备:每平行组每次随机取2尾鱼,用1mL无菌注射器于西伯利亚鲟尾静脉采集血液,置于无菌离心管,室温放置1h后4℃过夜,4℃ 2 000×g离心10min后分别取等量上清混合,保存于-80℃待用。
黏液的制备:将取过血的鱼用洁净自来水冲洗鱼体表,再用0.9%灭菌生理盐水洗涤2次,用吸水纸吸取多余水分。用玻片从鱼体鳃盖后缘向后刮取体表黏液,置于1.5mL的离心管,加入等体积生理盐水混匀,4℃下10 000×g离心20min,每组2尾等量上清液混合。-80℃保存备用,参照韩雯等[15]的方法。
外周血白细胞的分离:
采集血液后,加入到等体积的肝素钠抗凝剂中,再加入等量的RPMI-1640细胞培养液(Hyclone,美国),配成单细胞悬液后静置1h。根据说明书,将细胞悬液缓慢加到已经配置好的具有明显分层的Percoll(Pharmacia,美国)不连续密度梯度离心管中,4℃,840×g离心30min,收集不同浓度Percoll界面处的白细胞层,用PBS重悬后离心(4℃,640×g,5min),洗涤3次备用。
脾脏组织细胞的获取:
用75%的酒精冲洗西伯利亚鲟体表,然后解剖,取出脾脏,用PBS冲洗3次,剪碎组织,用细胞筛过滤,滤过的细胞再加入500μL 0.9%生理盐水冲洗,4℃,500×g离心5min,弃上清,加入500μLRMPI1640细胞培养基重悬细胞,待用。
1.4 外周血白细胞吞噬活力
参照Zhang等[15,23]的方法,用PBS冲洗下在LB培养基上培养16h的嗜水气单胞菌(Aeromonas hydrophila),在10 000×g下离心 5min,用RMPI1640培养基重悬。在65℃水浴灭活1h。将灭活的细菌加入溶有FITC(终浓度为100μg/mL)的二甲基亚砜(DMSO)溶液中,30℃孵育1h后用PBS洗5次,然后用RMPI1640培养基重悬调至浓度为1×108个/mL作为标记的嗜水气单胞菌悬液。取100μL FITC标记好的菌液加入到1mL浓度为1×106个/mL的白细胞悬液中,混匀后于28℃孵育1h。将白细胞在500×g下离心10min,PBS洗涤3次,再加入1mL 0.125%台盼蓝孵育5min,淬灭胞外荧光。用PBS洗涤2~3次,用0.9%生理盐水重悬细胞,上流式细胞仪(Partec,德国)分析。以不孵育FITC标记细菌的西伯利亚鲟白细胞为对照首先在FSC和SSC二维点阵图选取白细胞区域,然后再以FL1(FITC)直观柱状图统计该区域FITC阳性(吞噬标记嗜水气单胞菌)的白细胞,每份样品检测10 000以上个白细胞,比较不同溶解氧含量试验组的FITC阳性白细胞数,以每1 000个白细胞吞噬嗜水气单胞菌的个数表示白细胞吞噬活力,每组测3个平行,求平均值。
1.5 血清杀菌活力
LB液体培养基27℃培嗜水气单胞菌(Aeromonas hydrophila,由上海海洋大学吕利群教授惠赠),待菌液浑浊,于10 000r/min下离心1min,倾倒培养基,用0.85%生理盐水将菌液调整到1×106/L制备细菌悬液。取200μL血清混合于200μL细菌悬液,28℃下温育1h,取细菌和血清混合物涂在LB平板上,28℃下培养48h,计算各平板中细菌菌落数,以涂有0.85%生理盐水的作为对照组,计算血清的杀菌百分率,杀菌率=(1-试验组菌落数/对照组菌落数)×100%[16]。
1.6 血清溶菌酶活力
参照Hutchinson等[17]的方法,以0.75mg/mL的溶壁微球菌冻干粉为底物,用磷酸钾盐缓冲液(pH=6.4)作为底物悬液。取190μL预冷的细菌悬液加入酶标板内,并加入10μL待测样品,混匀,于570nm处测定其OD值A0。之后于37℃温育40min,取出后冷却至室温,测其吸光度值A。测定的溶菌酶活力为U=(A0-A)/A。每个样品测3个平行。
1.7 碱性磷酸酶活力、酸性磷酸酶活力
试验中各试验组碱性磷酸酶和酸性磷酸酶活力均采用南京建成生物工程技术研究所提供的试剂盒进行测定。
1.8 脾脏巨噬细胞呼吸爆发测定
解剖鱼,取出脾脏,用PBS冲洗后,剪碎,用100目细胞筛过滤,加入500μL细胞培养液l RMPI1640,4℃,500×g下离心 5min,弃去上清,再加入 500μL细胞培养液重悬细胞。
参照文献[18],采用NBT法测定呼吸爆发。将细胞悬液调为1×107cells/mL,在96孔细胞培养板上每孔加入100μL,每尾鱼做3个平行,空白对照为加入100μL生理盐水。将细胞培养板放入28℃培养箱中培养1h,待细胞贴壁后弃掉培养液,每孔再加入 100μL NBT,继续培养 1h,再弃掉 NBT,用 PBS冲洗后,加入75%乙醇固定10min,弃掉乙醇,加入120μL KCL(2 mol/L)和140Μl DMSO(1mg/mL),混匀后,用酶标仪(BioTek,美国)600nm吸光值。
1.9 数据处理
实验数据采用平均值(M)±标准差(SD)表示,利用SPSS17.0软件的ANOVA单因素方差分析,对不同组织间均值进行统计学显著性差异分析。首先对数据进行正态分布和方差齐性检验,如果ANOVA分析有意,再用Duncan进行两两比较。显著性水平设为P<0.05。
2 结果
2.1 不同溶解氧下西伯利亚鲟的外周血白细胞吞噬活力
通过流式细胞术检测西伯利亚鲟幼鱼的外周血白细胞吞噬活力,如图1(a)和图1(b)所示,图1(a)是白细胞的FSC-SSC图,去掉信号感染的选择Q2区域细胞进行绿色荧光的检测,图1(b)中FL1 subject显示吞噬掉细菌的细胞。各组FITC阳性白细胞数量统计分析结果见图2。可知,在溶解氧含量为12mg/L,白细胞吞噬活力达到峰值,且在溶解氧含量为10、14mg/L相比对照组,6、8mg/L组显著升高(P<0.05),而在溶解氧含量12mg/L下的白细胞吞噬活力具极显著差异(P>0.05)。表明,溶解氧的升高,促进白细胞的吞噬作用,但升至14mg/L,白细胞吞噬活力有所降低。
2.2 不同溶解氧下西伯利亚鲟的血清杀菌活力
5种溶氧条件下,西伯利亚鲟幼鱼血清杀菌活力结果如图3所示。8mg/L相比其余各组达到最大值(P<0.05),而溶解氧含量再升高到12、14mg/L,血清杀菌活力下降,与溶解氧含量6mg/L的活力相一致。
2.3 不同溶解氧下西伯利亚鲟的血清溶菌酶活力
在高溶氧含量下西伯利亚鲟幼鱼血清溶菌酶活力水平也相比6mg/L下的活力高,但无显著性差异(P>0.05),如图4所示。
2.4 不同溶解氧含量下西伯利亚鲟肝脏碱性磷酸酶活力、酸性磷酸酶活力
在不同溶解氧含量下,西伯利亚鲟幼鱼肝脏碱性磷酸酶活力(见图5)和酸性磷酸酶活力(见图6)的差异大体一致,均低于6mg/L组。酸性磷酸酶活力差异不显著,碱性磷酸酶活力的差异具有显著差异,这暗示西伯利亚鲟可能在高氧状态下机体生命代谢受到一定的影响。
2.5 不同溶解氧含量下西伯利亚鲟脾脏巨噬细胞的呼吸爆发活力
西伯利亚鲟幼鱼脾脏巨噬细胞呼吸爆发活动在高氧组(8、10、12mg/L)均高于 6mg/L 组,并在10mg/L溶氧含量下达到峰值(光密度值0.124±0.035),溶解氧含量14mg/L组巨噬细胞呼吸爆发活动降到最低值,显著低于其余各组(P<0.05),可见14mg/L的溶氧含量影响到鱼体巨噬细胞的呼吸爆发活动。不同溶解氧含量西伯利亚鲟脾脏巨噬细胞的呼吸爆发活力如图7所示。
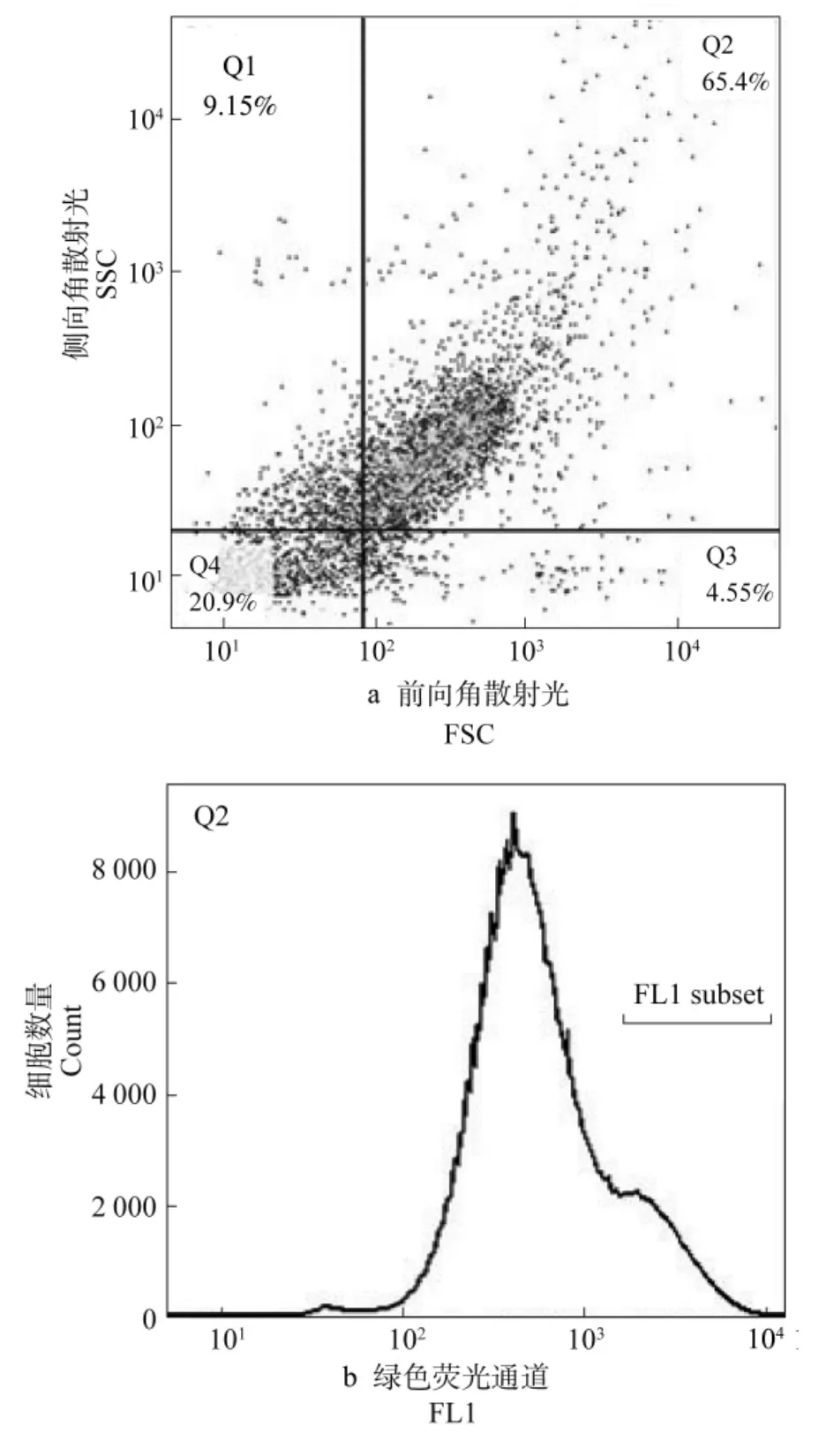
图1 西伯利亚鲟外周血白细胞吞噬FITC标记嗜水气单胞菌流式细胞术检测图Figure 1 Detection figure of FITC-labled A.hydrophila phagosytized by sturgeon leukocyte
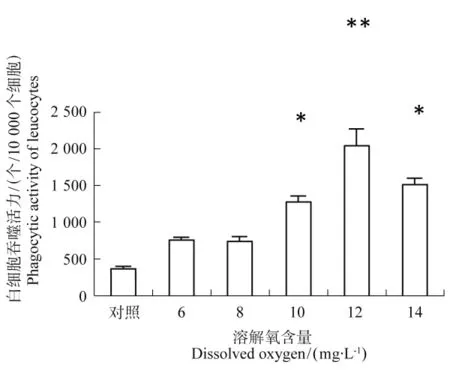
图2 不同溶解氧含量西伯利亚鲟幼鱼外周血白细胞吞噬活力Figure 2 Phagocytic activity of leucocytes of sturgeon in different DO group
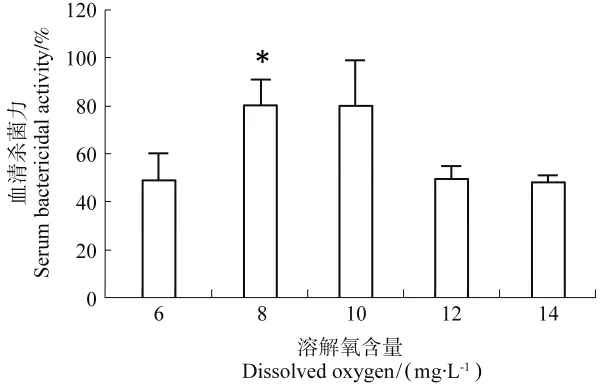
图3 不同溶解氧下西伯利亚鲟的血清杀菌活力Figure 3 Serum bactericidal activity of sturgeon in different DO group
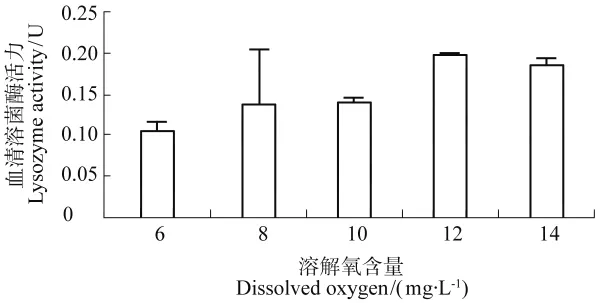
图4 不同溶解氧下西伯利亚鲟的血清溶菌酶活力Figure 4 Lysozyme activity of serum in sturgeon under different DO
3 讨论
鱼类属于低等脊椎动物,具有特异性和非特异 性免疫功能,以保护鱼体免受病原侵袭。病原进入机体后,首先接触的是鱼体的体表黏液细胞、内皮组织和吞噬细胞,这些构成了鱼体内非特异性免疫应答的第一道防线[15],在防御病原入侵及清除体内病原过程中发挥着关键作用。影响鱼体免疫功能的因素很多,如个体遗传发育、温度[10]、溶解氧含量[19]、盐度胁迫[20]等。已有报道表明高水温对杂交鲟的非特异性免疫有显著的抑制作用,同样慢性低氧胁迫抑制黄颡鱼的免疫机能,严重抑制巨噬细胞的活性。本文探究了高氧对西伯利亚鲟幼鱼非特异性免疫机能的影响,研究结果显示高氧胁迫下,高溶解氧组的西伯利亚鲟血清溶菌酶活力高于低溶氧组,而血清杀菌活力和巨噬细胞活力均在10mg/L组达到峰值,而更高的解氧含量(14mg/L)导致肝脏的代谢受到一定影响。
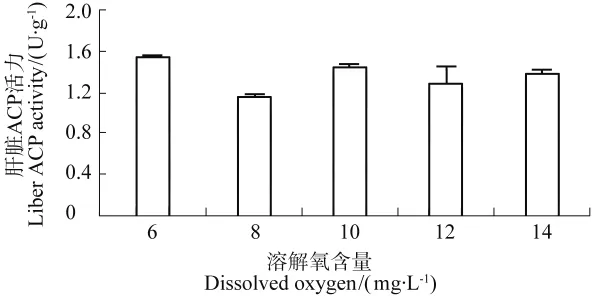
图5 不同溶解氧含量西伯利亚鲟肝脏酸性磷酸酶活力Figure 5 ACP activity of liver in sturgeon under different DO
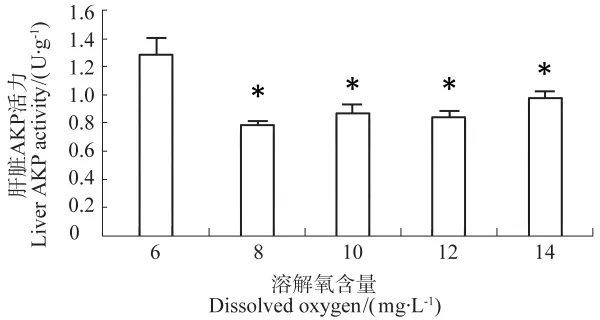
图6 不同溶解氧含量西伯利亚鲟肝脏碱性磷酸酶活力Figure 6 AKP activity of liver in sturgeon under different DO
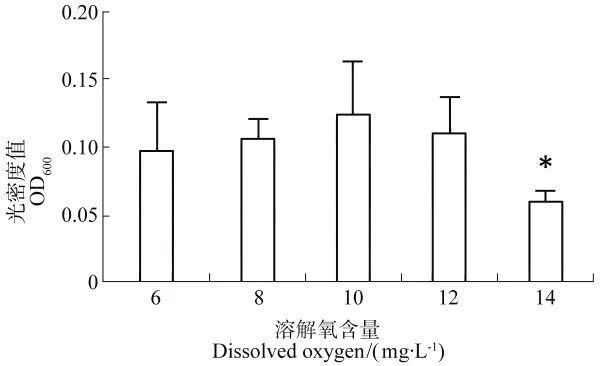
图7 不同溶解氧含量西伯利亚鲟脾脏巨噬细胞的呼吸爆发活力Figure 7 Respiratory burst of splenic macrophage in sturgeon under different DO
巨噬细胞和外周血白细胞是重要的免疫细胞,对侵入机体的异物及衰老死亡的细胞具有吞噬功能,发挥非特异性免疫功能。巨噬细胞可依赖其分泌的细胞因子发挥免疫调节作用;白细胞,可吞噬异物产生抗体,在机体损伤治愈、抵抗病原入侵起到重要作用[15]。外周血白细胞吞噬活力是衡量鱼类非特异性免疫力高低的一个重要指标,吞噬作用是清除侵入鱼体的病原的主要途径。本试验结果显示,12mg/L溶解氧组的外周血白细胞吞噬活力高于其余各组,14mg/L组反而较低。提示过高的溶解氧含量下,西伯利亚鲟的外周血参与的免疫过程受到一定抑制。
活化的脾脏巨噬细胞内部会产生显著的有氧代谢爆发,电子发生转移,最终产生丰富的反应性氧中间体,此过程为氧呼吸爆发。这些氧中间体均具有显著的化学反应性,作用靶分子范围广泛,是最有效的抗菌物质。本文用NBT法检测鱼体的脾脏巨噬细胞呼吸爆发活力,结果显示,随着溶解氧含量的升高,鱼体的脾脏巨噬细胞呼吸爆发活力逐渐升高,在溶氧为10mg/L时达到峰值,并且在溶氧14mg/L的活力显著低于对照组(P<0.05),表明溶解氧含量在一定范围的升高可促进鲟鱼体内脾脏巨噬细胞的呼吸爆发活力,促进非特异性免疫,然而溶解氧含量升高至14mg/L时脾脏巨噬细胞的呼吸爆发活力下降。
溶菌酶是一种专门作用于微生物细胞壁的水解酶,又称为N-乙酰基胞壁酰水解酶,其功能是水解G+菌细胞壁上的乙酞氨基键,使进入体内的细菌细胞壁溶解[21],广泛存在于鱼类的血清、皮肤黏液和组织器官当中,作为鱼类的非特异性免疫物质之一,在鱼体防御系统中扮演着重要角色。本试验中,西伯利亚鲟在养殖100d时,溶解氧高的组血清溶菌酶活力高于溶解氧含量低的组,但无显著差异(P>0.05)。这与在黄颡鱼的不同溶氧试验中4个溶解氧浓度处理组的溶菌酶活力变化趋势不一致,但两个试验中不同溶氧组血清溶菌酶活力均无显著差异[19]。经过100d不同溶氧下的养殖,各组血清溶菌酶活力无明显差异,表示溶菌酶不可作为鲟鱼对长期高氧胁迫的应激信号。
鱼体肝脏碱性磷酸酶、酸性磷酸酶均直接在生物体内参与磷酸基团的转移代谢,是机体生长代谢、保持内环境温度以维持机体健康所必需的酶。碱性磷酸酶参与机体免疫预防主要机制是催化有机磷酸酯水解,释放磷酸离子,可以改变细菌表面结构,增强其异己性,从而被体内吞噬细胞吞噬和降解。酸性磷酸酶是动物体内巨噬细胞溶菌酶的标志酶,在体内直接参与磷酸基团的转移和代谢,主要存在于肝脏、脾脏和红细胞,溶酶体的水解作用是机体攻击异物的主要机制之一[22]。酸性磷酸酶和碱性磷酸酶都受着营养状况、环境变化及疾病的影响,当免疫水平降低或增高时它们也会发生变化。本实验中西伯利亚鲟肝脏酸性磷酸酶活力在不同溶解氧条件下未发生明显变化,碱性磷酸酶活力在溶氧含量8、10、12、14mg/L的均明显低于溶氧6mg/L的。表明西伯利亚鲟在高氧胁迫下的代谢能力有所减弱或者免疫调节能力有所下降。
综上所述,在不同溶解氧含量的条件下,西伯利亚鲟的血清杀菌活力、脾脏巨噬细胞的呼吸爆发活力的最高值均出现在10mg/L组,外周血白细胞吞噬活力的最高值出现在12mg/L,而14mg/L组的各项非特异性免疫指标均出现降低。可见一定程度地提高溶解氧含量可刺激鲟鱼血清和脾脏的杀菌活力。而肝脏酸性磷酸酶活力无明显变化,碱性磷酸酶活力有略微下降,可见肝脏中碱性磷酸酶参与的免疫防御功能受到一些影响。
[1] 谢忠明,孙大江,王树京,等.鲟鱼养殖技术[M].北京:中国农业出版社,2000:258-263.
[2] 曲秋芝,高艳丽.西伯利亚鲟的人工繁殖[J].中国水产科学,2005,12(4):492-495.
[3] WEI L Z,ZHANG X M,HUANG G Q.Effects of limited dissolved oxygen supply on the growth and energy allocation of Juvenile Chinese Shrimp,Fenneropenaeus chinensis[J].World Aquaculture Society,2009,40(4):483-492.
[4] 张钊,李荣,郭惠,等.不同溶解氧水平对工厂化养殖大菱鲆生长及肌肉生化组分的影响[J].水产科学,2014,33(8):520-523.
[5] 胡国宏,孙广华,朱世成,等.低溶氧量对怀头鲇呼吸代谢耗氧率的影响[J].动物学杂志,2002,37(2):46-48.
[6] FANG Y Z.Reactive oxygen species in organisms[C].FANG Y Z,ZHENG R L,Eds.Theory and application of free radical biology.Beijing:Science Press,2002:122-126
[7] 况新宇,王晓雯,朱华.高溶氧量对西伯利亚鲟抗氧化酶活力及肝脏损伤相关指标的影响[J].水产科技情报,2016(4):198-202.
[8] 田照辉,徐绍刚,王巍,等.急性热应激对西伯利亚鲟HSP70m RNA表达、血清皮质醇和非特异性免疫的影响[J].水生生物学报,2013,37(2):344-350.
[9] 白海文.温度对施氏鲟幼鱼生长、消化及免疫功能影响的研究[D].上海:上海海洋大学,2012.
[10] 王静波,曹欢,王小亮,等.高水温对杂交鲟主要免疫指标的影响[J].大连水产学院学报,2015(5):484-488.
[11] 宋超,牛翠娟,朱华.不同多糖对史氏鲟非特异性免疫反应的影响[J].水生生物学报,2009,33(3):455-460.
[12] 李莎,管敏,郭文韬,等.微生物制剂对中华鲟生长、消化酶及非特异性免疫酶活性的影响[J].水产学杂志,2014(1):50-54.
[13] 刘红柏,卢彤岩,张春燕,等.黄芪对史氏鲟抗氧化能力及免疫力的影响[J].大连海洋大学学报,2006,21(3):231-235.
[14] 曹阳,李二超,陈立侨,等.养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[J].水生生物学报,2014(5):968-974.
[15] 韩雯,王秀华,王玉娟,等.皂角苷对大菱鲆非特异免疫的增强作用[J].水产学报,2014,38(7):999-1008.
[16] ZHANG J,CHEN L,SUN L.SmLMWPTP,a teleost low molecular weight protein tyrosine phosphatase,inhibits the immune response of peripheral blood leukocytes in a manner that depends on the conserved P-loop[J].Developmental&Comparative Immunology,2013,40(2):103-111.
[17] 秦启伟,吴灶和,周永灿,等.饵料维生素C对青石斑鱼的非特异性免疫调节作用[J].热带海洋学报,2000,19(1):58-63.
[18] HUTCHINSON T H,MANNING M J.Seasonal trends in serum lysozyme activity and total protein concentration in dab(Limanda limanda L)sampled from Lyme Bay,U.K.[J].Fish&Shellfish Immunology,1996,6(7):473-482.
[19] SECOMBES C J.Isolation of salmonid macrophages and analysis of their killing activity[J].Techniques in Fish Immunology,1990:137-163.
[20] 沈凡,樊启学,杨凯,等.不同溶氧条件下黄颡鱼免疫机能及抗病力的研究[J].淡水渔业,2010,40(4):44-49
[21] 王晓雯,朱华,况新宇,等.盐度胁迫对杂交鲟生理及存活的影响[J].水产科学,2015(10):597-602.
[22] GRINDE B,JOLLES P.Purification and characteristic of two lysozymes from rainbow trout(salmogairdneri)[J].European Journal of Biochemistry,1998(173):169-273.
[23] 牟海津,江晓路,刘树青,等.免疫多糖对栉孔扇贝酸性磷酸酶、碱性磷酸酶和超氧化物歧化酶活性的影响[J].青岛海洋大学学报(自然科学版),1999(3):463-464.
Effects of Hyperoxia on Non-specific Immunology in Acipenser Baeri
WANG Xiao-wen,ZHU Hua,HU Hong-xia,MA Guo-qing
(1.Beijing Key Laboratory of Fishery Biotechnology,Beijing Fisheries Research Institute,Beijing 100068,China)
【Objective】Evaluate the effects of hyperoxia on non-specific immunity of juvenile sturgeon.【Methods】Acipenser baeri juveniles with body weight of(20.83±0.21)g were raised in different five dissolved oxygen level(6,8,10,12,14mg·L-1).The serum immune indicators,activities of lysozyme,ACP,AKP and antibacterial in mucus and serum were analyzed at 100d after the hyperoxia stress.【Results】The results showed that the antibacterial activity of serum,leukocytes phagocytic activity,respiratory burst of macrophage in spleen respectively reached maximum at group of 10mg·L-1,10mg·L-1,12mg·L-1.What’s more,the activity of ACP in liver of all groups did not have remarkable differences,and activities of AKP in 8,10,12,14mg·L-1group were slightly lower than in 6mg·L-1group.【Conclusion】In conc-lusion,some level of high dissolved oxygen within 6~12mg·L-1could promote the antibacterial activity of serum and spleen to a certain degree.However,the immune defense function of alkaline phosphatase in liver was influenced slightly.
Acipenser baer;hyperoxia;phagocytosis;alkaline phosphatase;acid phosphatase;antibacterial activity
S943
A
1000-2650(2017)01-0093-06
10.16036/j.issn.1000-2650.2017.01.014
2016-10-28
国家科技支撑计划项目(2015BAD25B01);现代农业产业技术体系北京市鲟鱼、鲑鳟鱼创新团队项目(SCGWZJ2 0161104);中央引导地方科技发展专项(名优水产良种选育与养殖技术推广Z161100004516003)。
王晓雯,助理研究员,主要研究方向为水产免疫生理,E-mail:wxw211@126.com。*责任作者:朱华,研究员,主要研究方向为水产养殖与生理生态,E-mail:zhuhua@bjfishery.com。
(本文审稿:耿 毅;责任编辑:秦碧雯;英文审稿:刘益平)

