不同解磷菌群对复垦土壤磷素形态及油菜产量的影响
刘玲利,卫 迎,刘 洋,洪坚平
(山西农业大学 资源环境学院,山西 太谷 030801)
矿山开采活动对矿区土壤造成了严重破坏。矿区复垦土壤贫瘠,养分含量低,微生物数量少,活性低[1],而有益微生物可通过多方面的作用加速复垦进程,促进植物的生长发育[2]。磷是植物生长发育的必需营养元素,参与许多植物生理代谢过程,然而,缺磷是我国及世界农业生产中限制作物产量的一个重要因子,其原因主要为磷肥施入土壤后易被土壤固定,导致磷肥利用率低[3]。解磷微生物可以将土壤中难溶态磷转换为有效磷[4-5],有研究表明,解磷微生物能够提高磷肥利用率、土壤磷素的含量以及增加作物增产量[6-7]。梁利宝[8]研究表明,解磷细菌能够促进石灰性土壤中磷素形态向易被作物吸收利用态转化,同时可减缓其向缓效态、难溶态的转化。目前,关于不同浓度解磷菌群对复垦土壤磷形态影响的研究较少。
本研究从石灰性土壤中筛选分离出不同种类解磷细菌和解磷真菌,进行油菜盆栽试验,研究不同浓度下单施解磷细菌群、解磷真菌群以及混施解磷细菌群和真菌群对油菜土壤磷素形态、油菜产量和吸磷量的影响,以期为提高复垦土壤的磷素作物有效性、合理培肥复垦土壤、减少浪费与污染、提高磷肥利用率及有效指导农业生产提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 供试土壤 试验采用土壤为山西省长治市襄垣县采煤塌陷区复垦1年的土壤,属石灰性褐土,质地为中壤土。其有机质含量为2.19 g/kg,全氮含量为0.05 g/kg,全磷含量为0.37 g/kg,碱解氮含量为20.18 mg/kg,有效磷含量为0.85 g/kg,速效钾含量为72.50 g/kg。
1.1.2 供试作物 供试油菜(Blassikakapestris)品种为四月蔓。
1.1.3 供试肥料 尿素:含氮460 g/kg;磷矿粉:含P2O5190 g/kg;硫酸钾:含K2O 540 g/kg;有机肥:含有机质389 g/kg,含N2 15 %,含P2O510.6 g/kg,K2O 13.1 g/kg。
菌群:解磷细菌(假单胞细菌1、假单胞细菌2和拉恩氏菌,经验证它们无拮抗反应,将这3株解磷细菌混合培养后经高密度发酵后制成液体菌剂),解磷真菌(黑曲霉和青霉,经验证它们无拮抗反应,将这2株解磷细菌混合培养后经高密度发酵后制成液体菌剂)。
1.2 试验方法
以解磷细菌、解磷真菌以及2种解磷菌群混施对复垦土壤进行处理,每一菌液设置C1(1 mL/盆)、C2(4 mL/盆)、C3(7 mL/盆)3个浓度,其中,混合菌液按1∶1进行配置,另外设置不施解磷菌群处理C0和不施肥对照处理CK,共11个处理,每个处理重复3次,共装33盆。盆栽试验用盆钵为15 cm×10 cm的塑料盆,土壤过2 mm筛后,装盆,每盆装风干土1.2 kg。除不施肥处理外,其余每盆都施入相同的基肥(尿素0.33 g,磷矿粉0.83 g,硫酸钾0.14 g,有机肥10.00 g)。
1.3 测定项目及方法
采集土壤样品自然风干,研磨后过1 mm筛,进行指标测定。其中,土壤有效磷含量、全磷含量参照鲍士旦[9]的方法进行测定,碱性磷酸酶活性、植物吸磷量参照李娜等[10]的方法进行测定,叶绿素含量的测定参照李合生等[11]的方法进行测定,油菜产量用电子秤直接称量。
Hedley无机磷形态的测定方法:称0.5 g过0.15 mm筛的细土于50 mL的离心管中,加蒸馏水30 mL,振荡16 h;将取下的离心管在离心机上以转速为10 000 r/min的速度离心10 min(温度要设置在0 ℃下),在离心管中,分别吸取5,10 mL的上清液,置于2个比色管,编号待测,倒掉离心管中的剩余溶液后加入0.5 mol/L重碳酸钠溶液30 mL,振荡16 h;将取下的离心管在离心机上离心10 min,转速为10 000 r/min(温度要设置在0 ℃下)。在离心管中,分别吸取5,10 mL的上清液,置于2个比色管,编号待测,倒掉离心管中的剩余溶液后加入0.1 mol/L氢氧化钠溶液30 mL,振荡16 h;将取下的离心管在离心机上离心10 min,转速为10 000 r/min(温度要设置在0 ℃下),在离心管中,分别吸取5,10 mL的上清液,置于2个比色管,编号待测,倒掉离心管中的剩余溶液后加入1 mol/L的盐酸溶液30 mL,振荡16 h;将取下的离心管在离心机上离心10 min,转速为10 000 r/min(温度要设置在0 ℃下),在离心管中,分别吸取5,10 mL的上清液,置于2个比色管,编号待测,倒掉离心管中的剩余溶液,将其内土壤转移至消煮管过夜;在消煮管中加入浓硫酸5 mL,120 °C消煮0.5 h后每20 min升温20 ℃,直到300 ℃,取下试管,冷却后摇匀,再次进行消煮,达到360 ℃取下试管,冷却后加入0.5 mol/L的双氧水继续消煮0.5 h,重复直到消煮管中的土样呈白色,液体清澈无色),结束消煮冷却后,定容于100 mL容量瓶,摇匀过夜;吸取容量瓶中的上清液于比色管中,加3~5滴水和1滴0.5%磷硝基酚指示剂,用4 mol/L的氢氧化钠和0.25 mol/L硫酸调节pH值,定容摇匀比色,测定残渣态-P;吸取提取液10 mL转移到50 mL比色管中,加入 0.9 mol/L硫酸3.6 mL,调节pH值,定容比色,分别测定H2O-Pi、NaHCO3-Pi、NaOH-Pi、HCl-Pi的含量。
1.4 数据分析
利用Excel、SPSS 18等软件对试验数据进行处理与统计分析。
2 结果与分析
2.1 不同解磷菌群处理对土壤有效磷含量、碱性磷酸酶活性及土壤全磷含量的影响
从表1可以看出,各处理土壤有效磷含量均高于CK,与不施解磷菌群处理相比,加入解磷菌群的土壤有效磷的含量均显著增加,其中,增加最显著的是解磷细菌群,增加了21.69%~50.42%;其次为解磷真菌群,增加了6.9%~16.19%;混合解磷菌群增加效果不明显。当菌液浓度为4 mL/盆时,解磷细菌群与解磷真菌群处理下土壤有效磷含量最大,与不施解磷菌群处理相比差异显著,且解磷细菌群与解磷真菌群之间差异显著。
各施肥处理下,土壤碱性磷酸酶的活性均显著高于CK,与不施解磷菌群处理相比,施入解磷细菌群土壤碱性磷酸酶活性增加了7.17%~25.45%,解磷真菌群增加了1.82%~20.00%,混合解磷菌群增加效果不明显。当菌液浓度为4 mL/盆时解磷细菌群、解磷真菌群与混合解磷菌群处理下,碱性磷酸酶的活性含量最大,与不施解磷菌群处理之间差异均达显著水平。各菌群处理在同一浓度下差异不显著。
施入解磷细菌群和解磷真菌群能够提高土壤全磷的含量,解磷细菌增加效果最好,与不施解磷菌群相比,解磷细菌处理提高了2.38%~9.52%;解磷真菌处理提高了2.38%。当菌液浓度为4 mL/盆时,解磷细菌群处理下土壤全磷的含量显著高于低浓度和高浓度处理;解磷真菌群在各浓度处理下差异不显著;混合菌群处理在1 mL/盆浓度下,土壤全磷的含量显著高于其他处理。
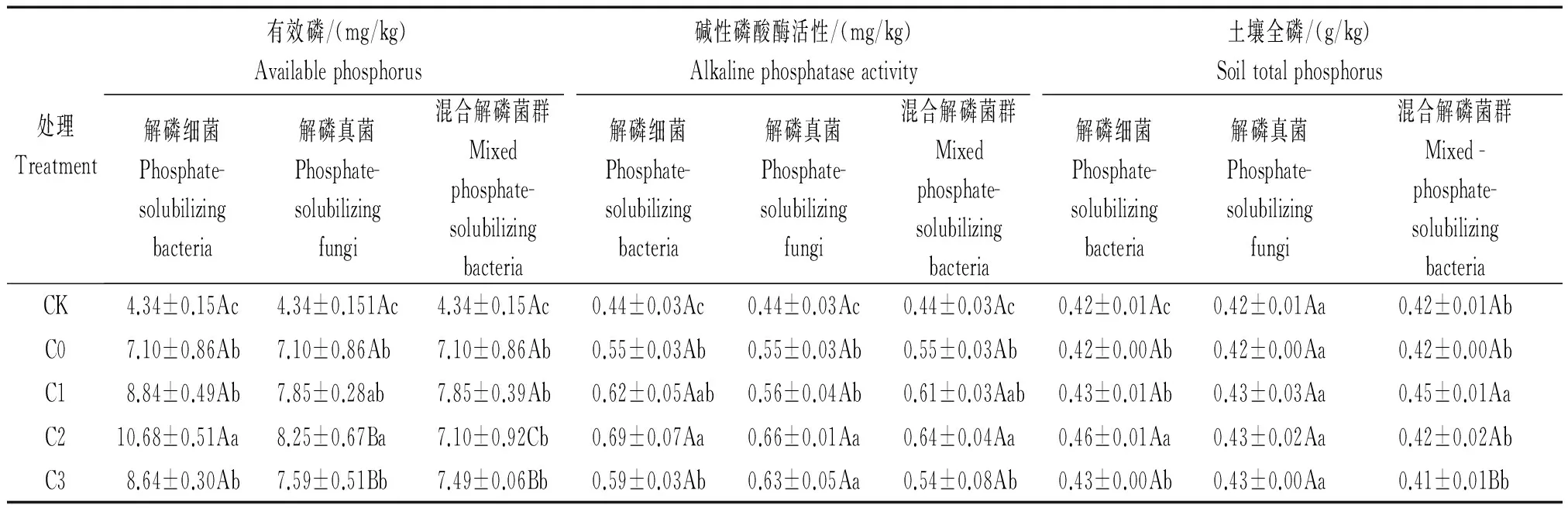
表1 不同解磷菌群处理对土壤有效磷含量、碱性磷酸酶活性以及土壤全磷含量的影响Tab.1 Effect of different phosphate-solubilizing bacteria on soil available phosphorus content,alkaline phosphatase activity and soil total phosphorus
注:表中不同小写字母表示同一解磷菌群不同施肥浓度间差异显著(P<0.05);不同大写字母表示不同解磷菌群处理间差异显著(P<0.05)。表2、图1-5同。
Note: The lowercase letters in the table indicate that the difference of different fertilization rates was significant difference(P<0.05); Different capital letters indicate different solubilizing bacteria treatments were significant difference(P<0.05). The same as Tab.2,Fig.1-5.
2.2 不同解磷菌群处理对油菜产量、吸磷量和叶绿素的影响
从表2可以看出,施入解磷菌群能够提高油菜的产量,作用效果最好的是解磷细菌群,比不施解磷菌群增加了4.13%~41.76%,在菌液浓度为4 mL/盆时,油菜产量达到最大,与不施解磷菌群处理间差异显著;当菌液浓度为4 mL/盆时,解磷细菌群处理下油菜的产量显著高于解磷真菌群处理,与混合解磷菌群处理差异不显著;在7 mL/盆浓度处理下,解磷细菌群处理显著高于解磷真菌群处理,与混合解磷菌群处理间差异不显著。
不同处理与CK相比,油菜吸磷量均有所增加,与不施解磷菌群处理相比,增加效果最好的是解磷细菌群,增加了11.76%~44.12%;其次是解磷真菌群,增加了2.94%~29.41%;混合解磷菌群增加了11.76%~20.59%。当菌液浓度为4 mL/盆时,各种菌群处理下油菜吸磷量达到最大,解磷细菌群处理在该浓度下显著高于1,7 mL/盆浓度处理。不同解磷菌群处理在同一菌液浓度下差异不显著。李娜等[10]研究结果也表明,施入解磷细菌肥能够提高油菜的吸磷量。
植物叶片中叶绿素含量与植物的产量密切相关,而磷元素的缺乏会影响植物叶绿素的合成,进而影响光合作用[12]。本研究中,不同菌群处理对油菜叶绿素含量的影响也不尽相同,其大小顺序为解磷细菌群>解磷真菌群>混合菌群>不施解磷菌群处理>CK,与不施解磷菌群处理相比,解磷细菌群增加了3.60%~17.90%。在菌液浓度为4 mL/盆处理下时,油菜叶绿素含量达到最大,与CK、1 mL/盆之间差异显著,与7 mL/盆之间差异不显著。各菌群处理在同一浓度下差异不显著。

表2 不同解磷菌群处理对油菜产量、吸磷量和叶绿素含量的影响Tab.2 Effect of different phosphate-solubilizing bacteria on rape yield, uptake of phosphorus and chlorophyll
2.3 不同解磷菌群处理对Hedley无机磷形态的影响
2.3.1 不同解磷菌群处理对土壤H2O-Pi的影响 从图1可以看出,施入解磷细菌群能够提高土壤H2O-Pi的含量,比不施解磷菌群处理提高1.35%~33.69%;且在4 mL/盆菌液浓度处理下达到最大,比CK增加9.85 mg/kg,比不施解磷菌群处理增加9.46 mg/kg,与其他处理差异显著;解磷真菌群处理在4 mL/盆菌液浓度下与其他处理差异不显著,混合菌群处理对提高土壤H2O-Pi的含量作用效果不明显。不同菌群处理在同一浓度下差异不显著。施入解磷菌群能够提高土壤H2O-Pi的含量,可能是由于解磷菌能够产生有机酸和磷酸酶,加速土壤难溶态磷的转化[13]。陈芬等[14]研究也表明,施用菌肥可以增加复垦3年土壤的H2O-Pi含量。
2.3.2 不同解磷菌群处理对土壤NaHCO3-Pi含量的影响 从图2可以看出,施入解磷菌群能够提高土壤NaHCO3-Pi的含量,与不施解磷菌群处理相比,解磷细菌群增加了12.37%~52.43%,解磷真菌增加了8.6%~18.91%,混合解磷菌群增加了10.67%~17.42%。各菌群处理土壤NaHCO3-Pi含量均在菌液浓度为4 mL/盆时达到最大,解磷细菌群处理在该浓度下土壤NaHCO3-Pi含量较不施解磷菌群提高了15.79 mg/kg,与其他浓度处理间差异显著,且与解磷真菌群、混合解磷菌群处理间差异显著。土壤NaHCO3-Pi的含量多少依次为解磷细菌群>解磷真菌群>混合菌群>不施解磷菌群处理>CK。吴文丽等[15]研究也表明,施用解磷菌肥能够提高复垦土壤中NaHCO3-Pi的含量。
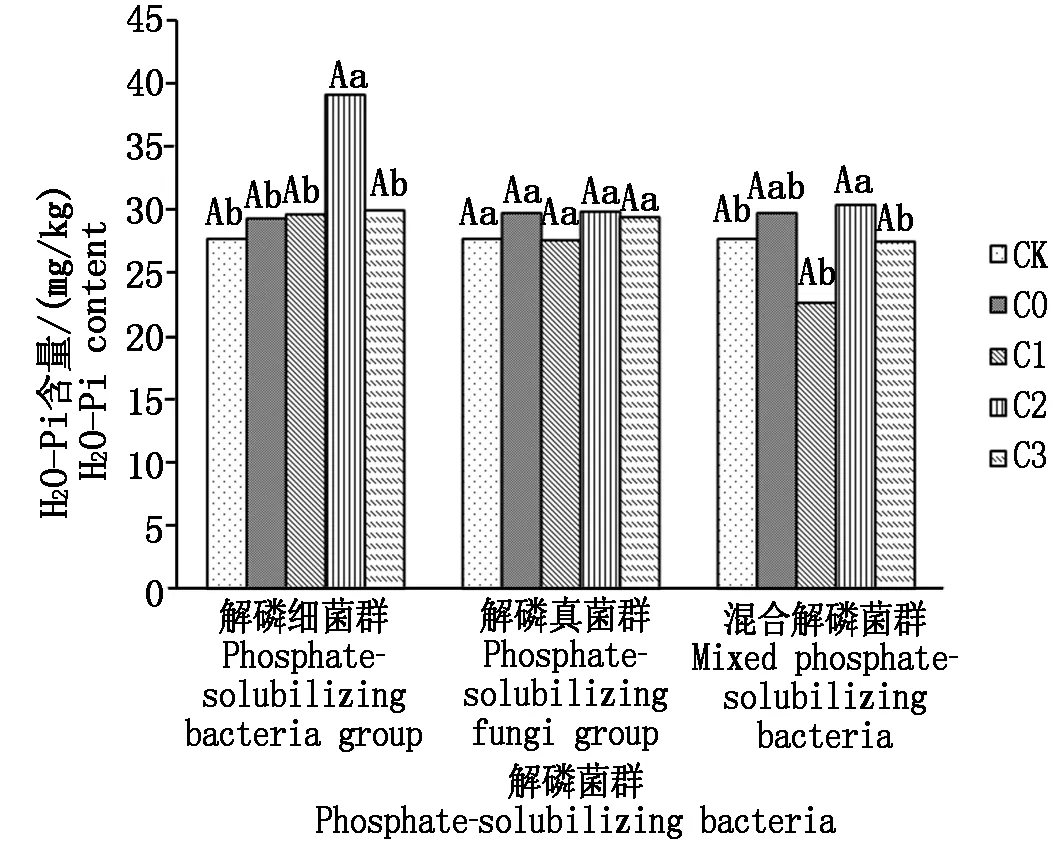
图1 不同解磷菌群处理对土壤H2O-Pi含量的影响Fig.1 Effect of different phosphate-solubilizing bacteria on content of soil H2O-Pi
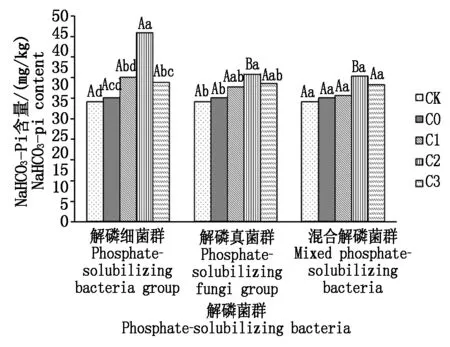
图2 不同解磷菌群处理对NaHCO3-Pi含量的影响Fig.2 Effect of different phosphate-solubilizing bacteria on content of soil NaHCO3-Pi
2.3.3 不同解磷菌群处理对土壤NaOH-Pi的影响 从图3可以看出,土壤NaOH-Pi的含量大小顺序依次为解磷细菌群>解磷真菌群>不施解磷菌群处理>混合菌群>CK,解磷细菌群与解磷真菌群处理土壤NaOH-Pi的含量均在4 mL/盆浓度时达到最大,解磷细菌群处理土壤NaOH-Pi在该浓度下较不施解磷菌群处理提高7.83 mg/kg,且二者间差异显著;解磷真菌群处理与不施解磷菌群处理间差异不显著。解磷细菌群处理与解磷真菌群处理在各菌液浓度处理下均与混合解磷菌群处理间差异显著,解磷细菌群处理与解磷真菌群处理间差异不显著。
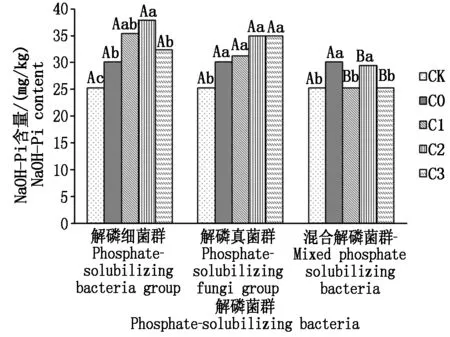
图3 不同解磷菌群处理对土壤NaOH-Pi含量的影响Fig.3 Effect of different phosphate-solubilizing bacteria on content of soil NaOH-Pi
2.3.4 不同解磷菌群处理对土壤HCl-Pi含量的影响 从图4可以看出,不同施肥处理下土壤HCl-Pi含量均低于CK,其大小依次为CK>解磷真菌群>不施解磷菌群处理>解磷细菌群。在菌液浓度为4 mL/盆时,解磷细菌群处理下土壤HCl-Pi含量最低,比CK降低了35.37 mg/kg,比不施解磷菌群处理降低了23.26 mg/kg,各菌群处理在同一浓度下差异不显著。
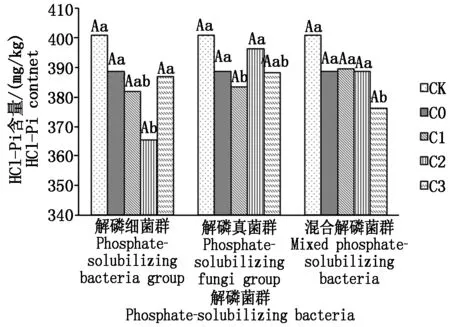
图4 不同解磷菌群处理对土壤HCl-Pi含量的影响Fig.4 Effect of different phosphate-solubilizing bacteria on content of soil HCl-Pi
2.4 不同解磷菌群处理对土壤残渣态-P的影响
从图5可以看出,施入解磷菌群降低了土壤残渣态磷的含量,其中,解磷细菌群残渣态-P的含量最低,较不施解磷菌群处理降低了4.57%~16.19%,在菌液浓度为4 mL/盆时土壤残渣态-P含量最低,较不施解磷菌群处理降低了47.02 mg/kg,且与其他浓度处理间差异显著;在4 mL/盆浓度下,解磷细菌群处理土壤残渣态-P含量显著低于混合解磷菌群与解磷真菌群处理。各菌群处理在其他浓度下差异不显著。

图5 不同解磷菌群处理对土壤残渣态-P含量的影响Fig.5 Effect of different phosphate-solubilizing bacteria on content of soil residual-P
3 结论与讨论
相关研究表明,解磷微生物能够将难溶态磷转化为能够被植物吸收利用的可溶性磷,其原因是解磷微生物产生的有机酸能够溶解难溶态的无机磷酸盐,一些解磷细菌在土壤缺磷条件下可分泌植酸、核酸以及磷脂酶类物质,通过酶解作用使有机磷转化成可供植物吸收利用的有效磷[16-18]。郜春花等[19]研究表明,施入解磷菌,土壤磷酸酶含量与不接种相比增加了19.9%~50.3%,与空白处理相比,组合溶磷细菌肥处理土壤中磷酸酶含量增加了34.7%~41.9%,且差异显著。白文娟等[20]研究表明,解磷细菌能够提高苗期玉米叶绿素含量以及植株和根系中全磷的含量。李玉娥等[21]在苜蓿上接种解磷菌后,植株的株高、茎粗、干质量、干鲜比和叶茎比都比对照明显增加。
本研究结果表明,施入解磷菌群能够提高土壤有效磷含量、碱性磷酸酶活性以及土壤全磷的含量,改善土壤的营养环境,促进作物的吸收利用,从而提高作物的产量、吸磷量和叶绿素含量。其中,作用效果最好的是解磷细菌群,与不施解磷菌群处理相比,土壤有效磷、碱性磷酸酶活性、油菜的产量、吸磷量和叶绿素含量增加了21.69%~50.42%,7.17%~25.45%,4.13%~41.76%,11.76%~44.12%,3.6%~17.90%,且在菌液浓度为4 mL/盆处理下作用效果最显著。
NaHCO3-Pi、NaOH-Pi是吸附在土壤粒子表面的活性磷和无机磷,易于被植物吸收和利用[14,22],而HCl-Pi、土壤残渣态-P是难溶态磷,不易被作物吸收利用[23]。唐勇等[24]研究表明,微生物腐解植物残体而产生的胡敏酸和富里酸能够与复合磷酸盐中的Ca2+、Fe3+和Al3+产生酸螯合,释放出磷酸盐。吴文丽等[15]研究发现,施用含有解磷菌的肥料,能够提高复垦土壤H2O-Pi、NaHCO3-Pi、NaOH-Pi的含量,从而提高土壤磷的有效性。
本研究在油菜土壤中施入解磷菌群,与CK相比,施入解磷菌群能够提高土壤中易被作物吸收和利用的H2O-Pi、NaHCO3-Pi、NaOH-Pi含量,降低土壤中HCl-Pi、残渣态-P的含量。其中,作用效果最好的是中浓度4 mL/盆处理下的解磷细菌群,与不施解磷菌群处理相比,土壤中H2O-Pi、NaHCO3-Pi、NaOH-Pi含量分别提高了9.85,15.79,7.83 mg/kg;土壤中HCl-Pi、残渣态-P的含量分别降低了23.26,47.02 mg/kg。施入解磷菌群能够改善土壤的磷素营养状况,提高磷素利用率。
[1] 钱奎梅,王丽萍,李 江.矿区复垦土壤的微生物活性变化[J].生态与农村环境学报, 2011,27(6):59-63.
[2] 杜慧平,刘利军,闫双堆.微生物对矿山复垦地土壤基质的改良作用[J].山西农业科学, 2011,39(1):43-46.
[3] 任海红,刘学义,李贵全.大豆耐低磷胁迫研究进展[J].分子植物育种, 2008,6(2):316-322.
[4] 陈 谦,张维新,赵 海,等.生物有机肥中几种功能微生物的研究及应用概况[J].应用与环境生物学报, 2010,16(2):294-303.
[5] 乔志伟,洪坚平,谢英荷,等.一株石灰性土壤强溶磷真菌的分离鉴定及溶磷特性[J].应用与环境生物学报, 2013,19(5):873-877.
[6] 蒋欣梅,夏秀华,于锡宏,等.微生物解磷茵肥对大棚茄子生长及土壤有效磷利用的影响[J].浙江大学学报:理学版, 2012,39(6):685-688.
[7] 郝 晶,洪坚平,刘 冰,等.不同解磷菌群对豌豆生长和产量影响的研究[J].作物杂志,2006,22(1):73-76.
[8] 梁利宝.解磷细菌对石灰性土壤磷形态的影响[J].山西农业大学学报:自然科学版,2008,28(4):454-457.
[9] 鲍士旦.土壤农化分析[M]. 3版.北京:中国农业出版社, 2000.
[10] 李 娜,乔志伟,洪坚平,等.溶磷混合菌肥对石灰性褐土磷素养分及解析特性的影响[J].应用与环境生物学报, 2014,20(4): 662-668.
[11] 李合生,孙 群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:167-169.
[12] 曹翠玲,毛圆辉,曹朋涛,等.低磷胁迫对豇豆幼苗叶片光合特性及根系生理特性的影响[J].植物营养与肥料学报,2010,16(6): 1373-1378.
[13] 胡晓峰,何元胜,岳 宁.不同溶磷菌生物有机肥对玉米苗期生长和土壤磷养分的影响[J].湖南农业科学,2012,42(11):74-77.
[14] 陈 芬,洪坚平,郝鲜俊,等.不同培肥处理对采煤塌陷地复垦土壤Hedley P形态的影响[J].山西农业科学,2012,40(3):243-245.
[15] 吴文丽,洪坚平,孟会生,等.连续施用解磷菌肥对复垦土壤磷酸酶和Hedley磷形态的影响[J].中国土壤与肥料,2016(4):59-64.
[16] 郝 晶,洪坚平,刘 冰,等.石灰性土壤中高效解磷细菌菌株的分离、筛选及组合[J].应用与环境生物学报,2006,12(3):404-408.
[17] Singh M, Bhui K, Singh R, et al. Tea polyphenols enhance cisplatin chemosensitivity in cervical cancer cells via induction of apoptosis[J]. Life Sciences,2013,93(1): 7-16.
[18] Rashid M, Khalil S, Ayub N. Organic acids production and phosphate solubilization by phosphate solubilizing microorganisms(PSM)underinvitroconditions[J]. Pakistan Journal of Biological Sciences,2004,7(2):187-196.
[19] 郜春花,卢朝东,张 强.解磷菌剂对作物生长和土壤磷素的影响[J].水土保持学报, 2006, 20(4): 54-56, 109.
[20] 白文娟,胡蓉蓉,章家恩,等.溶磷菌对玉米苗期生长和磷素吸收的影响[J].生态科学, 2014,33(3): 401-407.
[21] 李玉娥,姚 拓,荣良燕.溶磷菌溶磷和分泌IAA特性及对苜蓿生长的影响[J].草地学报, 2010, 18(1): 84-88.
[22] 贺丽娜,梁银丽,熊亚梅,等.不同前茬对设施黄瓜产量和品质及土壤酶活性的影响[J].中国生态农业学报, 2009, 17(1): 24-28.
[23] 钟传青,黄为一.不同种类解磷微生物的溶磷效果及其磷酸酶活性的变化[J].土壤学报, 2005, 42(2): 286-294.
[24] 唐 勇,陆 玲,杨启银,等.解磷微生物及其应用的研究进展[J].天津农业科学, 2001, 7(2): 1-5.

