PPOS方案对不同年龄段卵巢储备功能减退患者IVF—ET结局的探讨
李霞+彭璇+段娟

[摘要] 目的 分析高孕酮状态下促排卵(PPOS)方案在不同年龄段的卵巢储备功能减退(DOR)患者体外受精-胚胎移植(IVF-ET)的治疗效果。 方法 回顾性分析2016年1月~2017年6月在我院行IVF-ET助孕采用PPOS方案的DOR患者共110个周期,按照患者不同年龄分为三组:A组(≤35岁, n=29)、B组(35<年龄<40岁, n=31)、C组(≥40岁,n=50), 将不同年龄组患者基础性激素、窦卵泡计数、获卵数、可移植胚胎数、周期取消率及胚胎解冻移植(FET)周期临床妊娠率进行比较分析。 结果 三组患者基础FSH(bFSH)、基础 LH(bLH)、基础 E2(bE2)、基础窦卵泡数(AFC)均无统计学差异(P>0.05);促排卵后获卵数、可移植胚胎数、周期取消率差异均无统计学意义(P>0.05),FET周期临床妊娠率分别为A组47.4%,B组25.0%,C组17.2%。A组明显高于B、C两组,B组高于C组,但差异无统计学意义(P>0.05),A组与C组比较差异有统计学意义(P<0.05)。结论 PPOS方案应用于卵巢储备功能减退患者的周期临床妊娠率随年龄的增加而下降,年轻的 DOR 不孕患者仍有较高的临床妊娠率。
[关鍵词] 卵泡期;孕激素;年龄;卵巢储备功能减退;体外受精-胚胎移植
[中图分类号] R711 [文献标识码] A [文章编号] 1673-9701(2017)33-0009-04
[Abstract] Objective To analyze the therapeutic effect of PPOS regimen under the high progesterone condition on the IVF-ET in the ovarian reserve dysfunction(DOR)patients in different age groups. Methods A total of 110 cycles of DOR patients using IVF-EF to help pregnancy by PPOS program from January 2016 to June 2017 were retrospectively analyzed. The patients were divided into three groups according to their different ages, including group A(≤35 years old, n=29), group B(35 years old
[Key words] Follicular phase;Progesterone;Age;Ovarian reserve dysfunction;In vitro fertilization and embryo transfer
随着社会发展,竞争越来越激烈,职场女性面临的压力也越来越大,卵巢储备功能减退的患者人数不断攀升;此外,女性生育年龄的后延及国家二孩政策的开放,高龄人群均加入了当今社会的生育大军,她们多半为卵巢储备功能减退(decreasing ovarian reserve,DOR)的患者,而又有着强烈的生育意愿。随之而来的是各大生殖中心面临着巨大的挑战,临床医生及实验室胚胎专家尽全力地为她们获得优质卵子及胚胎,努力提高临床妊娠率,改善临床结局。本研究旨在探讨高孕激素状态下促排卵(progestin primed ovarian stimulation,PPOS)方案在不同年龄段DOR患者IVF-ET(in vitro fertilization and embryo transfer,试管婴儿)中的治疗效果。
1 对象与方法
1.1研究对象
本研究回顾性分析2016年1月~2017年6月在我院接受试管嬰儿助孕治疗的不孕患者且符合卵巢低反应(poor ovarian response,POR)诊断的患者,共纳入110个周期,根据不同年龄段分为三组:A组(≤35岁,n=29),B组(35岁<年龄<40岁,n=31),C组(≥40岁,n=50)。三组患者的一般资料比较无统计学差异(P>0.05),具有可比性。
POR的诊断标准参照2011年欧洲人类胚胎与生殖学会(European Society of Human Reproduction and Embryology,ESHRE)的诊断共识:(1)年龄≥40岁或基础卵泡刺激素(basal follicle-stimulating hormone,bFSH)≥10 mIU/mL或存在其他POR的危险因素;(2)既往IVF周期卵巢低反应,常规方案获卵数≤3个;(3)卵巢储备下降[AFC<5~7个或AMH<(0.5~1.1)ng/mL]。以上条件满足其中2个即可诊断POR。所有患者均自愿要求接受IVF治疗并符合《人类辅助生殖技术规范》的适应证并排除禁忌证。排除标准:自然周期取卵,近期服用避孕药等激素类药物等。
1.2 方法
PPOS方案:采用卵泡期联合应用安宫黄体酮和促卵泡刺激素促排卵,于月经周期第2~3天,阴超监测双侧卵巢排除功能性囊肿且无>8 mm的窦卵泡,基础雌二醇(basal estradiol,bE2)<80 pg/mL。FSH≤10 IU/mL的患者,予尿促性素(150~225)IU/d(HMG,丽珠制药)肌注,同时口服安宫黄体酮10 mg/d(2 mg/片,浙江仙居制药);FSH>10 IU/mL的患者,先口服安宫黄体酮10 mg/d,至FSH降至10 IU/mL以下,即予尿促性素(150~225)IU/d促卵泡发育。当主导卵泡≥18 mm予醋酸曲普瑞林(达必佳,辉凌,德国)0.1 mg及注射用绒促性素针(human chorionic gonadotropin,HCG,2000 IU/支,丽珠制药)2000 IU,34~35 h后经阴道超声引导下取卵。根据男方精液参数进行常规授精或单精子卵胞质内显微注射,常规胚胎培养。
1.3 胚胎移植策略
所有周期均行全胚冷冻,择期行胚胎解冻移植(frozen embryo transfer,FET)。采用激素替代方案:于月经第2~3天检测性激素及卵泡均处于早卵泡期,口服戊酸雌二醇(4~8)mg/d(1 mg/片,补佳乐,拜尔医药,德国),当子宫内膜≥8 mm,予黄体酮针剂(20 mg/支,浙江仙居制药)80 mg/d转化内膜,移植后改为黄体酮60 mg/d或黄体酮阴道缓释凝胶(雪诺酮,默克雪兰诺,德国)黄体支持。FET后14 d常规验血HCG确定生化妊娠,移植后28~30 d B超提示妊娠囊及卵黄囊确定为临床妊娠。
1.4 观察指标
比较三组的bFSH、基础黄体生成素(basal luteinizing hormone,bLH)、bE2、窦卵泡计数(antral follicle count,AFC)、获卵数、可移植胚胎数及周期取消率、FET周期临床妊娠率。周期取消率=(未获卵周期数+无可移植胚胎周期数)/促排卵周期数×100%;胚胎解冻移植(frozen-thawed embryo transfer,FET)周期临床妊娠率=临床妊娠周期数/移植周期数×100%。
1.5 统计学方法
所有数据采用SPSS17.0软件进行统计分析,符合正态分布的计量资料以均数±标准差(x±s)表示,偏态分布的计量资料采用中位数(四分位数)即M(Q25,Q75)表示,正态分布的计量资料采用单因素方差分析;非正态分布的计量资料采用Kruskal-Wallis H非参数检验;计数资料以率(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 三组患者的基本情况比较
三组患者bFSH、bLH、bE2、AFC组间比较差异无统计学意义(P>0.05),具有可比性。见表1。
2.2 三组患者的实验室及临床指标比较
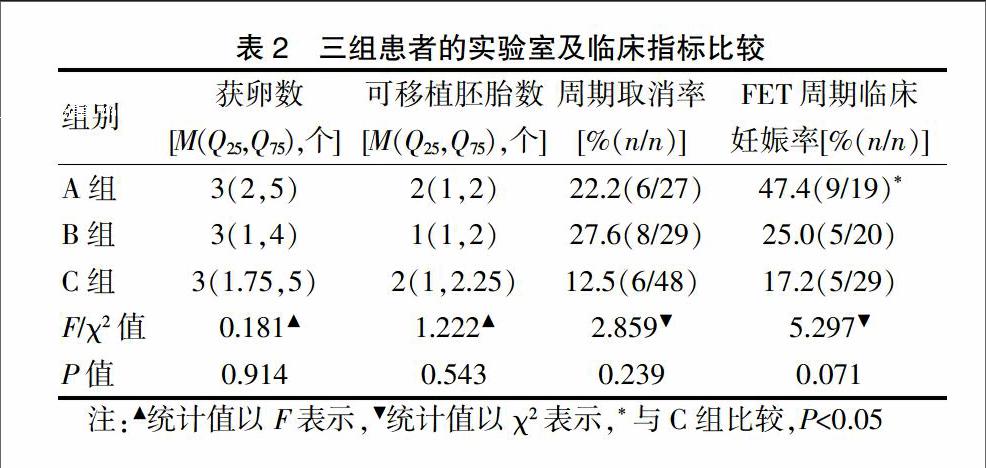
三组患者的获卵数、可移植胚胎数、周期取消率均无统计学差异(P>0.05)。截至2017年8月,FET共68个周期,周期临床妊娠率分别为A组47.4%,B组25.0%,C组17.2%。A组明显高于B、C两组,B组高于C组,但差异无统计学意义(P>0.05),A组与C组比较差异有统计学意义(P<0.05)。见表2。
3 讨论
近年来,卵巢储备功能下降的人群的生育问题是当今辅助生殖技术领域的一大挑战。女性的卵子由于受外界环境、自身疾病、遗传因素和不良生活习惯等因素的影响,如病毒感染、放射线、噪音、微波辐射、环境污染及吸烟、酗酒等,易出现损伤。此外,随着年龄的增长,卵子数量减少以及质量下降、卵子老化以及受精障碍,从而严重影响其自然受孕率。美国妇产科协会2015年专家共识推荐:年龄>35岁超过6个月试孕失败的,应进行快速的不孕检查并接受助孕治疗;>40岁因为生育力已经接近于衰竭阶段,推荐直接IVF-ET助孕治疗。因此,部分人群需通过辅助生育方式助孕。
DOR患者方案的选择非常关键,传统的垂体降调节方案虽然经典、临床妊娠率稳定,但是有着治疗周期长、费用高等缺点,更适宜卵巢储备功能正常的人群。而对于DOR患者来说,降调方案易出现因垂体降调节过深导致的医源性卵巢低反应。DOR促排卵方案常常采用温和刺激、微刺激或者自然周期。近年来,微刺激方案以其周期治疗时间短、费用低廉、并发症少等优点,倍受生殖科医生的关注。其中PPOS方案为此类人群促排提供了新思路,安宫黄体酮是人工合成的孕激素,口服经体内代谢吸收后并不会影响体内孕酮水平的检测,可以有效抑制内源性LH峰。随着玻璃化冷冻技术日益成熟,为PPOS的广泛应用提供了保障。endprint
PPOS方案的基础是卵泡发育波,有研究[1]对50名女性定期超声卵泡监测发现一个月经周期卵泡生长存在2~3个卵泡发育波,大部分女性一个周期仅一个成熟卵泡发育,因为发生在卵泡发育波的早中期会出现排卵,而黄体期则不出现排卵现象。卵泡发育节奏是相对独立的,而不是连续的过程。早期动物实验表明雌激素诱导的LH峰在垂体水平,而孕酮抑制LH峰的作用部位位于下丘脑[2]。基于以上基础,才有了黄体期促排的诞生。黄体期促排是利用内源性孕酮抑制LH峰的出现,虽然卵泡暴露在高孕酮状态下生长,依然可以获得高质量的卵母细胞[3,4]。在同一月经周期进行两次促排卵以期获得更好的胚胎改善妊娠结局,该研究显示69.8%的患者至少获得一个整倍体囊胚[5]。由于雌激素的双重反馈作用,PPOS方案则是早卵泡期雌激素尚未上升之前补充外源性孕酮来抑制LH峰。
PPOS方案的应用彻底改变了传统的垂体降调节抑制早发内源性LH峰的理念,该方案主要用于高龄、DOR患者可以增加获卵数、降低周期取消率、减轻患者的经济负担[6];可利用胚胎率高于常规方案或微刺激组[7-9]。该方案应用于不同年龄段的DOR相关研究尚少。本研究回顾性分析了该方案应用于DOR患者的不同年龄段的获卵数、可移植胚胎数、周期取消率等均无显著差异(P>0.05),而FET周期临床妊娠率随着年龄的增加而下降,但差异无统计学意义(P>0.05),本文考虑与样本量较小有关。三组患者中,35岁以下患者,即使卵巢储备功能下降,依然有较高的临床妊娠率(47.4%),高于其他两组(B组25.0%;C组17.2%),与C组比较有统计学差异(P<0.05)。虽然同为DOR,临床妊娠率却有着较大差距,预示着年龄是生育力的决定性因素,尤其40岁以上的患者,卵泡数量及卵子质量都明显下降,卵子非整倍体率升高,胚胎质量下降,从而影响助孕结局。与高龄患者相比,年轻人群DOR患者卵子非整倍体率相对较低可能是主要原因之一。尽管如此,辅助生育技术能够一定程度上帮助DOR患者成功妊娠。同时我们也呼吁不孕不育患者尽早进行生育力评估,属于DOR人群尽快接受生殖专科医生指导。
不仅如此,此方案还应用与卵巢储备功能正常及多囊卵巢综合征的患者。有研究[10]将卵巢正常反应人群降调节长方案助孕治疗失败的患者和PPOS方案进行自身对照发现,PPOS方案正常受精率、优胚数、周期临床妊娠率均显著高于长方案。在卵巢儲备功能正常的患者,每天口服4 mg安宫黄体酮足以抑制内源性LH峰[11]。叶红娟等[12]应用于高反应人群可以明显降低卵巢过度刺激(ovarian hyperstimulation syndrome,OHSS)的发生。PPOS方案的弊端是新鲜周期不能移植,需全胚胎冷冻[13],但也有学者认为全胚冷冻有其在子宫内膜容受性方面的优势,不受超促排卵对子宫内膜容受性的影响的优势[14]。玻璃化冷冻技术的发展是该方案迅速发展的重要保障,胚胎冷冻复苏率达90%以上,且妊娠率与新鲜周期相似甚至更高[15,16]。
综上所述,PPOS方案为DOR患者提供了简单、经济、有效的促排卵方案,对于卵巢储备功能下降人群,年龄是影响临床妊娠率的重要因素。本研究样本量有限,且部分患者尚未移植。在后续工作中,我们将扩大样本量进一步验证该方案的有效性及各年龄段治疗结局的差异。
[参考文献]
[1] Baerwald AR,Adams GP,Pierson RA.A new model for ovarian follicular development during the human menstrual cycle[J]. Fertil Steril,2003,80(1):116-122.
[2] Wildt L,Hutchison JS,Marshall G,et al.On the site of action of progesterone in the blockade of the estradiol-induced gonadotropin discharge in the rhesus monkey[J]. Endocrinology,1981,109(4):1293-1294.
[3] Kuang Y,Hong Q,Chen Q,et al.Luteal-phase ovarian stimulation is feasible for producing competent oocytes in women undergoing in vitro fertilization/intracytoplasmic sperm injection treatment with optimal pregnancy outcome in frozen-thawed embryo transfer cycles[J].Fertil Steril,2014,101(1):105-111.
[4] Li Y,Yang W,Chen X,et al.Comparison between follicular stimulation and luteal stimulation protocols with clomiphene and HMG in women with poor ovarian response[J].Gynecol Endocrinol,2016,32(1):74-77.
[5] Ubaldi FM,Capalbo A,Vaiarelli A,et al.Follicular versus luteal phase ovarian stimulation during the same menstrual cycle (DuoStim) in a reduced ovarian reserve population results in a similar euploid blastocyst formation rate:New insight in ovarian reserve exploitation[J].Fertil Steril,2016,105(6):1488-1495.endprint
[6] 张锦,姜宏,倪丰,等.安宫黄体酮降调节在40岁以上高龄妇女体外受精中的应用价值[J].现代妇产科进展,2016,25(6):406-410.
[7] 张楚,朱彤,严为巧,等.卵泡期高孕酮状态下促排卵对改善卵巢储备功能低下患者IVF结局的临床研究[J].中国优生与遗传杂志,2016,24(10):111-114.
[8] Kuang Y,Chen Q,Fu Y,et al.Medroxyprogesterone acetate is an effective oral alternative for preventing premature luteinizing hormone surges in women undergoing controlled ovarian hyperstimulation for in vitro fertilization[J].Fertil Steril,2015,104(1):62-70.
[9] 张少娣,陈圆辉,王雪,等.高孕酮状态下促排卵方案(PPOS)与非典型微刺激方案在卵巢低反应患者体外受精-胚胎移植(IVF-ET)中的效果[J].生殖与避孕,2016,36(12):981-985.
[10] 郭丽娜,贾新转,吕翠婷,等.高孕激素状态下促排卵方案用于卵巢正常反应患者IVF-ET的自身对照研究[J].生殖医学杂志,2017,26(2):127-132.
[11] Dong J,Wang Y,Chai WR,et al.The pregnancy outcome of progestin-primed ovarian stimulation using 4 versus 10 mg of medroxyprogesterone acetate per day in infertile women undergoing in vitro fertilisation:A randomised controlled trial[J].BJOG,2017,124(7):1048-1055.
[12] 葉红娟,陈秋菊,匡延平.多囊卵巢综合征在高孕酮超促排中LH与IVF/ICSI临床结局的相关性分析[J].生殖与避孕,2016,36(3):177-184.
[13] Blockeel C,Drakopoulos P,Santos-Ribeiro S,et al.A fresh look at the freeze-all protocol: A SWOT analysis[J].Hum Reprod,2016,31(3):491-497.
[14] Almeida Ferreira Braga DP,Setti AS,Savia Figueira RC,et al.Freeze all oocyte vitrification OR fresh embryo transfer?Lesson from an egg-sharing donation program[J].Fertil Steril,2016,106(3):615-622.
[15] Cobo A,Kuwayama M,Perez S,et al.Comparison of concomitant outcome achieved with fresh and cryopreserved donor oocytes vitrified by the cryotop method[J].Fertil Steril,2008,89(6):1657-1664.
[16] Roque M,Valle M,Guimaraes F,et al.Freeze-all policy:Fresh vs frozen-thawed embryo transfer[J].Fertil Steril,2015,103(5):1190-1193.
(收稿日期:2017-09-19)endprint

