母孕期使用抗生素对后代患哮喘风险的Meta分析
苏艳艳 耿 刚 付文龙 龚财惠 汪东海 代继宏
支气管哮喘是儿童时期最常见的气道慢性炎症性疾病[1],以气道反应性增加、可逆性的气流受限伴不同程度的气道重塑[2,3]为主要特征。近30年哮喘诊断与防治指南历经多次修订,但其发病率仍呈逐年上升趋势[4,5],因此预防尤其一级预防至关重要。有研究证实哮喘和高血压等多种慢性疾病与母孕期不良的宫内外环境密切相关[6,7],其中备受关注的是抗生素。抗生素可通过改变肠道微生物的组成导致免疫反应失调,增加过敏性疾病如哮喘的发病风险[8,9]。Metsala等研究[10]结果显示,母孕期抗生素使用增加后代哮喘的发生率,但也有研究结果持怀疑态度[11,12],其中最受争议的问题是逆向因果[4,13]和残余因素[14]。逆向因果是指不能区分是抗生素导致哮喘还是潜在哮喘导致抗生素的使用;残余因素主要是指去除母亲及儿童自身因素后的家庭环境、基因遗传和就诊行为等。2015年Zhao等[15]的Meta分析探讨了母孕期抗生素使用与后代哮喘的关联,结果显示母孕期使用抗生素增加了后代哮喘的发生率。该Meta分析共纳入3篇病例对照研究和7篇队列研究,仅以年龄3岁为界行亚组分析,没有考虑残余因素,且纳入的病例对照研究,不适宜分析暴露因素对结局的影响。本文Meta分析旨在进一步系统评价孕期抗生素使用与儿童哮喘的关联。
1 方法
1.1 文献纳入标准 ① 队列研究;②研究对象:为孕妇和儿童;③暴露因素:孕期使用抗生素;④文献报道了本文结局指标儿童哮喘;⑤效应值为OR、RR、HR及其95%可信区间,队列最短终点为2年;⑥语种限定为中文和英文。
1.2 孕期抗生素暴露 ①抗生素包括抗细菌、真菌、支原体、衣原体等微生物药物,不包括抗病毒药物;②孕期:末次月经后至分娩;孕早期:末次月经后至91 d;孕中期:~189 d;孕晚期:~分娩。
1.3 结局指标 儿童哮喘发生率及其暴露关联因素(OR、RR或HR)。
1.4 文献检索策略 计算机检索,均从建库到2017年8月1日。中文数据库[中国知网数据库(知网)、万方数据库(万方)和维普科技期刊数据库(维普)]和英文数据库(PubMed、EMBASE、Cochrane和Ovid)检索式见表1。
1.5 文献筛选、资料提取和偏倚风险评估 由苏艳艳、耿刚独立进行,有争议者与付文龙讨论决定。
1.5.1 文献筛选 首先用Endnote软件去除重复文献,再阅读文献题目和摘要,排除非中英文、没有评估抗生素的使用与哮喘关系的文献。初筛后的文献获取全文,全文阅读后排除病例对照、会议论文、结局指标不符要求等文献。重复发表的文献,取观察时间最长的文献。

表1 中英文数据库检索式
1.5.2 资料提取 用登记表提取基本资料,包括纳入文献的作者、出版年份、研究类型、随访年龄、病例数和队列总例数、结局指标和暴露的判断标准、效应指标及母亲哮喘、孕期烟草暴露、生产方式、残余因素、胎次等混杂因素。
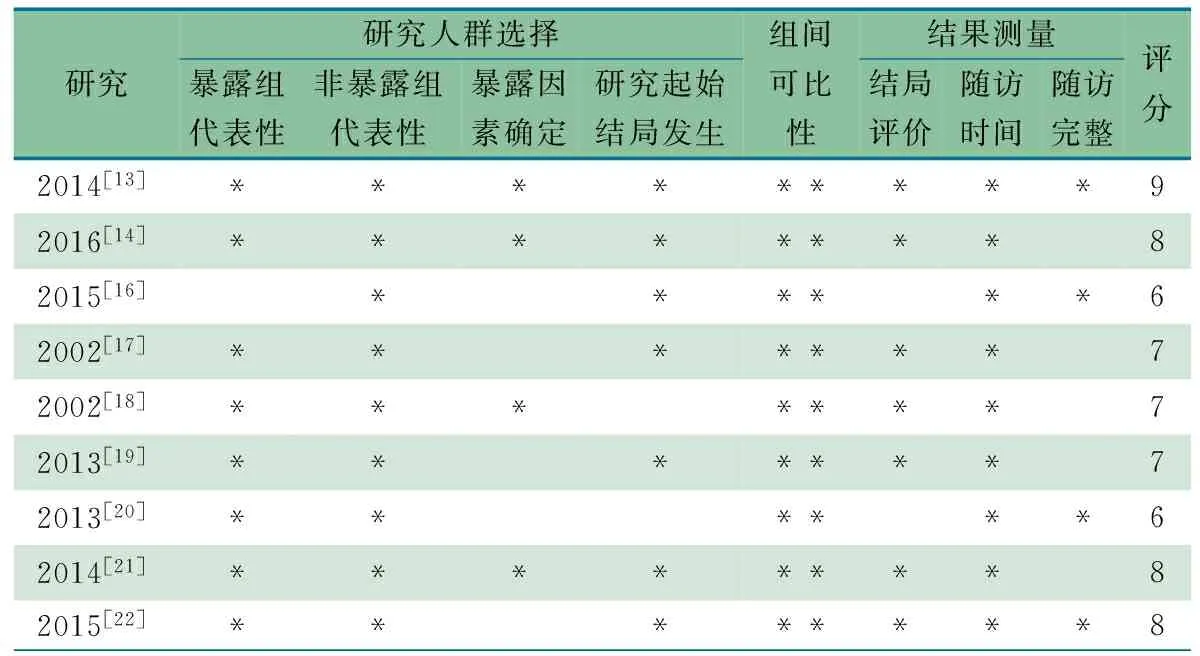
1.5.3 偏倚风险评价 根据Cochrane 系统评价员手册推荐的队列研究的偏倚风险评价工具纽卡斯尔-渥太华量表(NOS)对纳入的文献行偏倚风险评价,共 9 颗星,>5颗星为质量高的研究。
1.6 统计学方法 采用Stata 12.0软件进行Meta分析,效应量以OR及其95%CI表示。采用χ2检验行统计学异质性分析,P≤0.1为研究间存在显著异质性;采用I2对异质性进行定量,I2≤50%为中低度异质性,采用固定效应模型描述;I2>50%为高度异质性,采用随机效应模型描述。根据临床异质性,进行亚组分析。

2 结果
2.1 文献检索 共检索到1 059篇,最终9篇[13,14,16~22]队列研究符合本文纳入标准进入Meta分析。文献筛选流程见图1。

图1文献筛选流程图
2.2 纳入文献情况 表1显示,9项队列研究为2002至2016 年的文献,来自丹麦3篇、美国3篇、瑞典2篇、英国1篇,队列终点年龄2~14岁,队列总人数为6 671 792人,病例数为60 807例;均校正了主要混杂因素。暴露因素:自我报告2项,问卷调查1项,6项来自医疗信息系统数据库。文献[13,19,22]具体描述了抗生素,余文献均未说明抗生素或种类。哮喘结局均来自于医生的诊断,4篇文献说明了抗哮喘用药史。1篇文献[16]的暴露对象是至少有 1 位亲属有过敏性疾病的高风险人群;3篇文献[13,19,22]分为孕早、中和晚期;2篇文献[13,14]为同胞对照组; 1篇文献[20]随访年龄≥2岁,因跨度大无法分类,余文献随访时间按<3岁和≥3岁、<6岁和≥6岁分层分析。表3显示按照 NOS 评价方法,纳入9篇文献得分均在6颗星以上,各文献间偏倚风险较小。
2.3 母孕期使用抗生素与儿童哮喘的关系Meta分析 图2显示,9项队列研究的结果效应值进行合并,汇总结果显示各研究间异质性大(I2=96.5%),采用随机效应模型分析,合并 OR=1.14(95%CI:1.13~1.15),孕期使用抗生素增加儿童时期哮喘的风险。
表3 纳入的9篇队列研究采用NOS量表评价的方法学质量
研究研究人群选择暴露组代表性非暴露组代表性暴露因素确定研究起始结局发生组间可比性结果测量结局评价随访时间随访完整评分2014[13]*********92016[14]********82015[16]******62002[17]*******72002[18]*******72013[19]*******72013[20]******62014[21]********82015[22]********8
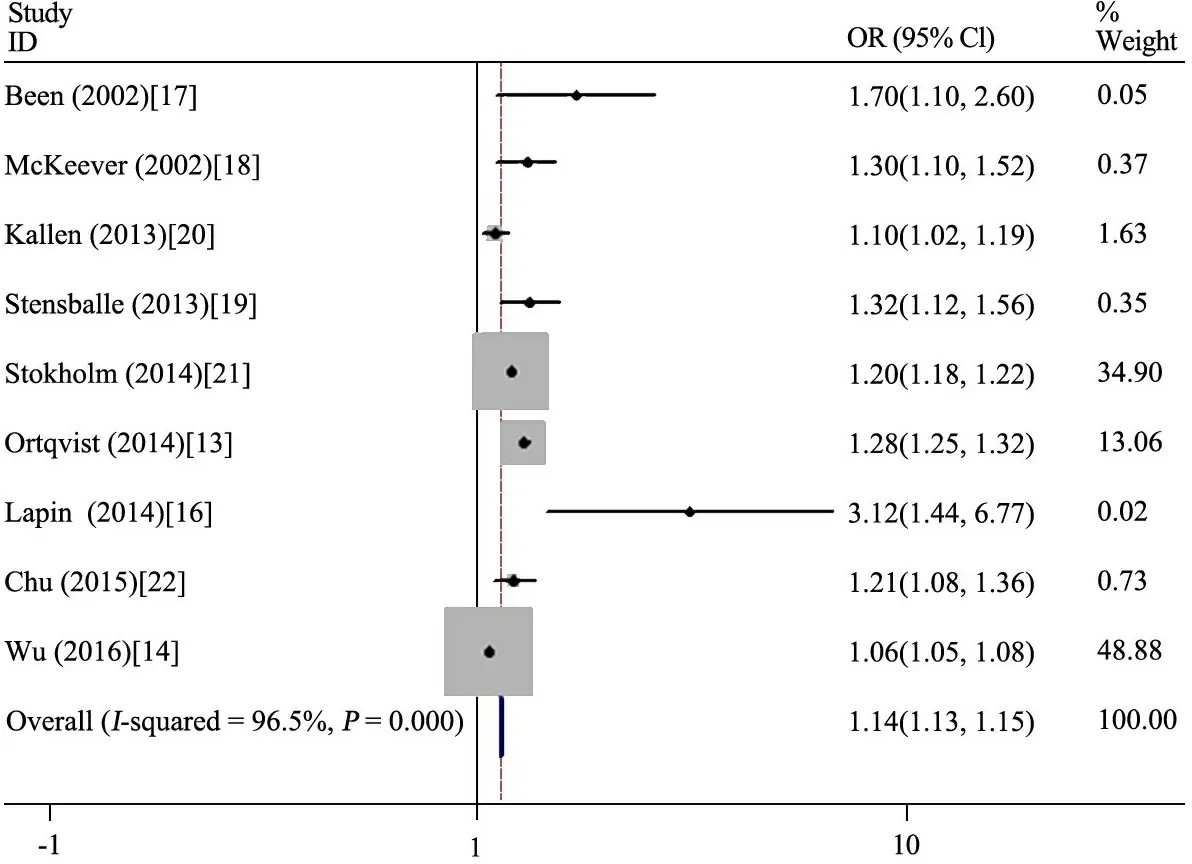
图2孕期抗生素使用与儿童哮喘的关系Meta分析
鉴于文献间异质性较大,逐篇去除行敏感性分析,结果发现文献[13,14,20,21]偏移较大,去除上述文献后行汇总OR=1.28(95% CI:1.19~1.39,I2=49.0%);余下5篇文献[16~19,22]再次行敏感性分析发现,文献[16]偏移较大,去除后再次汇总OR =1.27(95% CI:1.17~1.38,I2=0),均未对最终结果造成影响。
2.4 亚组分析
2.4.1 以随访年龄3岁为界孕期抗生素使用与儿童哮喘的关系Meta分析 图3显示,<3岁文献[16,18]间异质性较大(I2=78.8%),采用随机效应模型分析, OR=1.85(95%CI:0.80~4.29);≥3岁文献[13,14,17,19,21,22]间异质性较大(I2=96.8%),采用随机效应模型分析,OR=1.19(95%CI:1.08~1.31)。
2.4.2 不同孕期使用抗生素与儿童哮喘的关系Meta分析 有3篇[13,19,22]将孕期分为早、中和晚期,文献间具有异质性(I2=78.8%)使用随机模型分析,仅孕早期使用抗生素的后代哮喘风险率成正相关(OR=1.17,95%CI:1.01~1.37,I2=93.5%)。因Chu[22]的研究只提取青霉素使用对后代哮喘的关联,代表性较差,去除后异质性较好(I2=0),采用固定效应模型分析,图4显示,孕早期(OR=1.29,95%CI:1.23~1.34)、孕中期
(OR=1.30,95%CI:1.25~1.35)、孕晚期(OR=1.26,95%CI:1.21~1.31)。
2.4.3 按暴露因素获取方式与后代哮喘的关系Meta分析 图5显示,以自我报告(采访)[16,17,19,20,22]等暴露形式文献间异质性较大(I2=71.2%),采用随机效应模型分析,OR=1.27(95%CI:1.10~1.48,);以数据库作为暴露形式[13,14,18,21]文献间异质性较大(I2=98.6%),采用随机效应模型分析,OR=1.20(95%CI:1.08~1.32);自我报告、采访等形式提取数据对后代哮喘的影响更大。
2.4.4 不同抗生素与后代哮喘的关系Meta分析 有2项研究[19,22]列出了具体的抗生素类型,均有β-内酰胺类抗生素、磺胺嘧啶及其他类型的抗生素。文献间异质性小(I2=0)采用固定效应模型分析,β-内酰胺类抗生素可增加后代哮喘的风险OR=1.18(95%CI:1.08~1.30);磺胺嘧啶文献间异质性较大(I2=83.5%),采用随机效应模型分析,OR=1.19(95%CI:0.78~1.83);其他类型的抗生素文献间无异质性(I2=0),采用固定效应模型分析,OR=1.19(95%CI:0.95~1.49),磺胺嘧啶和其他抗生素与后代哮喘无关联。
2.5 同胞组孕期使用抗生素与后代哮喘的关系Meta分析结果 图6显示,有2项研究[13,14]设置了同胞对照研究,进行合并后结果显示,文献间异质性较大(I2=93.3%),采用随机效应模型,OR=0.91(95%CI:0.79~1.06),结果显示母孕期抗生素与后代哮喘无关联
2.6 发表偏倚 分别采用Begg 秩相关法和Egger直线回归法进行发表偏倚检验。用Begg秩相关法结果显示, 纳入文献连续型校正,各文献P=0.348;采用Egger直线回归法结果显示,纳入各文献中P=0.818,提示发表偏倚较小。
3 讨论
本文Meta 分析纳入的9篇文献均为队列研究,7项为前瞻性,2项为回顾性,采用NOS 评分评估偏倚风险,除文献[16]中含有高危因素的人群外,余8项文献暴露组均可真正或一定程度上代表人群中的暴露组的特征;4项研究[13,14,18,21]的数据来自档案记录的数据库,5项研究[16,17,19,20,22]的暴露数据来自自我报告、采访及问卷;9项研究的非暴露组与暴露组均来自同一人群,均控制了最重要混杂因素如胎龄母亲过敏疾病史等;4项研究[13、16,20,22]随访完整或有少量研究对象失访但不至于引入偏倚,5项研究[14、17~19,21]的随访未描述,但9项研究随访时间均足够长(≥2岁)。 所有文献NOS评分均≥6颗星,质量较高。
本文基于队列研究的Meta分析结果示,母孕期使用抗生素可增加后代患哮喘的风险,但同胞组队列研究结果示母孕期抗生素使用与后代哮喘无关联,提示家庭环境、遗传基因等残余因素可能是重要的混杂因素,且可导致逆向因果。随着新证据的纳入,残余因素对哮喘的影响越来越受到关注,其中Örtqvist等的研究首次开创了用同胞组控制残余家族因素,结果显示随着年长同胞个数的增加,儿童哮喘的发病率反而有所下降,提示年长同胞对年幼者有保护作用[14,23]。但相关研究较少,因此有待更多研究进一步验证,同时也是未来研究的方向。
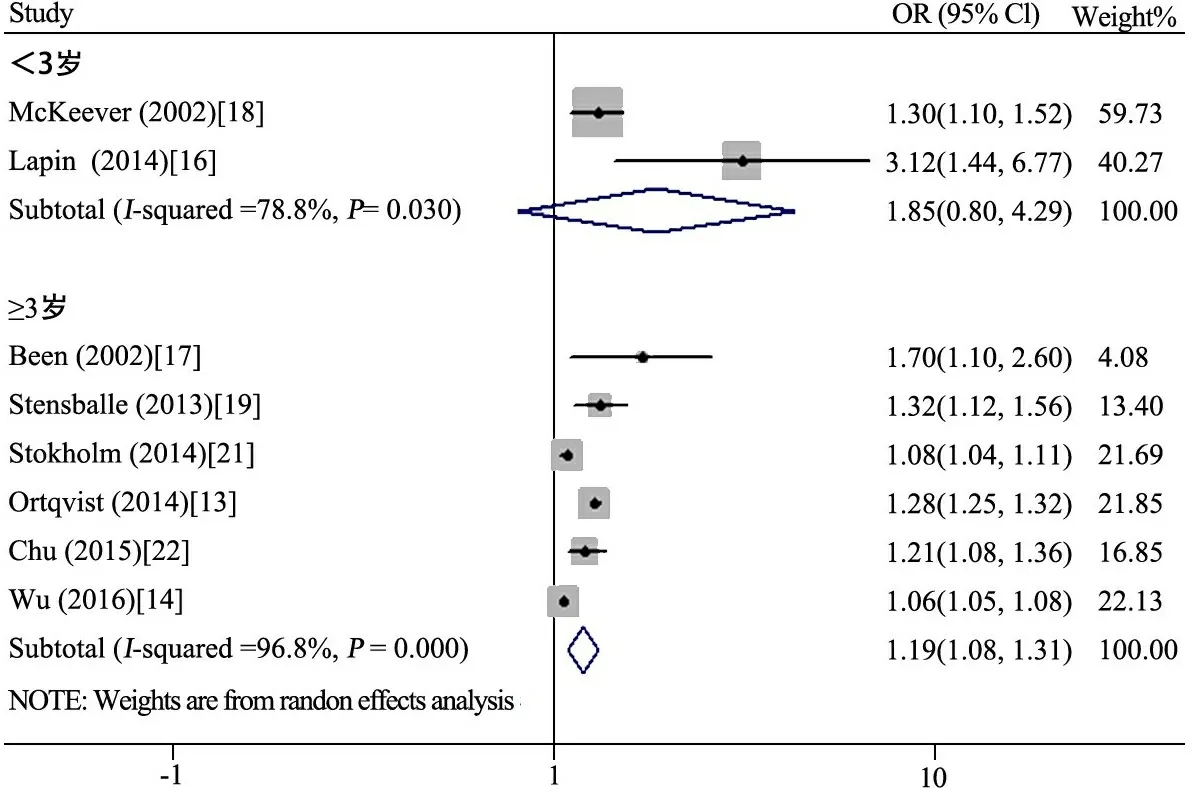
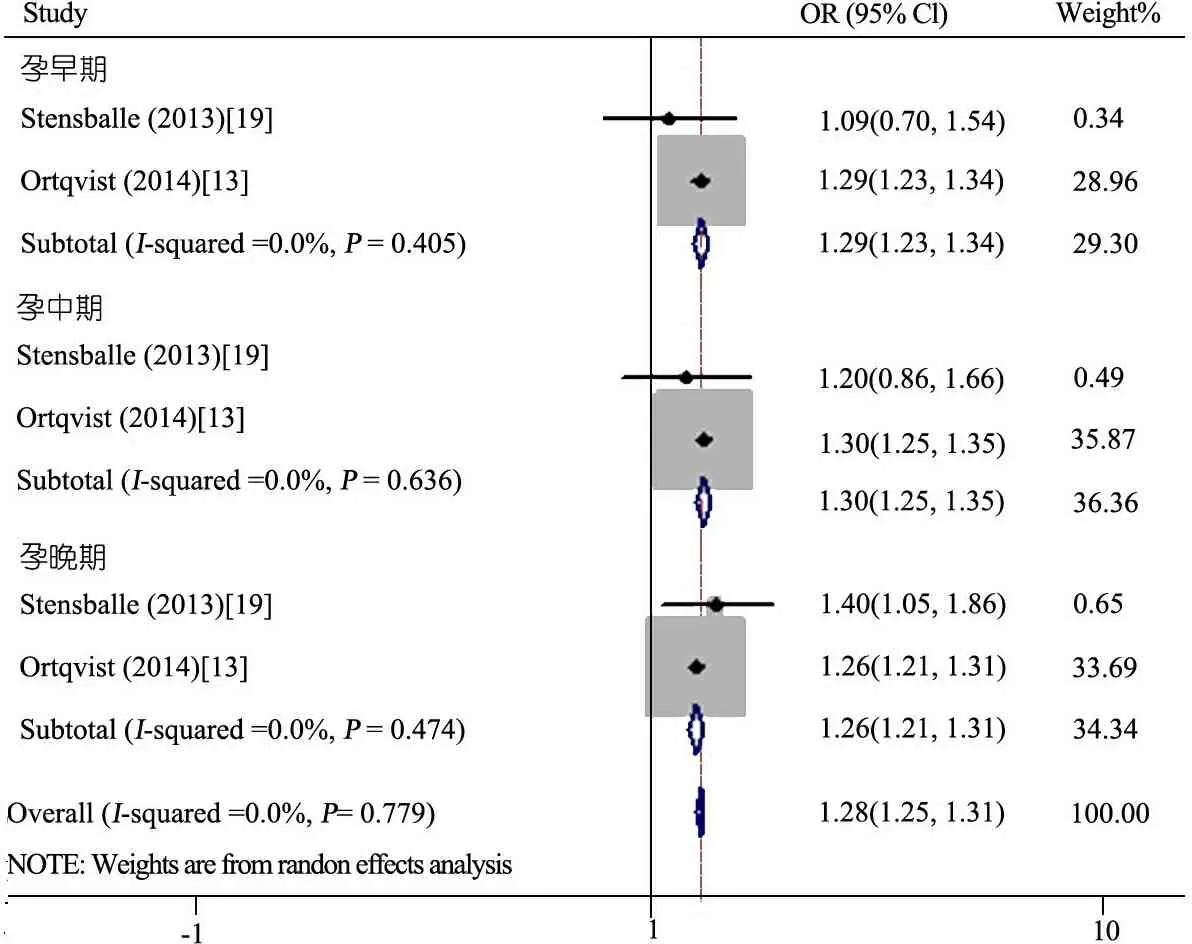
图3 以随访年龄3岁为界孕期抗生素使用与儿童哮喘的关系Meta分析
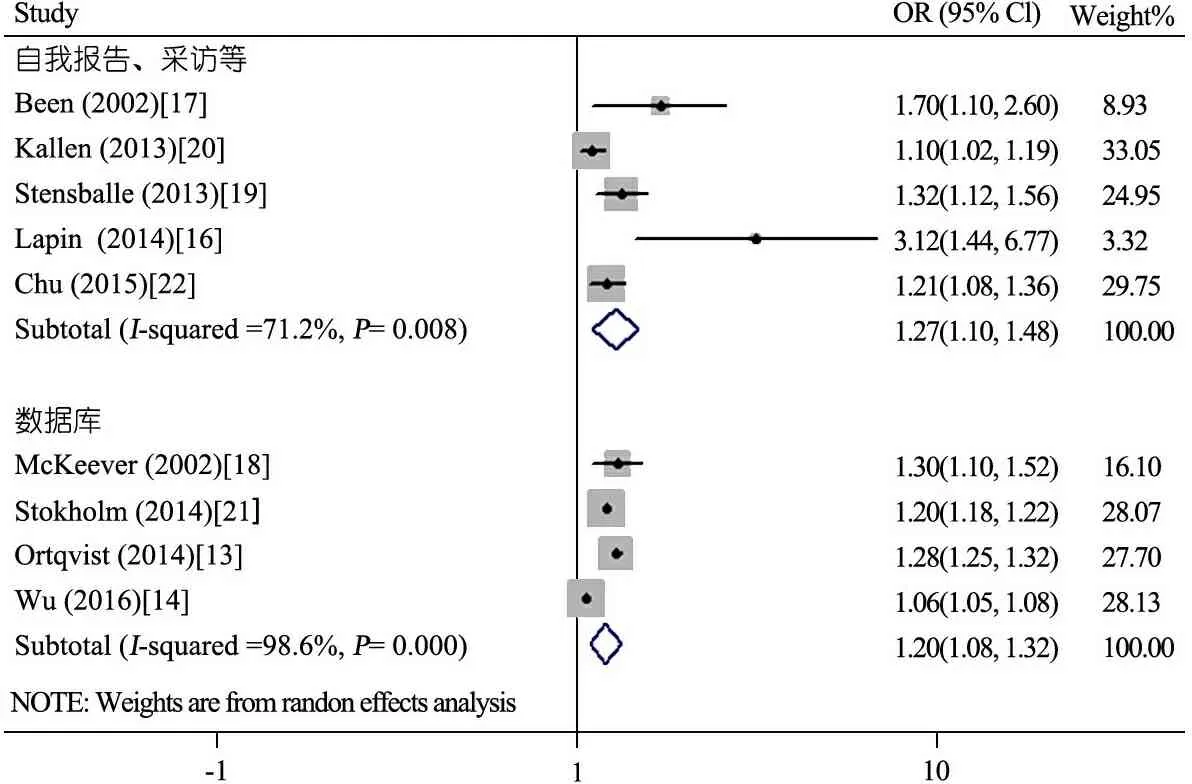
图4 不同孕期使用抗生素与儿童哮喘的关系Meta分析
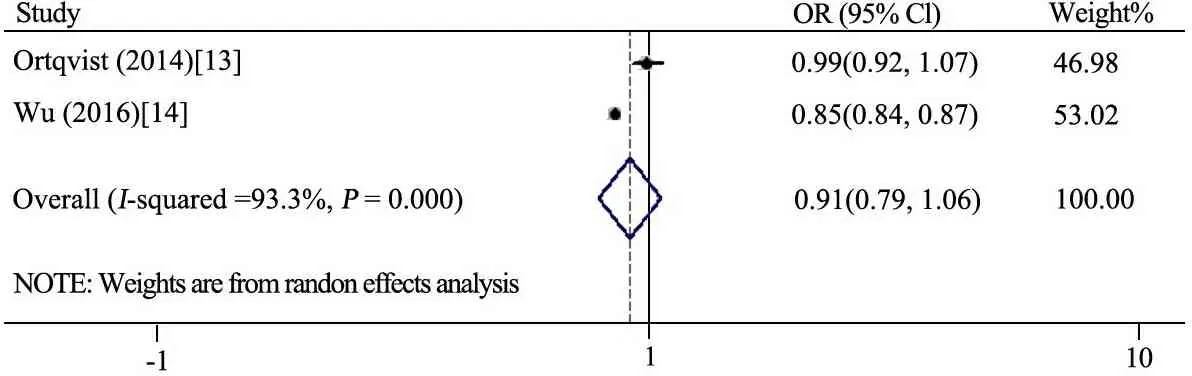
图5 按自我报告(采访)和数据库暴露因素获取方式与后代哮喘的关系Meta分析
图6同胞组孕期使用抗生素与后代哮喘的关系Meta分析
本文Meta纳入的研究均系观察性队列研究,文献汇总后异质性较大,混杂因素较,主要来源于以下几方面:①纳入人群有母亲与儿童两代人,母亲相关因素,如母亲过敏性疾病、吸烟、饮食、受教育水平、怀孕时婚姻状况、情绪等;儿童相关因素,如出生方式、性别、年龄、胎龄、出生体重、出生后生命早期的感染、胎次等;残余因素,如家庭环境、遗传易感性、就医观念及行为[18,24]等。②暴露因素的获取方式,抗生素的类型、剂量、疗程,暴露的时机不同,可能导致不同结果,而多数文献无法提取上述信息,导致异质性增加。③结局指标的标准、获取方式、年龄设置等不同也可能导致结果不同。本文纳入的9项研究除文献[16]的纳入对象为一级亲属哮喘病史1项指标外,其余均控制了母亲及儿童相关性混杂因素,但仅2项研究控制了残余因素。
为探索临床异质性来源,分别以随访年龄、不同孕期、暴露因素获取方式及不同抗生素类型行亚组分析。亚组分析结果示:不同的随访年龄结果不同,孕期抗生素使用对3岁以上儿童哮喘风险影响明显,3岁以下不明显;不同孕期使用抗生素对后代哮喘发病风险不同,孕中期对后代哮喘发病率影响最大,但仅有2项研究纳入,Chu等的研究首次提出孕早期是一个敏感窗口,因此不同孕期对哮喘的影响有待进一步研究;来自自我报告(访谈)形式比来自数据库有更大的风险比值;不同抗生素类型对后代哮喘的影响也不同,β-内酰胺类抗生素可增加后代哮喘的风险,而磺胺嘧啶及其他类型的抗生素与后代哮喘关联不大,提示孕期抗生素对后代哮喘关联与抗生素的类型有关,但相关研究少,有待进一步探讨。
综上所述,本文的异质性既不能用随访年龄、暴露因素获取方式消除,也不能仅凭孕期及抗生素类型解释,残余因素的作用是值得深入考虑的。
本文局限性如下:①纳入文献不能分辨感染类型、抗生素类型、剂量等,无法进一步分析抗生素特异性和效应关系;②纳入的研究人群主要为欧美洲人,使得结果的外推性受到限制,因种族的差异,结论可能不适合其他国家和地区的人群;③2017全球哮喘处理和预防策略指南指出≤ 6 岁儿童确诊为哮喘是有挑战性的,但本研究结局指标未限制年龄范围,在纳入的 9 篇研究中4篇研究的结局年龄≤ 6 岁,可能会对结果产生影响;④只纳入英文和中文文献,可能带来语种选择偏倚。⑤个别文献以平均年龄统计,可能对年龄分组产生影响。
[1]Krawiec ME, Westcott JY, Chu HW, et al. Persistent wheezing in very young children is associated with lower respiratory inflammation. Am J Respir Crit Care Med, 2001, 163(6): 1338-1343
[2]Barbato A, Turato G, Baraldo S, et al. Airway inflammation in childhood asthma. Am J Respir Crit Care Med, 2003, 168(7): 798-803
[3]Jenkins HA, Cool C, Szefler SJ, et al. Histopathology of severe childhood asthma: a case series. Chest, 2003, 124(1): 32-41
[4]Semic-Jusufagic A, Belgrave D, Pickles A, et al. Assessing the association of early life antibiotic prescription with asthma exacerbations, impaired antiviral immunity, and genetic variants in 17q21: a population-based birth cohort study. Lancet Respir Med, 2014, 2(8): 621-630
[5]Lapin B, Piorkowski J, Ownby D, et al. The relationship of early-life antibiotic use with asthma in at-risk children. J Allergy Clin Immunol, 2014, 134(3): 728-729
[6]Asthma Workgroup; Chinese Thoracic Society; Chinese Societ of General Practitioners. Chinese guideline for the prevention and management of bronchial asthma (Primary Health Care Version). J Thorac Dis, 2013, 5(5): 667-677
[7]Verduci E, Martelli A, Miniello V, et al. Nutrition in the first 1000 days and respiratory health: A descriptive review of the last five years’ literature. Allergol Immunopathol (Madr), 2017, 45(4): 405-413
[8]Bisgaard H, Hermansen MN, Buchvald F, et al. Childhood asthma after bacterial colonization of the airway in neonates. N Engl J Med, 2007, 357(15): 1487-1495
[9]Lynch SV, Boushey HA. The microbiome and development of allergic disease. Curr Opin Allergy Clin Immunol, 2016, 16(2): 165-171
[10]Metsälä J, Lundqvist A, Virta LJ, et al. Prenatal and post-natal exposure to antibiotics and risk of asthma in childhood.
Clin Exp Allergy, 2015, 45(1): 137-145
[11]Calvani M, Alessandri C, Sopo SM, et al. Infectious and uterus related complications during pregnancy and development of atopic and nonatopic asthma in children. Allergy, 2004, 59(1): 99-106
[12]Rusconi F, Galassi C, Forastiere F, et al. Maternal complications and procedures in pregnancy and at birth and wheezing phenotypes in children. Am J Respir Crit Care Med, 2007, 175(1): 16-21
[13]Örtqvist AK, Lundholm C, Kieler H, et al. Antibiotics in fetal and early life and subsequent childhood asthma: nationwide population based study with sibling analysis. BMJ, 2014, 349: g6979[14]Wu P, Feldman AS, Rosas-Salazar C, et al. Relative importance and additive effects of maternal and infant risk factors on childhood asthma. PloS one, 2016, 11(3): e0151705[15]Zhao D, Su H, Cheng J, et al. Prenatal antibiotic use and risk of childhood wheeze/asthma: A meta-analysis. Pediatr Allergy Immunol, 2015, 26(8): 756-ibl
[16]Lapin B, Piorkowski J, Ownby D, et al. Relationship between prenatal antibiotic use and asthma in at-risk children. Ann Allergy Asthma Immunol, 2015, 114(3): 203-207
[17]Benn CS, Thorsen P, Jensen JS, et al. Maternal vaginal microflora during pregnancy and the risk of asthma hospitalization and use of antiasthma medication in early childhood. J Allergy Clin Immunol, 2002, 110(1): 72-77
[18]McKeever TM, Lewis SA, Smith C, et al. The importance of prenatal exposures on the development of allergic disease: a birth cohort study using the West Midlands General Practice Database. Am J Respir Crit Care Med, 2002, 166(6): 827-832
[19]Stensballe LG, Simonsen J, Jensen SM, et al. Use of antibiotics during pregnancy increases the risk of asthma in early childhood. J Pediatr, 2013, 162(4): 832-838. e833[20]Källén B, Finnström O, Nygren KG, et al. Maternal drug use during pregnancy and asthma risk among children. Pediatr Allergy Immunol, 2013, 24(1): 28-(4
[21]Stokholm J, Sevelsted A, Bønnelykke K, et al. Maternal propensity for infections and risk of childhood asthma: a registry-based cohort study. Lancet Respir Med, 2014, 2(8): 631-637
[22]Chu S, Yu H, Chen Y, et al. Periconceptional and gestational exposure to antibiotics and childhood asthma. PloS one, 2015, 10(10): e0140443[23]Ball TM, Castro-Rodriguez JA, Griffith KA, et al. Siblings, day-care attendance, and the risk of asthma and wheezing during childhood. N Engl J Med, 2000, 343(8): 538- JA
[24]Su Y, Rothers J, Stern D, et al. Relation of early antibiotic use to childhood asthma: confounding by indication? Clin Exp Allergy, 2010, 40(8): 1222-1229

