不同配料及发酵剂对发酵香肠品质特性的影响
刘蒙佳,周强,许美纯,张宝善
(1.福建师范大学 闽南科技学院,福建 泉州 362332;2.陕西师范大学,西安 710119)
胶原蛋白(Collagen)是一种白色、不透明、无支链的不溶性纤维蛋白质,几乎存在于所有组织中,是生物体内重要的功能性蛋白质,起着支撑器官、保护机体的功能,同时还具有信号转导、生长因子与细胞因子转运等功能。由于这些特殊功能,胶原蛋白已成为生物科技产业最具关键性的原材料之一,在医学材料、化妆品、食品工业、生物合成等领域均有着广泛的应用。在食品领域中,胶原蛋白主要应用于补钙、减肥降血脂的功能食品中,亦可作为饮料澄清剂、冷冻食品增稠剂,还可以用于制作人造肠衣、食品的内包装膜以及涂层材料等用于食品表面。将胶原蛋白添加至肉制品里,可以改善肉制品的嫩度。经过断裂胶原蛋白分子里的氢键,使原本的超螺旋结构遭到破坏,生成结构较为疏松、分子较小的明胶,使肉制品的肉质嫩度及其食用价值得以提高,蛋白质含量增加,既有良好的口感又具有丰富的营养[1]。李星等[2]的研究结果表明:在普通香肠里添加适量的胶原蛋白,可以减少产品中水分的蒸发,提高香肠的出品率,改善香肠的嫩度,同时提高其营养价值。
发酵型香肠又名生香肠,是采用畜禽肉,通过绞碎,和动物的脂肪、辅料和发酵剂等掺杂后,灌进肠衣,通过微生物发酵,生成具有微生物典型特性的发酵香味肉产品,它具有特殊的风味、质地和色泽,并可较长时间保存。在微生物的作用下,蛋白质被分解成各类氨基酸,消化吸收率增加,且营养保健价值得到进一步改善,故而近年来发酵型香肠得到了快速的发展。
在2000多年前,外国人已经学会制作味道鲜美的香肠,且这类香肠具有持久的保质期。然而那时的食品是通过自然发酵、干燥为主制作的干香肠,这种产品如今仍在世界许多国家受到追捧。在德国、法国、意大利、西班牙等许多欧洲国家,生产发酵香肠是重要的经济来源之一[3]。目前,国外学术界关于发酵香肠的探究有两方面:改进发酵香肠的生产工艺和构建筛选具有良好性状的微生物菌种。
我国是肉与肉制品生产消费大国,发酵肉制品由于其悠久的历史和独特的风味深受人们喜爱[4],如川味香肠、广式腊肠等,这些传统发酵香肠都是依赖自然发酵而成,不仅生产周期长,且产品质量也不稳定。为了解决这一问题,近20年来,国内对发酵香肠的探究逐步火热起来,人们开始利用微生物发酵剂[5-7]或酶制剂[8,9]制作发酵香肠,尝试使用不同的原料肉来加工[10-16],采用不同的处理改善其品质特性[17-21],研究发酵香肠成熟过程中的生化变化规律、风味物质形成机制、菌相构成及变化[22-25],考察不同有益成分在香肠中的使用[26-33],努力开发具有安全性、保健性、营养性且美味可口的发酵香肠制品[34]。
发酵香肠中常用的发酵剂菌株是乳酸菌、接触酶阴性球菌(主要是葡萄球菌属和考克斯菌属),以及酵母和霉菌[35]。乳酸菌可以把原料中的糖分解、转化为酸,使产品的pH值减少。酸性条件可延长产品的保质期,抑制腐败菌的生长繁殖,避免食品的腐败[36];低pH值可以加快香肠的干燥速度,改善产品的硬度,使肉中的蛋白质更好地凝结,产品易于切片;同时可以促进亚硝酸盐的分解,减少亚硝酸胺的生成[37]。酵母菌具有分解脂肪、蛋白质和形成过氧化氢酶的能力,故可以显著改善发酵香肠色泽和风味,可促使香肠的酸味更适宜且具有酵母特殊的风味,还可在一定程度上抑制金黄色葡萄球菌的生长。有关材料证明:酵母菌会增加氨基酸的种类并可以降低香肠的酸度[38]。霉菌、微球菌和葡萄球菌均能使发酵香肠产生独特的风味和香气,同时可以抑制有害微生物生长,地中海地区常用毛霉和青霉发酵促进香肠感官品质的提高。
常见的发酵香肠以单独接种乳酸菌发酵居多,其虽能快速降低产品pH值,但产品褪色现象严重;单独接种微球菌能改善产品色泽,但pH值的下降速度相对较慢。研究发现:发酵香肠时,应用混合菌种比单一菌种更能使制品具有独特的风味和良好的品质[39,40]。目前,乳酸菌或微球菌与酵母菌混合发酵生产香肠的方法鲜有报道。
随着人们健康意识的提高,消费者对食品的要求,已从单一的果腹,逐步升级为追求营养和美味。故本研究主要考察复合发酵剂(乳酸菌和酵母菌)和胶原蛋白在燕麦猪肉发酵香肠中的应用效果,探究配方的优化以及各添加成分对发酵香肠品质特性的影响,旨在生产出可迅速发酵又安全稳定的花色、保健型发酵香肠,为生产提供可行性理论依据。
1 材料与方法
1.1 实验材料
实验使用优比特双歧杆菌酸奶发酵菌及安琪葡萄酒果酒专用酵母RW。
猪前腿瘦肉、背膘、羊肠衣、淀粉、料酒、燕麦粉、香辛料、葡萄糖、食盐、味精、白砂糖、食品级亚硝酸钠等原料,均为市售。
不同类型胶原蛋白粉(500-S-01,500-S-02,1000-S-01,1000-S-02,1000-A-02,2000-S-02,3000-S-01,3000-S-02),由北京盛美诺生物技术有限公司提供。
对氨基苯磺酸、盐酸、盐酸萘乙二胺、硼砂、硫酸锌、亚硝酸钠,均为国产分析纯。
MRS培养基、营养琼脂培养基、PDA培养基,均为生化试剂。
1.2 主要仪器与设备
JYZ-D525型九阳绞肉机(九阳)、SW-CJ-1F型单人双面净化工作台(苏州净化)、YXQ-LS-75S11型立式压力蒸汽灭菌器、SPX-150B-Z型生化培养箱(上海博讯)、DHG-9070型电热恒温鼓风干燥箱(上海经鸿)、雷磁PHS-3C型pH计(上海贻电)、TE612-L型电子天平(北京赛多利斯)、DKL(FC)-6型远红外电热食品烤炉(广东多利)、BCD-256KT型海尔电冰箱(青岛海尔)、721型可见分光光度计(上海光谱)、EG823LC2-NA型微波炉(美的)、HBD5-MS2100 WA型水分活度仪(北斗星)。
1.3 实验方法
1.3.1 发酵香肠基础配方
瘦肥肉比为7∶3、葡萄糖1.25%、味精0.1%、食盐2.5%、淀粉5%、香辛料(白胡椒粉)0.16%、白砂糖3%、料酒1%、亚硝酸钠0.01%、发酵剂适量、燕麦粉适量、胶原蛋白粉适量。
1.3.2 发酵香肠工艺流程

1.3.3 工艺要点
实验选用新鲜的猪后腿肉及背部的硬膘,将其切成小块后绞碎,加入辅料,搅匀,置于0~4 ℃腌制8 h,加胶原蛋白粉及燕麦粉,并接入适量的发酵剂(酵母菌与乳酸菌以一定比例混合),搅匀,灌入羊肠衣中,控制好肉馅间的空隙,用细绳结扎并针刺肠体,最后擦净外壁。将香肠置于培养箱内发酵,而后提高温度进行干燥处理,并于150 ℃左右条件下烤熟。
1.3.4 实验设计
取适量已处理好的猪肉(瘦肉∶肥肉为7∶3),添加辅料,腌制8 h,把腌好的肉分成若干份,每份中添加2%胶原蛋白粉(1000-S-01型)及10%燕麦粉,然后分别把复合发酵剂(乳酸菌与酵母菌的混合)的接种比例设置为1∶0,0∶1,1∶1,1∶2,2∶1,每种处理做3组平行。菌种接种量均为3%,拌匀后灌入肠中,于40 ℃恒温环境中培养11 h,发酵结束后于60 ℃恒温环境中干燥2 h,干燥结束后测定pH值、水分含量,并于烤熟后进行感官评定。接种比例确定后,按照此方法依次考察接种量(1%,2%,3%,4%,5%)、燕麦粉添加量(4%,6%,8%,10%,12%)、胶原蛋白粉类型(500-S-01,500-S-02,1000-S-01,1000-S-02,1000-A-02,2000-S-02,3000-S-01,3000-S-02)及添加量(0%,2%,4%,6%,8%)、发酵温度(25,30,35,40,43 ℃)及时间(7,11,15,19,23 h)等因素的改变对香肠品质的影响,每个处理做3组平行。
1.4 指标测定方法
1.4.1 感官评定
由7位品尝人员组成评定小组实行评分,采用100分评分制,包括色泽、组织状态、口感、风味各25分,取平均值,具体评分标准见表1。
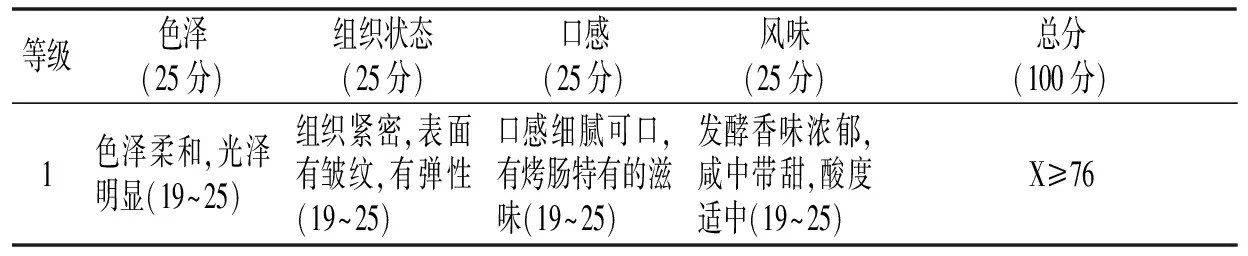
表1 感官评分标准Table 1 Standards of sensory evaluation

续 表
1.4.2 理化指标测定
pH值:样品经处理后,使用pH计测定;水分含量:采用直接干燥法测定;水分活度:使用水分活度仪测定;亚硝酸盐含量:采用GB 5009.33-2010中盐酸萘乙二胺法测定。
1.4.3 微生物指标测定
细菌总数:采用国标GB 4789.2-2010中方法测定;乳酸菌数:采用国标GB 4789.35-2010中方法测定;酵母菌数:采用国标GB 4789.15-2010中方法测定。
2 结果与分析
2.1 菌种比例对猪肉发酵香肠品质特性的影响

图1 不同菌种比例下猪肉发酵香肠的水分含量和pH值Fig.1 Moisture content and pH value of fermented pork sausage under different bacteria ratios

图2 菌种比例对猪肉发酵香肠感官评分的影响Fig.2 Effect of bacteria ratios on sensory scoring of fermented pork sausage
由图1和图2可知,发酵香肠感官评分随着菌种比例(乳酸菌∶酵母菌)的变化出现先升高后下降的趋向,菌种比例(乳酸菌∶酵母菌)为1∶2时,香肠的色泽、口感及风味是最佳的,感官评分是最高的,具有较低pH值和低水分含量。发酵香肠pH值随菌种比例(乳酸菌∶酵母菌)的变化出现先升高后下降的趋向,因为乳酸菌能降低产品的酸度,并且两菌混合能使香肠的酸度更低。而酸性环境能延长产品的货架期,低pH值能加快香肠干燥速度,缩短生产周期,并促使亚硝酸盐分解,减少生成亚硝酸胺,提高产品质量。与其他几组相比,菌种比例(乳酸菌∶酵母菌)在1∶2时,发酵香肠的综合评分最高,酸味更加适宜,且香肠的色泽、口感和风味都有较显著的改善,因为酵母菌能明显改善发酵香肠的色泽和风味,使香肠的酸味更适中并具有独特的酵母风味,且乳酸菌的终产物可以使香肠具有独特的风味[41]。所以,当酵母菌和乳酸菌以适当比例混合时,发酵香肠的质量提高,色泽、风味改善,并且生产周期缩短。所以,宜选取复合菌种(乳酸菌∶酵母菌为1∶2)发酵猪肉香肠。
2.2 菌种接种量对猪肉发酵香肠品质特性的影响

图3 不同菌种接种量下猪肉发酵香肠的水分含量和pH值Fig.3 Moisture content and pH value of fermented pork sausage under different bacteria inoculum doses
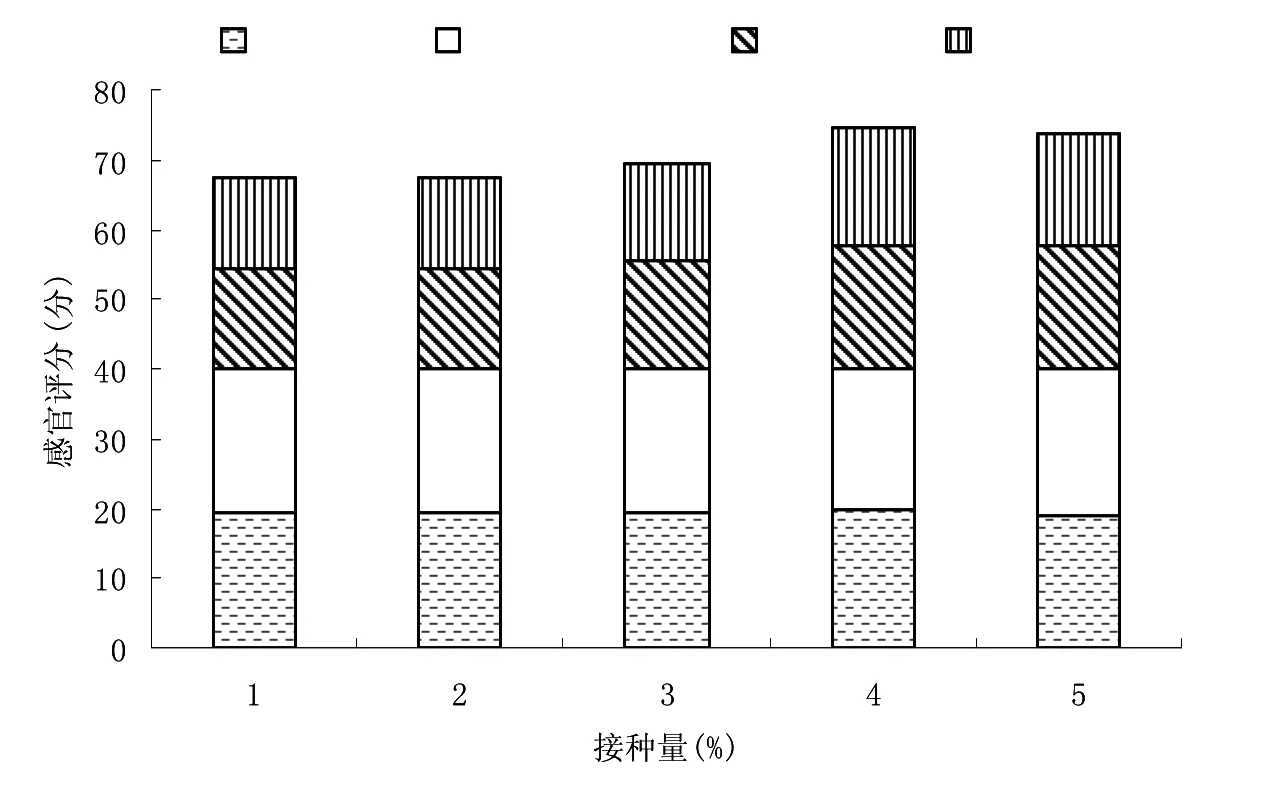
图4 菌种接种量对猪肉发酵香肠感官评分的影响Fig.4 Effect of bacteria inoculum doses on sensory scoring of fermented pork sausage
由图3和图4可知,发酵香肠感官评分随着复合发酵剂(乳酸菌∶酵母菌为1∶2)接种量的增加出现先升高后下降的趋向。复合发酵剂(乳酸菌∶酵母菌为1∶2)接种量为4%时,香肠的色泽、口感和风味是最佳的,感官评分是最高的,具有较低pH值和低水分含量。发酵香肠pH值随着复合发酵剂(乳酸菌∶酵母菌为1∶2)接种量的增加逐渐下降,主要是因为乳酸菌的大量繁殖,使肠馅里的碳水化合物分解,产生了少量醋酸和大量乳酸,使pH值降低。有关研究发现,低pH值是食品防腐的重要栅栏因子,发酵香肠的pH值保持在5.3以下是其安全控制的关键因素[42]。
当复合发酵剂(乳酸菌∶酵母菌为1∶2)接种量较低(1%,2%,3%)时,pH值难以在短时间内下降,产品的pH值都大于5.3,不能有效地抑制金黄色葡萄球菌等有害菌生长;复合发酵剂(乳酸菌∶酵母菌为1∶2)接种量为4%,5%时,其pH值下降至5.3以下,能够有效地抑制致病菌生长。但是接种量不易太大(5%),因其会导致pH值下降较快,影响产品的色泽和风味[43]。因此,最佳菌种接种量为4%。
2.3 燕麦粉添加量对猪肉发酵香肠品质特性的影响
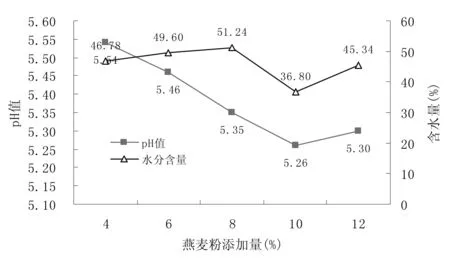
图5 不同燕麦粉添加量下猪肉发酵香肠的水分含量和pH值Fig.5 Moisture content and pH value of fermented pork sausage under different oat meal additive amount

图6 燕麦粉添加量对猪肉发酵香肠感官评分的影响Fig.6 Effect of oat meal additive amount on sensory scoring of fermented pork sausage
由图5和图6可知,发酵香肠感官评分随着燕麦粉添加量增多出现先升高后下降的趋向。燕麦粉添加量为10%时,香肠的色泽、组织状态、口感及风味是最佳的,感官评分是最高的,具有低pH值和水分含量。随着燕麦粉添加量的增多,发酵香肠的色泽越来越柔和,光泽越来越明显,燕麦味道渐渐变浓,且其组织状态也渐渐变得紧密、有弹性。但过量添加燕麦粉则香肠色泽不柔和,光泽暗淡,组织状态、口感、风味等不佳。因此,最佳燕麦粉添加量为10%。
2.4 胶原蛋白粉添加量对猪肉发酵香肠品质特性的影响

图7 不同胶原蛋白粉添加量下猪肉发酵香肠的水分含量和pH值Fig.7 Moisture content and pH value of fermented pork sausage under different collagen powder additive amount

图8 胶原蛋白粉添加量对猪肉发酵香肠感官评分的影响Fig.8 Effect of collagen powder additive amount on sensory scoring of fermented pork sausage
由图7和图8可知,发酵香肠感官评分随着胶原蛋白粉添加量增多出现先升高后下降的趋向。添加胶原蛋白粉可使发酵香肠的感官品质稍有提高,添加胶原蛋白粉的量在4%时,香肠单项感官评分综合为最佳,具有低pH值和高水分含量。而添加了胶原蛋白粉的香肠比不添加胶原蛋白粉的香肠水分含量明显提高,这主要是因为胶原蛋白粉的乳化、凝胶、保水和吸水等特性发挥了一定作用。相关报道证明胶原蛋白粉添加至香肠里会提高其嫩性、弹性[44],此结果与其相同。所以,最佳胶原蛋白粉添加量是4%。
2.5 胶原蛋白粉类型对猪肉发酵香肠品质特性的影响
经查阅资料可知:胶原蛋白粉分子量为1000~3000 Da时最容易在人体里被吸收。
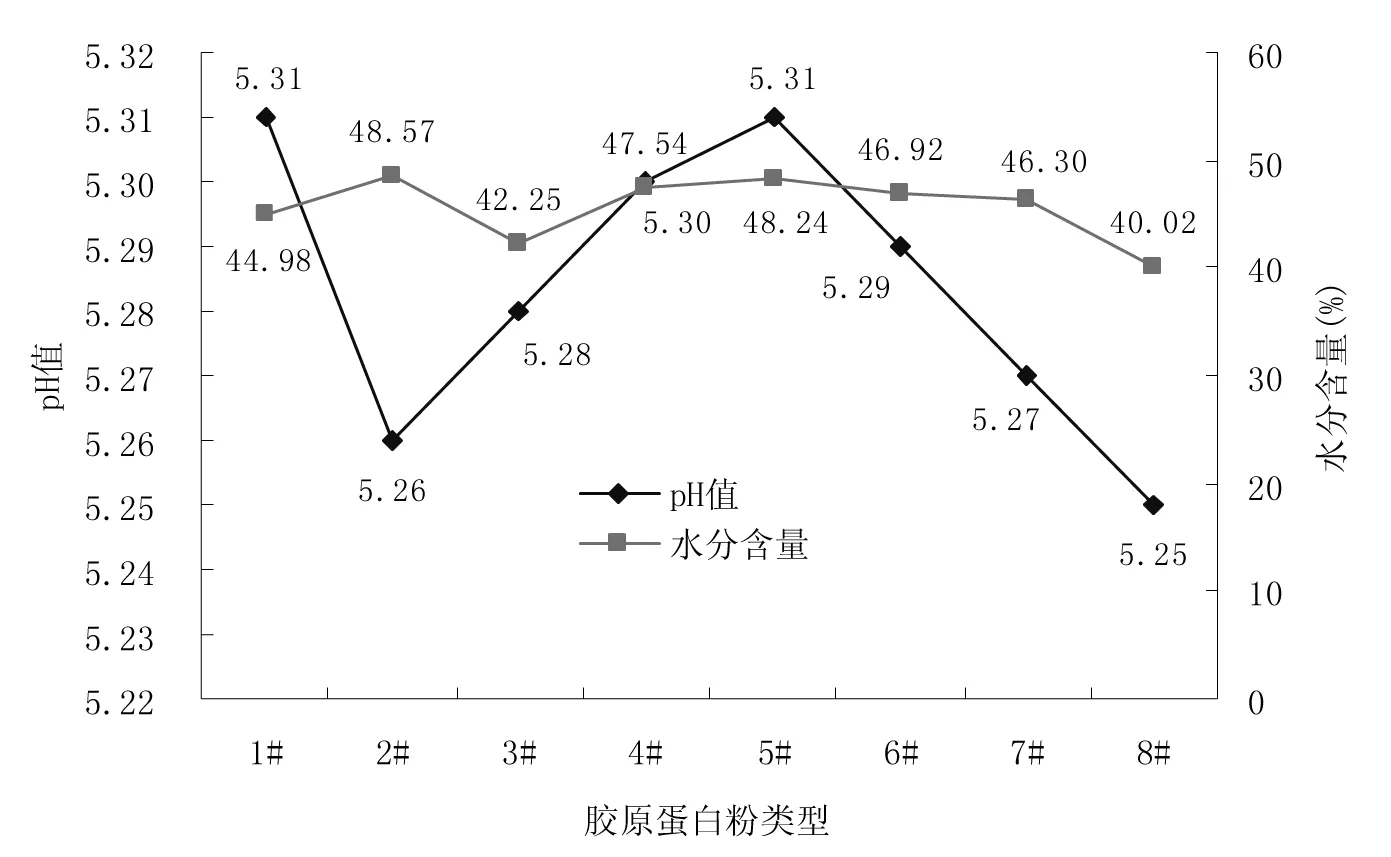
图9 不同胶原蛋白粉类型下猪肉发酵香肠的水分含量和pH值Fig.9 Moisture content and pH value of fermented pork sausage under different collagen powder types
注:1#(500-S-01),2#(500-S-02),3#(1000-S-01),4#(1000-S-02),5#(1000-A-02),6#(2000-S-02),7#(3000-S-01),8#(3000-S-02)。第1个整数代表胶原蛋白的分子量;01代表鱼鳞;02代表鱼皮;S代表胶原蛋白的状态,即:粉末状。

图10 胶原蛋白粉类型对猪肉发酵香肠感官评分的影响Fig.10 Effect of collagen powder types on sensory scoring of fermented pork sausage
由图9和图10可知,添加1000-S-01型胶原蛋白粉制作出来的发酵香肠感官评分是最高的。添加不同类型胶原蛋白粉制作出来的香肠pH值相差不大,添加1000-S-01型胶原蛋白粉的产品具有相对较低的水分含量。添加1000-S-01型胶原蛋白粉的产品与其他几组香肠相比,其组织状态更有弹性,口感更细腻,风味更佳。由于实验过程中将胶原蛋白粉直接加进了香肠中,这样处理改善了香肠的嫩度以及熟后肌肉的纹理。经过断裂胶原蛋白分子里的氢键,使原本的超螺旋结构遭到破坏,生成结构较为疏松、分子较小的明胶,使香肠的肉质嫩度及食用价值得以提高,蛋白质含量增加,既有良好口感又具有丰富营养[45]。因此,在制作猪肉发酵香肠时,可考虑添加一定量的胶原蛋白,经分析可知,本产品宜使用1000-S-01型胶原蛋白粉。
2.6 发酵温度对猪肉发酵香肠品质特性的影响

图11 不同发酵温度下猪肉发酵香肠的水分含量和pH值Fig.11 Moisture content and pH value of fermented pork sausage under different fermentation temperatures

图12 不同发酵温度下猪肉发酵香肠的品质特性Fig.12 Quality characteristics of fermented pork sausage under different fermentation temperatures
温度是发酵香肠生产过程中最重要的因素之一[46],由图11和图12可知,随着发酵温度上升,发酵香肠感官评分出现先升高后下降的趋向,而其pH值出现先降低后上升的趋向。微生物有最高、最适以及最低的生长温度范围,一旦超出其生长温度范围(温度低于最低生长温度范围或高于最高生长温度范围),微生物便无法生长,处于休眠状态,甚至失活。乳酸菌和酵母菌混合使用时,生长温度最适为30 ℃,发酵11 h后pH值小于5.3,属于高酸性发酵香肠,可抑制不良微生物的生长[47]。在此条件下获得的产品组织状态紧密,口感细腻,风味最佳,综合感官总分最多。因此,最佳发酵温度为30 ℃。
2.7 发酵时间对猪肉发酵香肠品质特性的影响

图13 不同发酵时间下猪肉发酵香肠的水分含量和pH值Fig.13 Moisture content and pH value of fermented pork sausage under different fermentation time
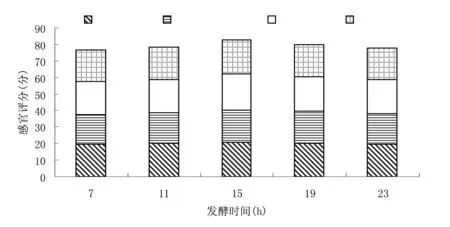
图14 发酵时间对猪肉发酵香肠感官评分的影响Fig.14 Effect of fermentation time on sensory scoring of fermented pork sausage
由图13和图14可知,发酵香肠感官评分随着发酵时间增长出现先升高后下降的趋向,发酵香肠pH值随着发酵时间增长出现先降低后上升的趋向,发酵15 h与19 h香肠pH值相差不大,但发酵15 h产品pH值可低于5.3,从时间及经济等方面考虑,应优先选择发酵15 h,此条件下香肠的各项感官评分均是最好的。因此,最佳发酵时间为15 h。
2.8 正交实验结果分析
在单因素实验基础上进行正交实验,实验设计见表2。其中,复合发酵剂中乳酸菌与酵母菌的比例为1∶2,选用1000-S-01型胶原蛋白粉,发酵温度30 ℃。正交实验结果见表3。

表2 正交实验因素水平表Table 2 Factors and levels of orthogonal experiments

表3 正交实验结果Table 3 Results of orthogonal experiments
根据极差分析可得,各成分对实验结果的主次影响顺序是A>D>C>B。极差分析最优组合为A2B2C3D1。在9种组合中可以直观地看出最优水平是5号组合,为A2B2C3D1,实验指标值为83.09分,二者重合。
在正交实验的方差分析中,选取与极差分析相同的4个因素,即:菌种接种量、燕麦粉添加量、胶原蛋白粉添加量、发酵时间。运用DPS9.5数据处理系统,进行方差分析计算,结果见表4。4个因素的显著次序为A>D>C>B,方差分析和极差分析的结果相同。

表4 方差分析结果Table 4 Results of variance analysis
注:“*”表示显著,“**”表示极显著。
直观、极差与方差等的分析结果一致,所以A2B2C3D1被认为是理想工艺制备条件,即:复合发酵剂(乳酸菌∶酵母菌为1∶2)接种量是4%,燕麦粉添加量是10%,使用1000-S-01型胶原蛋白粉,其添加量是6%,发酵时间是13 h。
2.9 发酵时间及发酵后干燥对猪肉发酵香肠理化指标及微生物指标的影响
利用获得的最优工艺条件,制备发酵香肠,每隔一段时间测定其pH值、水分含量、水分活度、细菌总数、乳酸菌数及酵母菌数等指标,以及终产品中亚硝酸盐残留量,结果见表5和表6。
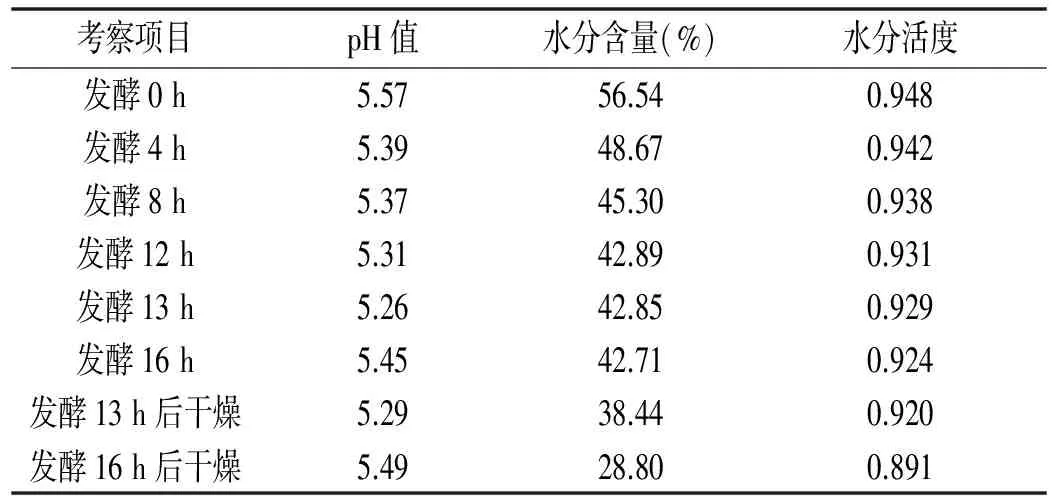
表5 发酵时间及干燥处理对猪肉发酵香肠理化指标的影响Table 5 Effect of fermentation time and drying treatment on physical and chemical indicators of fermented pork sausage
由表5可知,发酵时间及发酵后干燥对发酵香肠pH值作用不大,但对水分含量、水分活度则有明显的作用。由于发酵时间增加及干燥,pH值先逐渐降低后升高,但是幅度不显著,这可能是由于酵母菌的作用使得pH值变化不显著,Dierings等[48]研究发现添加酵母菌后的培养基中,乳酸菌生成乙酸和乳酸的速率变缓慢,而水分活度和水分含量则明显下降。

表6 发酵时间及干燥处理对猪肉发酵香肠微生物菌群的影响Table 6 Effect of fermentation time and drying treatment on microbial communities of fermented pork sausage cfu/g
由表6可知,在发酵周期(16 h)内,细菌总数、乳酸菌数呈先上升后下降趋势,在发酵13 h时相关指标达到最高值;在12 h发酵前酵母菌数呈上升趋势,并在发酵12 h时菌数到达高峰,而后逐渐降低。
结合表6,经过对pH值的研究发现,发酵13 h时香肠pH值最低,和在发酵13 h时乳酸菌数呈现高峰现象吻合。这是由于乳酸菌数在发酵13 h时达到最高值,产生的乳酸积累量也达到最高值,所以pH值最低。随发酵时间增长以及较高温度干燥,乳酸菌数渐渐降低,乳酸发生转化作用,pH值逐渐上升。
酵母菌数量在发酵12 h时出现高峰,随后逐渐下降,主要与乳酸菌数量有关。开始时乳酸菌数量较少,酵母菌便迅速生长,在发酵8 h时,乳酸菌数量逐渐增加,乳酸也积累了一定量,pH值达到5.31,酵母菌的生长渐渐受到抑制,以及较高温度干燥,酵母菌不耐热,数量便渐渐下降。
通过2.5的方法,得出样品中的亚硝酸盐含量为6.759 mg/kg,符合我国的食品添加剂使用卫生标准(不超过0.03 g/kg),证明本实验制得的发酵香肠安全可食。
2.10 产品的质量标准
2.10.1 感官指标
色泽:红润、光泽明显;
组织状态:紧密、表面有皱纹、有弹性;
口感:细腻、有烤肠特有滋味;
风味:发酵浓郁、咸中带甜、酸度适中。
2.10.2 理化指标
pH值:<5.3;
水分含量:≤45%;
水分活度:≤0.92;
亚硝酸盐含量:≤0.03 g/kg。
2.10.3 微生物指标
细菌总数:≥24×103cfu/g;
乳酸菌数:≥35×105cfu/g;
酵母菌数:≥60×105cfu/g;
致病菌:不得检出。
3 结论
在单因素实验和正交实验的极差分析与方差分析的基础上得到最佳的猪肉发酵香肠制作工艺是:在原料猪肉中加入一定量调料及香辛料,添加10%燕麦粉及6%胶原蛋白粉(型号1000-S-01),接种4%复合发酵剂(乳酸菌∶酵母菌为1∶2)后,于30 ℃环境中发酵13 h,在60 ℃环境中干燥2 h后用150 ℃的温度烤30 min左右至熟。所得产品色泽红润,光泽明显,组织紧密,口感细腻,有烤肠特有滋味,发酵香味浓郁,咸中带甜,酸度适中。
复合发酵剂的使用可使发酵香肠的质量提高,色泽、风味改善,并且可使生产周期缩短,而胶原蛋白的添加可使发酵香肠的弹性、嫩度提高。
[1]陈甜甜.有关胶原蛋白在食品中的应用分析[J].中外食品工业,2014(11):69-70.
[2]李星,葛良鹏,张晓春,等.胶原蛋白对香肠品质的影响研究[J].食品研究与开发,2014,35(17):13-15.
[3]王敏.发酵香肠及其发酵剂的研究进展[J].江苏调味副食品,2013(3):4-9.
[4]权美平.发酵香肠在自然风干存贮过程中的理化指标变化[J].中国调味品,2013,38(7):44-46.
[5]李茜,蔺晓敏,王水晶,等.发酵剂BOM-13生产发酵香肠发酵条件的优化[J].山西农业大学学报:自然科学版,2015,35(4):430-434.
[6]李俊霞,王新惠,白婷,等.植物乳杆菌对发酵香肠理化特性影响的研究[J].食品科技,2015(9):110-114.
[7]潘晓倩,成晓瑜,张顺亮,等.不同发酵剂对北方风干香肠色泽和风味品质的改良作用[J].食品科学,2015,36(14):81-86.
[8]段艳,袁倩,贾雪晖,等.外源蛋白酶对羊肉干发酵香肠理化特性的影响[J].食品研究与开发,2012,33(8):54-58.
[9]段艳,刘夏炜,靳志敏,等.植物乳杆菌及木瓜蛋白酶对羊肉干发酵香肠保藏性的影响[J].食品工业,2014,35(7):106-110.
[10]李超,王乃馨,陈尚龙,等.混菌发酵制备鸭肉香肠的工艺优化及其氧化控制研究[J].中国调味品,2016,41(1):25-29.
[11]姚光明,张猛,刘佳彤,等.脂代果蔬/鹿肉复合发酵香肠加工特性与工艺优化[J].肉类研究,2014(11):21-26.
[12]李彦坡,周红梅,卢丹淑.鱼发酵香肠发酵特性研究[J].温州农业科技,2015(4):20-23.
[13]王曙光,王德宝,马丹,等.混合发酵剂对羊肉发酵香肠理化特性和亚硝酸盐残留量的影响[J].食品科技,2015(11):86-89.
[14]王志威,许彩云,李先保.鹅肉发酵香肠工艺条件的研究[J].食品与生物技术学报,2014,33(8):877-883.
[15]董杰,蒋云升,张文娟,等.兔肉香肠发酵剂添加方式及配比的优化研究[J].安徽农业科学,2012,40(30):14971-14972.
[16]黄燕.响应面优化乌蒙乌鸡发酵香肠的发酵工艺研究[J].食品工业,2013(12):67-69.
[17]李超,王乃馨,陈尚龙,等.葡萄籽提取物对发酵鸭肉香肠储存稳定性的影响[J].食品工业,2016(2):117-120.
[18]商学兵.银杏叶提取物对发酵猪肉香肠储存稳定性的影响[J].中国食品添加剂,2016(1):104-108.
[19]《肉类研究》编辑部.挪威科学家研究超高压处理的原料肉加工干发酵香肠的微生物、物化性质和感官参数[J].肉类研究,2015(9):1.
[20]罗玉龙,靳烨,靳志敏,等.不同包装条件对羊肉发酵香肠品质特性的影响[J].食品科学,2015,36(18):252-256.
[21]刘恩岐,陈尚龙,巫永华,等.微波处理对发酵香肠干燥成熟期安全稳定性和品质的影响[J].食品工业,2015,36(8):37-41.
[22]巩洋,孙霞,杨勇,等.混合菌种发酵生产的低酸度川味香肠挥发性成分分析[J].食品与发酵工业,2015,41(7):175-181.
[23]Paulsen P,Vali S,Bauer F.Quality traits of wild boar mould-ripened salami manufactured with different selections of meat and fat tissue,and with and without bacterial starter cultures[J].Meat Science,2011,89(4):486-490.
[24]Wang Xinhui,Ren Hongyang,Liu Dayu,et al.Effects of inoculatingLactobacillussakeistarter cultures on the microbiological quality and nitrite depletion of Chinese fermented sausages[J].Food Control,2013,32(2):591-596.
[25]王磊,陈宇飞,杨柳.草鱼肉发酵香肠发酵过程中微生物变化的研究[J].中国调味品,2016,41(2):65-68.
[26]吴昊,张光杰,吕留庄,等.绿茶风味发酵香肠工艺研究[J].山东食品发酵,2013(2):22-26.
[27]樊晓盼,王思雨,马俪珍.蒸煮蔬菜发酵香肠的品质评价[J].肉类研究,2015(9):1-5.
[28]邵丽霞.沙葱及其提取物对羊肉发酵香肠加工过程中品质特性的影响[D].呼和浩特:内蒙古农业大学,2012.
[29]王岩.牛蒡紫山药发酵香肠的研究[J].肉类工业,2014(10):8-10.
[30]王岩.复合型膳食纤维鸭肉发酵香肠的研制[J].食品工业,2012(12):52-54.
[31]吴凡.发酵香菇香肠生产工艺研究[J].山东食品发酵,2012(1):34-35.
[32]王庭.红枣发酵香肠的设计研制[J].肉类研究,2010(6):19-21.
[33]李志国,周清涛,魏星华.甜玉米发酵鱼肉肠工艺的研究[J].农产品加工·学刊,2010(4):51-54.
[34]章倩羽,曾小群,吕鸣春,等.发酵香肠研究进展[J].现代化农业,2014(11):24-26.
[35]Ammor M S,Mayo B.Selection criteria for lactic acid bacteria to be used as functional starter cultures in dry sausage production:an update[J].Meat Science,2007,76(1):138-146.
[36]Juan Marcos A A,Purevdorj Nyam-Osor,Kayoko T,et al.The effect of starter cultures on proteolytic changes and amino acid content in fermented sausages[J].Food Chemistry,2010,119(1):279-285.
[37]郑培君,郑琳,齐明,等.从广式腊肠分离出的乳酸菌降解亚硝酸盐的影响因素研究[J].中国调味品,2015,40(6):18-23.
[38]张娜,万鎛壬,陈洪生,等.低胆固醇发酵香肠配方研究[J].农产品加工(上),2015(5):1-5.
[39]刘静,王德宝.复合发酵剂对羊肉干发酵香肠品质的影响[J].食品科技,2015(8):118-121.
[40]赵丽华,靳烨,马长伟,等.戊糖片球菌与复合发酵剂对羊肉干发酵香肠质地剖面分析(TPA)和色泽的影响[J].食品科技,2009(10):122-126.
[41]朱迎春,杜智慧,马俪珍,等.发酵剂对发酵香肠微生物及理化特性的影响[J].现代食品科技,2015(9):198-204.
[42]单吉祥,孟岳成.休闲发酵香肠贮藏期产品特性变化研究[J].肉类工业,2013(7):18-24.
[43]Fonseca S,Ouaba L I I,Franco I,et al.Use of molecular methods to charaterize the bacterial community and to monitor different native starter cultures throughout the ripening of Galician chorizo[J].Food Microbiology,2013,34(1):215-226.
[44]李兴武,章黎黎.胶原蛋白的改性研究及在食品工业中的应用[J].肉类研究,2009(11):80-84.
[45]王丹.胶原蛋白在食品工业中的应用[J].农产食品科技,2009,3(2):48-50.
[46]Fonseca S,Cachaldora A,Gómez M,et al.Monitoring the bacterial population dynamics during the ripening of Galician chorizo,a traditional dry fermented Spanish sausage[J].Food Microbiology,2013,33(1):77-84.
[47]张春晖.发酵肉制品加工技术[M].北京:中国农业出版社,2014.
[48]Dierings L R,Braga C M,Silva K M,et al.Population dynamics of mixed cultures of yeast and lactic acid bacteria in cider conditions[J].Brazilian Archives of Biology and Technology,2013,56(5):837-847.

