DCE-MRI评估索拉非尼抑制兔VX2肝种植瘤血管生成的实验研究
潘江洋, 时高峰, 王琦, 王丽佳, 张宁, 黄宁
近年来,抗肿瘤血管生成治疗成为研究的热点,血管内皮生长因子(vascular endothelial growth factor,VEGF)与受体结合后,能有效诱导血管内皮细胞增生,促进肿瘤血管的形成,并为侵袭周围组织和转移提供基础。索拉非尼是一种多激酶抑制剂,通过抑制Raf-MEK-ERK信号转导通路及细胞表面激酶受体,如内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)和血小板衍生因子受体(platelet-derived growth factor receptor,PDGFR)等,从分子水平阻断肿瘤新生血管的形成,是肝癌治疗的新选择[1]。抗血管生成治疗使肿瘤缺血坏死,在治疗早期肿瘤的大小变化往往不明显,缺乏有效的影像评估手段。MR动态增强扫描成像(dynamic contrast enhanced MRI,DCE-MRI)在提供常规MR图像的同时,还可提供肿瘤组织内部血流灌注信息,常用于肿瘤疗效的评估[2]。本研究以兔VX2肝种植瘤为实验模型,该模型肿瘤血供丰富,旨在探讨DCE-MRI定量参数评估索拉非尼抑制血管生成的能力。
材料与方法
1.兔VX2肝种植瘤模型制作
兔VX2瘤株购自东南大学实验动物中心。实验动物为健康新西兰大白兔45只,体重(3.2±0.5) kg/只,雌雄不限,普通级,均购自河北医科大学实验动物中心。新西兰大白兔由单个兔笼饲养,用卫生水及标准兔饲料喂养。术前禁食12 h,剥离荷瘤兔肿瘤,切取生长旺盛的鱼肉样组织,制成体积为1 mm3的瘤组织块备用,采用1%戊巴比妥钠(1.5 mL/kg)经兔耳缘静脉注射进行麻醉,麻醉成功后,开腹直视下将兔VX2肿瘤组织块种植于肝叶内,建立兔VX2肝种植瘤模型,术后7 d行MR常规扫描(包括T1WI和T2WI序列),肿瘤模型制备成功的标准为肝内肿瘤直径≥0.7 cm。45只新西兰兔中2只肝脏未见成瘤,5只在行MRI扫描前因麻醉意外死亡,2只在饲养过程中死亡,成功造模36只,造模成功率80%。选取瘤灶形状规则、大小基本一致的30只兔肝种植瘤模型进行后续实验,肿瘤平均直径为(1.09±0.11) cm。
2.实验分组及抗血管生成治疗实验
将筛选后的30只兔肝种植瘤模型,随机分为实验组(n=15)和对照组(n=15)。术后第8天开始,实验组每日使用索拉非尼(BAYER公司)进行灌胃治疗,剂量为30 mg/kg/d;对照组每日使用5%葡萄糖进行灌胃,剂量为30 mg/kg/d,共给药14 d。分别在治疗前、治疗后第7天、治疗后第14天(即术后第7、14、21天)行MRI常规扫描和DCE-MRI扫描。
3.检查方法
MRI扫描采用Siemens 3.0 Tim skyra 磁共振扫描仪,膝关节线圈。常规MRI扫描前,使用戊巴比妥钠对实验兔进行麻醉,剂量为1.5 mg/kg,麻醉满意后将实验兔仰卧于膝关节线圈内,为减少腹部呼吸运动使用腹带加压包扎,分别行T1WI、脂肪抑制T2WI及DCE-MRI扫描,扫描范围从膈顶至肾脏下极水平。T1WI扫描参数:TR 790 ms,TE 18 ms,层厚2.5 mm,层间距0.25 mm, 视野130 mm×130 mm,矩阵320×240。T2WI扫描参数:TR 4010 ms,TE 73 ms,层厚3 mm,层间距0.3 mm, 视野130 mm×130 mm。 DCE-MRI扫描对比剂为钆双胺注射液(Gd-DTPA-BMA,欧乃影) ,将Gd-DTPA-BMA 稀释在0.9%的生理盐水中配制成浓度为0.05 mmol/mL的注射液 ,按照0.30 mmol/kg的剂量进行注射,采用高压注射器经耳缘静脉注入,注射流率1 mL/s。DCE-MRI进行矢状面扫描,采用T1加权的容积式插入法屏气检查(volumetric interpolated breath-hold examination,VIBE)序列,时间分辨力约为2.1 s,扫描参数:TR 5.51 ms,TE 2.46 ms,层厚3.0 mm,层间距0.6 mm,视野274 mm×341 mm,翻转角12°,矩阵320×194,平扫使用5°、10°、12°、15°翻转角行T1WI扫描,对比剂注射后,使用12°翻转角扫描获得无中断的67期动态图像,扫描时间为144 s。
4.图像处理
将MR灌注图像调入GE Omni-Kinetics灌注软件。首先,对图像进行运动校准,以减少呼吸运动的影响,使用3D非刚性配准(free form deformation,FFD) 模式,将校准后的图像调入软件,并按以下步骤处理灌注数据:①AIF(动脉输入函数)勾画和拟合,在血管较清晰的情况下,勾画腹主动脉及肝门静脉的ROI,ROI的直径以不超过相应血管直径的2/3为宜。选择肝脏双输入模型,点击“curving”得到两个输入血管的时间-浓度曲线并进行拟合;②选择双室Tofts模型。选择病灶的最大层面,点击“Calculate”进行计算;③选择病灶图像最大层面的强化明显区域为ROI,每个病灶勾画3~4个ROI(ROI范围为60~90像素),勾画ROI时应避开肿瘤可见的坏死区、强化的血管等,点击“report”,得到ROI的血流动力学参数,包括转运常数(volume translate constant,Ktrans)、速率常数(reverse reflux rate constant,Kep)、血管外细胞外容积分数(extravascular extracellular volume fraction,Ve)和血浆容积分数(volume fraction of the plasma,VP)。为了减少误差,对每个病灶的ROI进行3次测定,计算平均值,作为最终结果并记录。
肝种植瘤最大径在T1WI增强扫描图像上进行测量,每个瘤灶均测量3次,取平均值并记录。
5.病理形态学观察及免疫组化分析
所有实验兔完成第3次(即治疗后第14天)DCE-MRI扫描后,通过空气栓塞处死。取肿瘤组织及瘤周正常组织进行蜡块包埋、切片(切片层面与成像层面保持一致,均为矢状位),行HE染色及VEGF、CD34(MVD)免疫组化指标检查,选择病灶最大层面进行分析。
VEGF及CD34免疫组织参照weidner等[3]的判断标准:肿瘤内的孤立内皮细胞或内皮细胞簇被染成棕黄色的,并且与邻近微血管或其他结缔组织分开的认为是一个微血管。高倍镜(×200)观察,选择5个染色明显的视野,并记录每个视野下微血管数目,计算其平均数,得到微血管密度(microvessel density,MVD)值。
VEGF染色结果:阳性细胞定义为胞浆内含有棕黄色或棕褐色颗粒的肿瘤细胞。低倍镜下(×100 )选择棕褐色染色区域,高倍镜下(×400 )选取4个染色明显的视野,间质染色不计入其内,计算每个视野内阳性细胞的数目及占视野内所有细胞数目的百分比,计算平均值并记录。
病理切片HE染色及免疫组化的结果由病理科医生在双盲情况下按统一标准进行观察并记录。
6.统计学分析
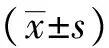
结果
实验组与对照组治疗前的基线数据差异无统计学意义(P>0.05)。治疗后,实验组与对照组之间DCE-MRI参数Ktrans、Kep值差异有统计学意义(F=20.882,P=0.001;F=5.031,P=0.049,图1~4),且Ktrans值在两组间不同观察时间点的变化趋势不同,差异有统计学意义(F=50.062,P<0.01 ,图5,表1),Kep值在两组间不同观察时间点的变化趋势差异无统计学意义(F=0.181,P=0.836,表2 )。实验组与对照组的Ve、Vp值差异无统计学意义(F=0.327,P=0.272;F=0.236,P=0.638),且Ve、Vp值在两组间不同观察时间点的变化趋势差异亦无统计学意义(F=0.088,P=0.916;F=0.127,P=0.881)。

表1 两组肝种植瘤治疗前后不同时间点的Ktrans值测量结果
注:a不满足协方差矩阵球对称条件,进行H-F校正,校正系数为0.759;b实验组与对照组间Ktrans值差异有统计学意义;cKtrans值在两组间不同观察时间点的变化趋势是不同的,差异有统计学意义。

表2 两组肝种植瘤治疗前后不同时间点的Kep值测量结果
注:a满足协方差矩阵球对称条件;b实验组与对照组间Kep值差异有统计学意义;cKep值在两组间不同观察时间点的变化趋势差异无统计学意义。
实验组治疗7天后肿瘤直径增大(0.23±0.06) cm,治疗14天后肿瘤直径增大(0.43±0.21) cm;对照组治疗7天后肿瘤直径增大(0.31±0.09) cm,治疗14天后肿瘤直径增大(1.48±0.56) cm。治疗7天后,两组间肿瘤直径增大值差异无统计学意义(P>0.05);治疗14天后,两组间肿瘤直径增大值差异有统计学意义(P<0.05)。
索拉非尼组的CD34染色结果显示肝种植瘤内散在的血管内皮细胞呈棕黄色,主要位于肿瘤的边缘(图6、7),免疫组化分析显示两组间MVD、VEGF差异有统计学意义(P<0.05)。相关性分析显示Ktrans与MVD、VEGF之间呈正相关(r值分别为0.792和0.651)。其他定量参数Kep、Ve、 Vp与MVD、VEGF均无显著相关性(表3、4)。

图1 实验组兔行DCE-MRI扫描获得VX2肝种植瘤的Ktrans伪彩图。a) 治疗前,肿瘤呈高血流灌注(红色区域),Ktrans均值为(0.33±0.11)/min; b) 索拉非尼治疗7天后,肿瘤内出现部分低血流灌注区(蓝色区域),Ktrans均值为(0.23±0.06)/min; c) 索拉非尼治疗14d后,肿瘤稍增大,内部呈低血流灌注(蓝色区域),Ktrans均值为(0.13±0.02)/min。 图2 实验组兔行DCE-MRI扫描获得VX2肝种植瘤的Kep伪彩图。a) 治疗前,肿瘤呈高血流灌注(红色区域),Kep均值为(2.43±1.20)/min; b) 索拉非尼治疗7天后,肿瘤内出现少量低血流灌注区(蓝色区域),Kep均值为(1.76±0.87)/min; c) 索拉非尼治疗14d后,肿瘤稍增大,内部有部分低血流灌注区(蓝色区域),Kep均值为(1.09±0.68)/min。

参数r值P值Ktrans0.7920.002Kep-0.160.96Ve0.0310.924Vp-0.0390.904

表4 DCE-MRI参数与VEGF之间的相关性
讨 论
根据实体瘤疗效评价标准(如RECIST1.1标准)及改良的mRECIST标准[4,5],其评价结果可分为完全缓解、部分缓解、进展及稳定,但单纯的形态学评价标准可能不能及时、准确地反映肿瘤对药物治疗的敏感性,而血流量、转移常数等功能学参数关注肿瘤内部的血流灌注信息,在肿瘤大小改变之前即可出现变化。DCE-MRI从微血管水平对组织器官的微循环功能状态进行观测、评价[6],并且避免了CT灌注扫描过高的辐射剂量[7],其应用的数学模型更贴近真实的微环境,可提供更多的微循环信息,为肿瘤分子靶向治疗疗效评估提供了新的途径。本研究将RECIST1.1标准作为评估靶向治疗的标准,索拉非尼治疗7天后,实验组肿瘤最大径与对照组变化差异无统计学意义,治疗14天后,两组间肿瘤直径增大值差异有统计学意义,证明了索拉非尼治疗有效。实验组与对照组之间Ktrans、Kep值差异有统计学意义,且Ktrans值在两组间不同观察时间点的变化趋势是不同的,在索拉非尼治疗7天后,两组间Ktrans值的差异即有统计学意义,说明DCE-MRI定量参数能评价分子靶向药物抗血管生成治疗的早期疗效。

图3 对照组兔行DCE-MRI扫描获得VX2肝种植瘤的Krans伪彩图。a) 治疗前,肿瘤以高血流灌注为主(红或黄色区域),Ktrans均值为(0.35±0.09)/min; b) 安慰剂治疗7天后,肿瘤增大,Ktrans均值为(0.37±0.06)/min; c) 安慰剂治疗14d后,肿瘤明显增大, Ktrans均值为(0.41±0.08)/min。 图4 对照组兔行DCE-MRI扫描获得VX2肝种植瘤的Kep伪彩图。a) 治疗前,肿瘤呈高血流灌注(红色区域),Kep均值为(3.12±2.13)/min; b) 安慰剂治疗7天后,肿瘤稍增大,Kep均值为(2.75±0.72)/min; c) 安慰剂治疗14d后,肿瘤明显增大,Kep均值为(1.47±0.69)/min。
龚威等[8]学者应用DCE-MRI评价恩度对兔VX2骨肿瘤抗血管生成的疗效,14 d后治疗组Ktrans值明显下降, 且Ktrans值与VEGF表达、MVD值均呈正相关关系,与本研究结果一致。杨蕊梦等[9]应用血管阻断剂M410治疗兔VX2种植性肝癌,治疗后4 h行DCE-MRI检查,治疗组Ktrans值即开始下降。丁爽等[10]使用安维汀治疗结肠癌(裸鼠皮下移植瘤模型),治疗后24、48 h行DCE-MRI检查,两组间Kep值差异亦有统计学意义,且与免疫组织化学结果呈正相关,与本研究结果不一致。Wang等[11]研究认为,Ktrans值主要由血流灌注和毛细血管通透性决定。肝种植瘤经索拉非尼治疗后,肿瘤MVD减低,血流量减少,同时毛细血管通透性下降,使两组间Ktrans值的差别更明显。Kep值不仅受血流灌注量、血管通透面积等因素的影响,血管外细胞外组织间隙内流体静水压等其他因素的影响亦不能忽略,故两组间Kep值的变化不如Ktrans值明显。在本研究中,选用双室Tofts血流动力学模型进行分析[12],治疗前后实验组及对照组间Ve、Vp值差异无统计学意义,笔者认为Ve、Vp评价索拉非尼抑制兔VX2肝种植瘤模型的价值尚不能肯定,有待于进一步研究。
在本研究中,我们使用双输入双室Tofts模型,以往的报道中,受限于当时的分析软件,常常只对肝动脉进行计算,忽视了门静脉供血,本研究选择兔肝动脉及门静脉作为输入血管,进行拟合计算,这更符合肝脏肿瘤双重血供的特点,计算更加准确。双室模型分别指兔VX2肝种植瘤微血管及血管外细胞外间隙,该模型将钆离子对比剂在动脉内的分布差异考虑在内,所获得的定量参数不仅可以反映单室模型所关注的血流量,而且可反映对比剂从血管内渗透到血管外细胞外间隙的相关指标,如血管的通透性等。与正常兔肝组织相比,肝种植瘤的Ktrans、Kep值较高,这与肿瘤新生血管成熟度较差、局部血流速度更快、内皮细胞间隙增大、血管表面渗透性增高的病理基础相匹配[13]。

图5 实验组和对照组肝种植瘤分别于治疗前、治疗后7天、治疗后14天测量的Ktrans值变化趋势图。实验组Ktrans值持续下降;对照组Ktrans值治疗后持续升高。两组治疗前后Ktrans值的变化趋势不同,差异有统计学意义(P<0.05)。

图6 免疫组化MVD结果(×200)。a) 实验组微血管密度较低; b) 对照组微血管密度较高。 图7 免疫组化VEGF结果(×400)。a) 实验组VEGF呈低表达; b) 对照组VEGF呈高表达。
镜下观察CD34和VEGF免疫组织化学染色多聚集在肝种植瘤及周边,经索拉非尼治疗后,实验组肿瘤组织血管生成受到抑制,VEGF及MVD数量减少,与对照组差异有统计学意义,说明索拉非尼可以有效抑制兔VX2肝癌新生血管的生成。Ktrans与MVD、VEGF值具有较好的相关性(r=0.792,r=0.651)。Wang等[14]对比了DCE-MRI参数与VEGF、MVD、P53蛋白等参数,证实DCE-MRI可以评估肝癌新生血管及其状态。Wedam等[15]为了评估bevacizumab(VEGFR受体的单克隆抗体)治疗乳腺浸润性癌的疗效,行DCE-MRI检查并进行分析,结果显示Ktrans、Kep值下降,并与VEGF受体表达呈正相关。
本研究存在以下局限性:①样本量较小,可能导致部分研究结果差异无统计学意义;②定量参数测量数据量大,测量繁琐;③DCE-MRI扫描技术仍存在局限性,首先是扫描协议的不同,不同MRI扫描仪使用的扫描序列不同,会影响获得的定量参数的准确性;④不同实验选择的血流动力学模型也不相同,得到的结果可能存在差异。
[1] Abou-Alfa GK,Schwartz L,Ricci S,et al.Phase Ⅱ study of sorafenib in patients with advanced hepatocellular carcinoma[J].Clin Oncol,2006,24(26):4293-4300.
[2] 史红媛,田迎,罗松,等.动态增强MRI扩散加权成像及光学成像联合监测抗血管生成治疗后肿瘤反应的动物实验研究[J].中华放射学杂志,2012,46(3):269-274.
[3] Weidner N.Tumour vascularity and proliferation:clear evidence of close relationship[J].Pathol,1999,189(3):297-299.
[4] Zhao JJ,Yan T,Zhao H,et al.Evaluation of eight different clinical staging systems associated with overall survival of chinese patients with hepatocellular carcinoma[J].Chin Med J (Engl),2015,128(3):316-321.
[5] Kim SH,Kamaya A,Willmann JK.CT perfusion of the liver:principles and applications in oncology[J].Radiology,2014,272(2):322-344.
[6] Thng CH,Koh TS,Collins D,et al.Perfusion imaging in liver MRI[J].Magn Reson Imaging Clin N Am,2014,22(3):417-432.
[7] Thukral A,Thomasson DM,Chow CK,et al.Inflammatory breast cancer:dynamic contast-enhanced MR in patients receiving bevacizumab——initial experience[J].Radiology,2007,244(3):727-735.
[8] 龚威,查云飞,闫力永,等.DCE-MRI评估Endostar对兔VX2骨肿瘤模型抗血管生成的疗效[J].放射学实践,2015,30(4):313-318.
[9] 杨蕊梦,邹永,罗良平,等.动态增强MRI定量监测血管阻断剂治疗兔VX2种植性肝癌的效果[J].中国医学影像技术,2013,29(11) :1786-1790.
[10] 丁爽,许永华,贾文霄,等.DCE-MRI各定量参数评价抗肿瘤血管药物早期疗效的应用价值[J].临床放射学杂志,2014,35(5):779-783.
[11] Wang HJ,Li JJ,Chen F,et al.Morphological,functional and metabolic imaging biomarkers: assessment of vascular-disrupting effect on rodent liver tumours[J].Eur Radiol,2010,20(8):2013-2026.
[12] Sourbron S,Sommer WH,Reiser MF,et al.Combined quantification of liver perfusion and function with dynamic gadoxetic acid-enhanced MR imaging[J].Radiology,2012,263(3):874-883.
[13] Jiang HJ,Lu HB,Zhang ZR,et al.Experimental study on angiogenesis in a rabbit VX2 early liver tumour by perfusion computed tomography[J].J Int Med Res,2010,38(3):929-939.
[14] Wang B,Gao ZQ,Yan X.Correlative study of angiogenesis and dynamic contrast-enhanced magnetic resonance imaging features of hepatocellular carcinoma[J].Acta Radiol,2005,46(4):353-358.
[15] Wedam SB,Low JA,Yang SX,et al.Antiangiogenic and antitumor effects of bevacizumab in patients with in flammatory and locally advanced breast cancer[J].J Clin Oncol,2006,24(5):769-777.

