产D-乳酸的德氏乳杆菌保加利亚亚种发酵工艺研究
韩文静,梁颖超,陶 进,张广昊
(玉米深加工国家工程研究中心,吉林长春 130033)
乳酸又称丙醇酸,是自然界最小的手性分子,具有L(+)和D(-)2种光学构型[1-3]。D-乳酸作为手性中心,是合成多种手性物质的前体,在医药、农药、化工等方面应用十分广泛。2000年以后,世界乳酸总生产能力已超过25万t/a,总产量为13万t/a,并每年递增[4]。D-乳酸的年生产量约1.6万t,而发酵法生产D-乳酸的需求量约2.6万t[5],所以D-乳酸的研究拥有广阔的市场前景。例如德国巴斯夫公司生产的S-2-氯丙酸除草剂、日本达意赛尔生产的对乙基苯氧丙酸除草剂、德国赫斯特公司生产的威霸除草剂[4]等。此外,D-乳酸还可用于聚乳酸的生产,根据生产的聚乳酸的性质,可以应用于各类食品和化妆品的外包装材料,在服装方面也有很好的应用前景,可以做成纱、编织物等。
世界乳酸产量的90%是通过发酵法生产的,其余是化学合成的。国际上的D-乳酸生产也主要采用微生物发酵法[6]。我国的D-乳酸生产量远远不能满足工业需要,生产技术相对落后,尤其对D-乳酸生产菌研究相对落后[7]。因此,对D-乳酸产生菌研究是非常重要的。关于研究发酵法产D-乳酸的工作有一些报道,王刚等[8]对假肠膜明串珠菌进行研究,得出该菌的最适生长温度为35 ℃,最适pH为6.5,4%初始葡萄糖浓度,6%的接种量,35 ℃有助于发酵产酸,35 ℃耗糖速度最快。刘海燕等[9]以麦芽汁为培养基发酵德氏乳杆菌RFXI,通过优化培养基,使RFXI的活菌数比优化前提高了4.6倍。刘联杰[10]对诱变后的菊糖芽孢乳杆菌进行研究,得到发酵培养基为:葡萄糖152.90 g/L,蛋白胨18.25 g/L,牛肉膏10.00 g/L,酵母抽提物6.25 g/L,磷酸氢二钾3.00 g/L,乙酸钠3.00 g/L,七水硫酸镁0.10 g/L。许婷婷等[11]对诱变后的乳杆菌进行研究,得到该菌株在只含葡萄糖及无机盐的培养基中对糖的总转化率接近理论最大值,达到98%,D-乳酸产量达到48.5 g/L,光学纯度在99%以上。于培星[12]以凝结芽孢杆菌JD-063D为出发菌株,通过诱变后筛选出一株JD-76D,产酸由出发菌株的61 g/L提高到145 g/L,D-乳酸纯度由原菌株的97.5%增加到98.7%以上。目前鲜见关于德氏乳杆菌保加利亚亚种生长的研究报道。笔者分析了德氏乳杆菌保加利亚亚种在不同条件下的生长情况,从而筛选出适合其生长的环境,为德氏乳杆菌保加利亚亚种产D-乳酸条件摸索及生产应用提供参考。
1 材料与方法
1.1材料
1.1.1菌种。德氏乳杆菌保加利亚亚种,由吉林农业大学提供,玉米深加工国家工程研究中心活化保藏。
1.1.2培养基。平板培养基:蛋白胨1.000%,牛肉粉0.800%,酵母粉0.400%,葡萄糖2.000%,磷酸氢二钾0.200%,柠檬酸氢二铵0.200%,乙酸钠0.500%,硫酸镁0.020%,硫酸锰0.004%,琼脂1.400%,吐温-80 0.100%,118 ℃灭菌15 min,pH 6.3~6.7。种子培养基(MRS肉汤培养基):蛋白胨1.000%,牛肉粉0.800%,酵母粉0.400%,葡萄糖2.000%,磷酸氢二钾0.200%,柠檬酸氢二铵0.200%,乙酸钠0.500%,硫酸镁0.020%,硫酸锰0.004%,吐温-80 0.100%,118 ℃灭菌15 min,pH 5.5~5.9。 发酵培养基:蛋白胨1.000%,牛肉粉0.800%,酵母粉0.400%,葡萄糖7.000%,磷酸氢二钾0.200%,柠檬酸氢二铵0.200%,乙酸钠0.500%,硫酸镁0.020%,硫酸锰0.004%,吐温-80 0.100%,发酵前一次性加入碳酸钙5.000%,118 ℃灭菌15 min,pH 6.4~6.7。
1.2方法
1.2.1产酸量检测。采用EDTA定钙法,按照文献[13-14]方法进行。
1.2.2不同葡萄糖添加量对产酸量的影响。葡萄糖添加量为2%、3%、4%、5%、6%、7%、8%、9%,通过EDTA定钙法测定不同葡萄糖浓度的发酵液中产酸量。
1.2.3不同初始pH对菌体生长的影响。菌种分别接种在pH 5.5、6.0、6.5、7.0、7.5的发酵培养基中,接种量为10%。采用分光光度法在600 nm波长下测定OD值。
1.2.4不同温度对产酸量的影响。培养温度是细菌生长的一个重要因素,它可以通过改变脂肪酸的组成影响细胞膜和细胞壁结构的组成及其完整[15]。根据文献记载,德氏乳杆菌保加利亚亚种生长温度为37~45 ℃,当温度高于50 ℃或低于20 ℃时菌体不能生长[16]。在其他发酵条件为最佳状态下,选择生长温度分别为36、38、40、42、44、46 ℃,采用EDTA法测定上述温度下的产酸量。
1.2.5不同接种量对产酸量的影响。接种量大小影响菌体生长速度。过小,会延长菌种生长的迟缓期,发酵周期变长;过大,会使菌体生长过剩,菌体利用营养物质自身生长,不利于产酸。在最佳发酵温度、pH、装液量条件下,接种量分别为6%、8%、10%和12%,测定产酸量,确定最佳接种量。
1.2.6不同装液量对产酸量的影响。装液量的多少影响发酵培养基中溶氧值的大小,该试验使用的菌种是兼性厌氧型,溶氧值的大小直接影响产酸量。在其他发酵条件为最佳状态下,装液量分别为50、75、100、125、150 mL,测定不同装液量下的产酸量。
1.2.7发酵周期对产酸量的影响。发酵周期过短,菌体的生长不稳定,培养基中的营养物质主要提供给菌体生长,用于产物积累较少;而发酵周期过长,营养物质耗尽和代谢产物的大量积累使菌体自溶,因此发酵周期对菌体的产酸量有很大的影响。在其他发酵条件最佳状态下,在发酵周期24、32、40、48、56、64、72、78 h的条件下,测定产酸量。
2 结果与分析
2.1不同葡萄糖添加量对D-乳酸产酸量的影响由图1可知,随着葡萄糖添加量的增加,产酸量也有明显的增加,当葡萄糖添加量达7%时,产酸量最高;但随葡萄糖添加量继续增加,产酸量反而降低。故选择7%为葡萄糖最佳添加量。
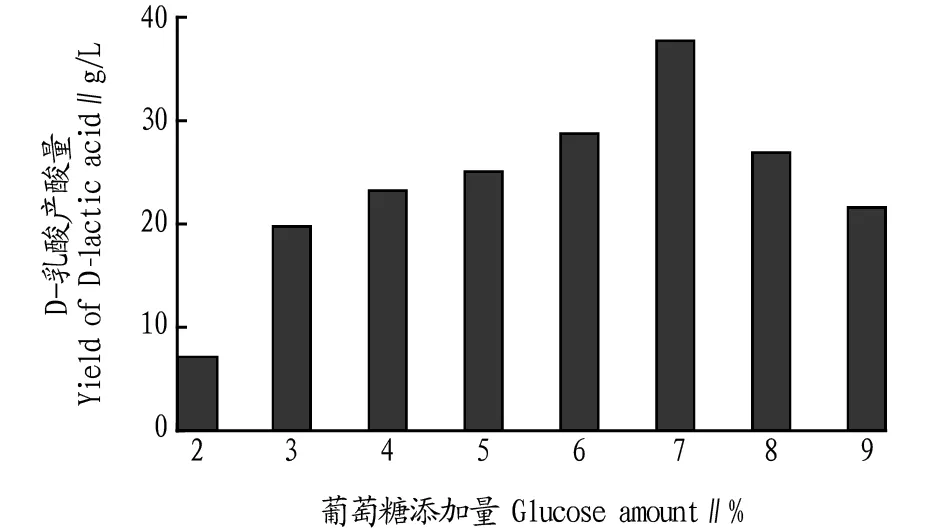
图1 不同葡萄糖添加量对D-乳酸产酸量的影响Fig.1 Effect of different glucose additions on D-lactic acid production
2.2不同初始pH对菌体生长的影响由图2可知,当初始pH为6.5时,菌体生长状态最佳,故发酵初始pH确定为6.5。
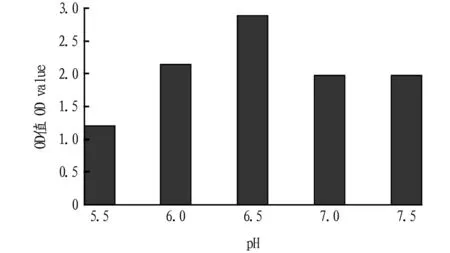
图2 不同初始pH对菌体生长的影响Fig.2 Effect of different initial pH on cell growth
2.3不同温度对D-乳酸产酸量的影响由图3可知,随着温度的升高,菌体产酸量增加,当温度达到42 ℃时产酸量最高,随着温度的不断增加,菌体产酸量开始降低,温度影响细胞内酶活变化,温度升高,细胞内酶促反应加快,代谢和生长也相应加快;但当温度过高时,生物活性物质发生变性,细胞功能下降甚至死亡。故选择42 ℃为最佳生长温度。
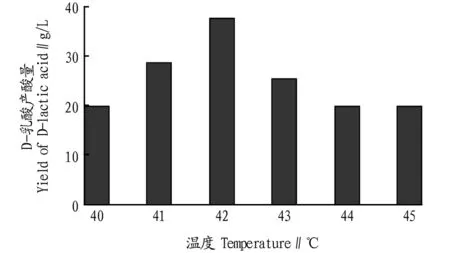
图3 不同温度对D-乳酸产酸量的影响Fig.3 Effect of different temperature on D-lactic acid production
2.4不同接种量对D-乳酸产酸量的影响由图4可知,随着接种量的增加,产酸量也不断增加,当接种量为10%时,产酸量最大,而接种量继续增加时,产酸量反而下降,可能接种量过大,培养基中的营养成分主要用于菌株的生长,从而造成了产酸量的降低。故以接种量10%为最佳值。

图4 不同接种量对D-乳酸产酸量的影响Fig.4 Effect of different inoculum size on D-lactic acid production
2.5不同装液量对D-乳酸产酸量的影响由图5可知,125 mL为最佳装液量。
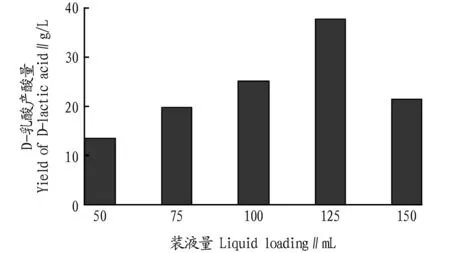
图5 不同装液量对D-乳酸产酸量的影响Fig.5 Effect of different liquid loading on D-lactic acid production
2.6不同发酵周期对D-乳酸产酸量的影响由图6可知,在72 h内,D-乳酸的产酸量随着时间的增长而增加,而在72 h以后,D-乳酸的产酸量开始减少,故确定72 h为最佳发酵周期。
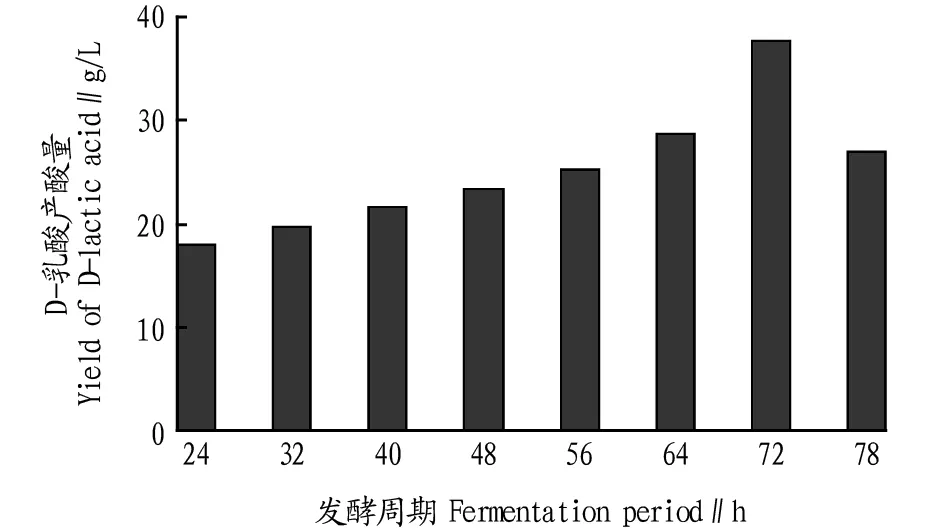
图6 发酵周期对D-乳酸产酸量的影响Fig.6 Effect of fermentation period on D-lactic acid production
3 结论
通过试验得到产D-乳酸的德氏乳杆菌保加利亚亚种发酵工艺条件为葡萄糖添加量7%,生长温度42 ℃,发酵周期72 h,初始pH 6.5,接种量10%,装液量125 mL/250 mL,此时产酸量最高,为37.8 g/L。
[1] CORMA A,IBORRA S,VELTY A.Chemical routes for the transformation of biomass into chemicals [J].Chen Rev,2007,107(6):2411-2502.
[2] 李媛,徐书景,张庆,等.采用钠盐调酸发酵生产D-乳酸的工艺研究[J].河北师范大学学报(自然科学版),2014,38(3):297-300.
[3] 刘联杰,周安盛,方聪明,等.产D-乳酸菊糖芽孢乳杆菌的诱变及发酵条件研究[J].湖北农业科学,2014,53(20):4936-4940.
[4] 崔小明.乳酸的生产应用及市场前景[J].四川化工与腐蚀控制,2002,5(2):37-41.
[5] 吕九琢,徐亚贤.乳酸应用、生产及需求的现状与预测[J].北京石油化工学院学报,2004,12(2):32-36.
[6] 周丽,田康明,陈献忠,等.微生物发酵产光学纯度D-乳酸研究进展[J].中国生物工程杂志,2010,30(10):114-124.
[7] 刘娟,王刚,张明磊,等.D-乳酸产生菌的研究进展[J].微生物学杂志,2016,36(1):96-99.
[8] 王刚,刘娟,陈光,等.产D-乳酸假肠膜明串珠菌生长特性分析[J].湖北农业科技,2016,55(5):1239-1241.
[9] 刘海燕,李应彪,徐幸莲,等.德氏乳杆菌增殖培养基的优化研究[J].现代食品科技,2008,24(11):1160-1163.
[10] 刘联杰.产D-乳酸菌株的选育及发酵过程优化[D].武汉:湖北工业大学,2014.
[11] 许婷婷,柏中中,何冰芳.D-乳酸研究制备进展[J].化工进展,2009,28(6):991-996.
[12] 于培星.高产D-乳酸生产菌株的选育[J].中国食品添加剂,2010(4):796-800.
[13] 郑志,姜绍通,潘丽军.EDTA定钙法测定发酵液中乳酸含量的探讨[J].食品科学,2003,24(3):102-105.
[14] 金其荣,张继民,徐勤.有机酸发酵工艺学[M].北京:中国轻工业出版社,1997:402-404.
[15] 李银镝.D-乳酸高产菌株的选育、发酵条件的优化及代谢通量分析[D].天津:天津大学,2007.
[16] 王伟.德氏乳杆菌发酵性能研究及发酵工艺优化[D].哈尔滨:东北农业大学,2012.

