溪黄草对肝癌HepG2细胞基因表达谱的影响
罗 莹,廖长秀,贺 珊,赖 术,黎为能
(1.右江民族医学院机能实验教学中心,广西百色 533000;2.右江民族医学院药理学教研室,广西百色 533000;3.右江流域特色民族药研究重点实验室,广西百色 533000)
原发性肝癌是世界上最常见的恶性肿瘤之一,每年新发病例超过50万人,且其发病率仍不断增长。中药在控制肝癌病情发展、改善症状体征及提高生存质量等方面具有独特的优势。中药溪黄草为民间常用草药,主要用于治疗急性黄疸型肝炎、急性胆囊炎、湿热痢疾、肠炎、跌打瘀肿和养生保健等。现代药理学研究溪黄草具有护肝利胆和抗肿瘤作用,作为多种抗肝癌复方组分用于肝癌的治疗,也有研究报道溪黄草单方对肝癌细胞增殖有抑制作用,但其具体机制尚不清楚[1-2]。本文利用表达谱芯片技术,从系统药理学角度研究溪黄草水提取物对人肝癌细胞HepG2相关基因的影响,以探讨溪黄草抗肝癌的可能机制。
1 材料与方法
1.1材料 人肝癌HepG2购于中国科学院上海细胞生物研究所,胎牛血清、DMEM高糖培养基购自美国Gibco公司,溪黄草购自广西中医药大学附属医院,由右江民族医学院覃道光副教授鉴定为溪黄草全株,Trizol为美国Invitrogen公司产品,总RNA提取试剂盒为美国Zymo Research公司产品、FastQuant RT Kit(With gDNase)、SuperReal荧光定量预混试剂增强版(SYBR Green)购自天根生化科技(北京)有限公司,引物由生工生物工程(上海)股份有限公司合成,DUSP1兔单克隆抗体购于英国Abcam公司,GAPDH鼠单克隆抗体、辣根(HRP)标记羊抗兔IgG抗体、辣根(HRP)标记羊抗鼠IgG抗体为中杉金桥公司产品,其他Western blot电泳和转膜及封闭试剂购于碧云天生物技术公司。

表1 DUSP1、IGFBP1、FXR和ALDH8A1引物
1.2方法
1.2.1溪黄草水提取物的制备 取溪黄草全株适量,加10倍量的水,煎煮2次,每次1 h,合并滤液,浓缩,经冷冻干燥机制备成溪黄草水提取物冻干粉,-20 ℃密闭保存。临用前用PBS溶解,高压蒸汽灭菌,0.25 μm无菌滤器过滤后用完全培养基稀释20倍(经MTT实验证实含该浓度的PBS对细胞生长无明显影响),配制成终浓度为9.54 mg/mL的溪黄草水提取物。
1.2.2细胞培养及处理 HepG2细胞含10%胎牛血清的DMEM培养基中培养,置于37 ℃、含5% CO2的培养箱中培养,细胞密度为80%~90%时可进行传代,2~3 d传代1次。取对数生长期细胞,胰酶消化成单细胞悬液,调整至合适的细胞密度,分别接种至25 cm2培养瓶和6孔板,实验分为2组:溪黄草水提取物组和阴性对照组(加含等量PBS的完全培养基)。细胞接种24 h后实验组分别加入溪黄草水提取物终浓度是9.54 mg/mL的完全培养基,对照组加等量培养基,作用24 h后,25 cm2培养瓶加入1 mL Trizol,送至上海卓立生物科技有限公司进行表达谱芯片检测。6孔板细胞用总RNA提取试剂盒提取RNA。
1.2.3表达谱芯片研究 由上海卓立生物科技有限公司经RNA提取、质量鉴定合格后,与HOA 7.1版本的芯片进行杂交,Cy5标记aRNA,杂交程序为OneArray Plus,Agilent 0.1 XDR 程序扫描,分析28 266个基因的变化。
1.2.4RT-PCR验证表达芯片的结果 6孔板细胞(每组重复3个复孔)提取细胞总RNA,用紫外分光光度法检测总RNA纯度和浓度,取1 μg RNA按试剂盒说明进行反转录,取合成的cDNA进行实时荧光定量PCR,引物由Primer Premier 5.0软件设计,引物序列、产物大小见表1。反应体系按试剂盒说明,GAPDH、DUSP1和IGFBP1反应条件为:预变性95 ℃ 15 min;变性95 ℃ 10 s,退火/延伸60 ℃ 20 s,共40个循环(Roche Lightcycler96荧光定量PCR仪扩增);ALDH8A1和FXR反应条件为:预变性95 ℃ 15 min;变性95 ℃ 10 s,退火60 ℃ 20 s,延伸72 ℃ 20 s,共40个循环(Bio-rad IQ5荧光定量PCR仪扩增),结果分析采用2-△△Ct法分析。
1.2.5Western blot验证表达芯片的结果 6孔板细胞(每组重复3个复孔)提取细胞总蛋白,用BCA法检测总蛋白浓度,取15 μg 蛋白与6×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上样缓冲液按5∶1比例混匀煮沸变性5 min,SDS-PAGE电泳,湿法转膜,5% BSA封闭2 h,一抗4 ℃孵育过夜、洗膜,二抗室温孵育2 h、洗膜,化学发光法显色,胶片曝光适当时间,经显影、定影后,扫描后用Image J软件读取各组条带灰度值。

2 结 果
2.1相差显微镜观察溪黄草水提取物对HepG2细胞的影响 相差显微镜下观察,溪黄草水提取物9.54 mg/mL处理24 h后,细胞形态皱缩,细胞数量明显减少,见图1。

A:阴性对照组;B:溪黄草水提取物组(9.54 mg/mL)
图1相差显微镜观察溪黄草水提取物对HepG2细胞的影响(×400)
2.2表达谱芯片观察溪黄草水提取物对HepG2基因的影响 溪黄草水提取物(9.54 mg/mL)作用24 h后264个基因上升2倍以上,194个基因下降2倍以上。其中增加和下降至对照组5倍以上的基因见表2。
2.3表达谱芯片分析溪黄草水提取物对HepG2功能的影响 基因本体(GO)分析发现溪黄草主要影响24个HepG2分子功能、167个生物进程通路和9个细胞组成。溪黄草处理后主要的GO分析变化的通路见表3。KEGG分析溪黄草主要影响7个HepG2信号通路,见表4。
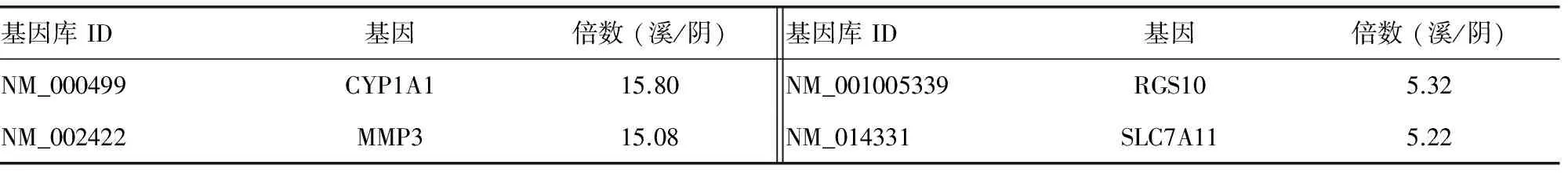
表2 溪黄草水提取物(9.54 mg/mL)处理肝癌HepG2细胞24 h后变化达5倍以上的基因

续表2 溪黄草水提取物(9.54 mg/mL)处理肝癌HepG2细胞24 h后变化达5倍以上的基因

表3 溪黄草水提取物影响HepG2的表达谱芯片GO分析结果

表4 KEGG分析溪黄草改变HepG2的信号通路
2.4RT-PCR验证部分芯片结果 将溪黄草水提取物处理的HepG2提取总RNA,实时定量PCR检测DUSP1、IGFBP1、ALDH8A1和FXR(NR1H4)表达发现,与阴性对照组相比,溪黄草水提取物处理后可明显增加DUSP1和IGFBP1的mRNA表达,降低ALDH8A1和FXR的mRNA表达,差异有统计学意义(P<0.01),与芯片结果基本一致。
2.5Western blot验证部分芯片结果 将溪黄草水提取物处理的HepG2提取总蛋白,Western blot检测DUSP1蛋白表达发现,与阴性对照组相比(蛋白条带灰度值DUSP1/GAPDH为1.15±0.19),溪黄草水提取物处理后(蛋白条带灰度值DUSP1/GAPDH为2.87±0.35)可明显增加DUSP1蛋白表达,差异有统计学意义(P<0.01),见图2,与芯片结果一致(溪黄草水提取物处理后DUSP1 mRNA表达增加为阴性对照组的2.18倍)。

表5 溪黄草水提取物对HepG2中DUSP1、IGFBP1、FXR和ALDH8A1 mRNA表达的影响
*:P<0.01,与阴性对照组比较;芯片结果中倍数值是指溪黄草水提取组/阴性对照组

图2 Western blot检测溪黄草水提取物对HepG2细胞DUSP1蛋白表达的影响
3 讨 论
中药治疗疾病具有多组分、多靶点的特点。本研究采用表达谱芯片技术研究了治疗肝病的经典中药溪黄草对肝癌HepG2细胞的影响,发现溪黄草水提取物可改变肝癌HepG2细胞458个基因的表达,并影响多个分子功能、生物进程、细胞组分和相关的信号通路。
本研究发现溪黄草水提取物处理后促进细胞增殖的细胞周期蛋白D(cyclin D1,CCND1)、细胞周期蛋白E(cyclin E1,CCNE1)、S期激酶相关蛋白2(S-phase kinase-associated protein 2,SKPZ2)[3]及起始识别复合物1(origin recognition complex subunit 1,ORC1)[4]均明显降低,而抑制细胞增殖的细胞周期依赖性激酶抑制因子CDKN1A(cyclin-dependent kinase inhibitor 1A,p21)及CDKN2B(cyclin-dependent kinase inhibitor 2B,p15)则明显升高,表明溪黄草可通过多种调控细胞周期的基因和蛋白抑制细胞增殖。
微小染色体维持蛋白(minichromosome maintenance proteins,MCM)是真核细胞DNA复制准许因子中的一个重要成员,可启动和参与DNA复制,对细胞DNA复制和周期具有调控作用[5]。其家族主要有MCM2~MCM7,已有研究表明MCM2、MCM3、MCM6、MCM7等在肝癌组织或肝癌细胞中异常表达,RNA干扰降低MCM7的表达可使肝癌细胞增殖减少、凋亡增多,细胞周期S期缩短,裸鼠移植瘤生长减慢[6-9]。本研究发现溪黄草水提取物处理的肝癌HepG2细胞MCM2、MCM3、MCM4、MCM5、MCM7均表达明显降低,分别降至阴性对照组的0.35、0.32、0.41、0.39和0.40倍,提示溪黄草可能通过抑制MCM家族表达,进一步抑制肝癌细胞增殖及使其更多处于静止期,并促进其凋亡。
本研究结果发现溪黄草水提取物处理HepG2细胞胰岛素样生长因子结合蛋白超家族(insulin-like growth factor binding protein superfamily,IGFBPs)中IGFBP1、IGFBP3、IGFBP4、IGFBP6、IGFBP7、CYR61均明显增加,分别增加至对照组的6.40、8.84、2.06、2.80、2.02和3.09倍,其中IGFBP1 mRNA表达已通过RT-PCR验证与芯片结果一致。已知胰岛素样生长因子(insulin-like growth factor,IGF)与胰岛素结构相似,是具有促进物质代谢、降低血糖、促进细胞分裂等多种功能的细胞增殖调控因子。IGFBPs可与其结合,结合后IGF作用减弱[10]。有研究报道IGFBP1和IGFBP3在肝癌组织或肝癌患者血清均低于正常水平,其与肝癌的预后呈正相关[11-12]。也有研究报道IGFBP3可通过非IGF途径抑制肿瘤细胞增殖,促进其凋亡[13],提示IGFBPs可能参与肝癌的发生、发展及预后。本研究结果表明溪黄草能提高部分IGFBPs表达,通过IGF和非IGF途径抑制肝癌细胞增殖,促进其凋亡。
已知MAPK(mitogen-activated protein kinase)是细胞内一类丝氨酸/苏氨酸蛋白激酶,可将细胞内的信号转导到细胞外,参与细胞的生长和分化、调节细胞周期和凋亡及血管的生成等[14]。目前已有研究表明MAPK相关信号转导通路(ERK1/2、p38、JNK和ERK5)通过调节肝癌细胞的增殖、凋亡、侵袭及转移[15-16],在肝癌的发生过程中起着重要的调控作用,成为肝癌防治的重要作用靶点。而双特异性磷酸酶(dual-specificity protein phosphatases,DUSPs)则可使MAPK去磷酸化,而抑制其活性,进一步调控肝癌的发生、发展[17]。目前已有研究证实,DUSP1在抑制肝癌发生、发展中起着重要作用,它的表达与ERK的表达呈负相关,与肝癌细胞增殖指数,细胞的凋亡和存活率,以及微血管密度紧密相关[18]。可通过调控 p-38/MAPK磷酸化增强p-53的磷酸化水平,诱导其下游靶基因p21和p27的表达,调控细胞周期和细胞凋亡[19]。研究表明DUSP5同家族中的其他成员一样,通过调控MAPK信号通路,调控多种肿瘤细胞的增殖、凋亡、侵袭转移等过程,与肿瘤的发展及预后密切相关[20-21]。但是对肝癌细胞的影响方面尚未见有相关研究。本研究发现溪黄草水提取物处理的肝癌HepG2细胞DUSP1(2.18倍,RT-PCR及Western blot结果均已证实)、DUSP5(5.92倍)、DUSP6 (2.89倍)和DUSP13(4.86倍)表达均明显升高,而DUSP9(0.44倍)表达下降,提示溪黄草水提取物可通过升高部分DUSPs活性,抑制MAPK的细胞增殖作用,从而达到抗肝癌或其他肿瘤的作用。
本研究通过芯片和RT-PCR技术均发现溪黄草处理后肝癌细胞ALDH8A1(aldehyde dehydrogenase 8 family,member A1)显著降低,ALDH8A1主要参与9-顺式视黄醛转化为9-顺式视黄酸的过程[22],目前关于其与肝癌的关系研究较少,溪黄草显著下降ALDH8A1 mRNA表达(已通过RT-PCR验证与芯片结果一致)的作用究竟对肝癌治疗的是利还是弊有待进一步研究。法尼酯X受体(farnesoid X receptor,FXR)调节胆汁酸代谢、胆固醇代谢、脂代谢,有研究报道FXR在肝癌组织表达高于癌旁组织,去除FXR则可自发生成肝脏肿瘤,激活FXR则可抑制肝癌细胞增殖[23-25]。本研究显示,溪黄草水提取物可显著降低肝癌细胞FXR的表达,是否会抑制其抗肝癌作用还有待于进一步研究。
有研究表明溪黄草含有多种活性抗肿瘤成分如二萜类化合物、三萜类化合物、多酚类化合物及活性多糖[26],溪黄草水提取物的抗肝癌作用可能是这多种抗肿瘤活性成分的协同作用,具体这些活性成分在溪黄草抗抗肝癌中的比重还需进一步通过谱-效关系确定。
综上所述,表达谱芯片表明溪黄草水提取物主要可上调IGFBPs、DUSPs及CDKNs等抑癌基因的表达,下调与肿瘤细胞增殖和DNA复制相关的MCMs等基因的表达,进而抑制肝癌细胞增殖和DNA复制,从而发挥其抗肝癌作用。但也可能上调促肝癌发生、发展基因(如MMP3、CYP1A1等)的表达,下调抑制肝癌发生、发展基因(如FXR等)的表达,需要辨证或整体看待溪黄草对肝癌的作用,以及进一步研究这些基因整体对肝癌的调控作用。
[1]陈源红,曾怡,罗艳红.溪黄草对肝癌细胞HepG2增殖及凋亡的影响[J].山东大学学报(医学版),2013,51(11):42-45.
[2]唐静雯,裴俊文,田同德,等.疏肝解毒活血汤联合西药治疗中晚期原发性肝癌31例[J].中医研究,2014,27(7):26-28.
[3]周幸.S期激酶相关蛋白2与人类恶性肿瘤关系的研究进展[J].医学研究生学报,2011,24(5):554-557.
[4]江明宏,舒茂琴.起始识别复合物在细胞周期中作用的研究进展[J].医学研究生学报,2007,20(1):80-82.
[5]高峻,杨宏新.微小染色体维持蛋白在肿瘤研究中的进展[J].包头医学院学报,2014,30(1):137-139.
[6]王晓林,熊枝繁,冯茂辉,等.微型染色体维持蛋白2在肝细胞癌中的表达及其意义[J].中华肝脏病杂志,2010,18(7):548-549.
[7]TANIAI E,YAFUNE A,KIMURA M,et al.Fluctuations in cell proliferation,apoptosis,and cell cycle regulation at the early stage of tumor promotion in rat two-stage carcinogenesis models[J].J Toxicol Sci,2012,37(6):1113-1126.
[8]ZHENG T,CHEN M,HAN S,et al.Plasma minichromosome maintenance complex component 6 is a novel biomarker for hepatocellular carcinoma patients[J].Hepatol Res,2014,44(13):1347-1356.
[9]孙雯.RNA干扰技术沉默MCM7基因对人肝癌SMMC-7721细胞生物学行为和裸鼠抑制瘤的影响[D].南宁:广西医科大学,2013.
[10]MA Y,HAN C C,LI Y,et al.Insulin-like growth factor-binding protein-3 inhibits IGF-1-induced proliferation of human hepatocellular carcinoma cells by controlling bFGF and PDGF autocrine/paracrine loops[J].Biochem Biophys Res Commun,2016,478(2):964-969.
[11]戴斌.IGFBP-1在肝癌组织中的表达、功能和作用机制研究[D].西安:第四军医大学,2015.
[12]姚一帆,毛卫林,董敏雅,等.血清类胰岛素样生长因子结合蛋白-3在肝癌早期复发中的预测价值[J].临床检验杂志,2016,34(8):630-634.
[13]GUCEV Z S,OH Y,KELLEY K M,et al.Evidence for insulin-like growth factor (IGF)-independent transcriptional regulation of IGF binding protein-3 by growth hormone in SKHEP-1 human hepatocarcinoma cells[J].Endocrinology,1997,138(4):1464-1470.
[14]KLEIN A M,ZAGANJOR E,COBB M H.Chromatin-tethered MAPKs[J].Curr Opin Cell Biol,2013,25(2):272-277.
[15]NAKAGAWA H,HIRATA Y,TAKEDA K,et al.Apoptosis signal-regulating kinase 1 inhibits hepatocarcinogenesis by controlling the tumor-suppressing function of stress-activated mitogen-activated protein kinase[J].Hepatology,2011,54(1):185-195.
[16]LIU W,NING R,CHEN R N,et al.Aspafilioside B induces G2/M cell cycle arrest and apoptosis by up-regulating H-Ras and N-Ras via ERK and p38 MAPK signaling pathways in human hepatoma HepG2 cells[J].Mol Carcinog,2016,55(5):440-457.
[17]CAMPS M,NICHOLS A,ARKINSTALL S.Dual specificity phosphatases:a gene family for control of MAP kinase function[J].FASEB J,2000,14(1):6-16.
[18]CALVISI D F,PINNA F,MELONI F,et al.Dual-specificity phosphatase 1 ubiquitination in extracellular signal-regulated kinase-mediated control of growth in human hepatocellular carcinoma[J].Cancer Res,2008,68(11):4192-4200.
[19]HAO P P,LI H,LEE M J,et al.Disruption of a regulatory loop between DUSP1 and p53 contributes to hepatocellular carcinoma development and progression[J].J Hepatol,2015,62(6):1278-1286.
[20]SHIN S H,PARK S Y,KANG G H.Down-regulation of dual-specificity phosphatase 5 in gastric cancer by promoter CpG island hypermethylation and its potential role in carcinogenesis[J].Am J Pathol,2013,182(4):1275-1285.
[21]STAEGE M S,MLLER K,KEWITZ S,et al.Expression of dual-specificity phosphatase 5 pseudogene 1 (DUSP5P1) in tumor cells[J].PLoS One,2014,9(2):e89577.
[22]刘佳莹,李淑珍,李晓玲,等.醛脱氢酶8A1融合蛋白的表达及其多克隆抗体的制备与鉴定[J].细胞与分子免疫学杂志,2008,24(12):1197-1198,1201.
[23]LI G,KONG B,ZHU Y,et al.Small heterodimer partner overexpression partially protects against liver tumor development in farnesoid X receptor knockout mice[J].Toxicol Appl Pharmacol,2013,272(2):299-305.
[24]孟祥宽,刘念,冯虎,等.FXR 在肝细胞癌组织和癌旁正常组织中的差异表达[J].中国实验诊断学,2015,19(7):1169-1171.
[25]位全芳,路菊,陶忠芬,等.FXR激动剂GW4064对裸鼠肝癌细胞移植瘤增殖及血管生成的影响[J].现代生物医学进展,2015,15(4):607-609.
[26]林恋竹.溪黄草有效成分分离纯化、结构鉴定及活性评价[D].广州:华南理工大学,2013.

