KP对早期胎盘滋养层细胞迁移及细胞内ERK、MMP-9、VEGF表达的影响
孙新六
(泰安市中心医院,山东泰安271000)
胎盘形成过程中,绒毛膜滋养层细胞对子宫壁不断重塑,侵入母体子宫内壁蜕膜,改造子宫壁螺旋动脉,形成丰富的血管通道,使母体和胎儿间有足够营养和气体交换[1]。人黑色素转移抑制基因(KP)与胎盘形成有关。绒毛膜滋养层细胞有KP和抗人黑色素转移抑制基因蛋白受体(GPR54)表达,KP与GPR54结合能影响癌细胞的生长、转移,并调节生殖功能、影响内分泌[2]。基质金属蛋白酶(MMP)、血管内皮细胞生长因子(VEGF)在绒毛膜滋养层细胞对子宫内壁的入侵过程中发挥重要作用[3]。2016年3月~2017年5月,本研究探讨了KP对早期胎盘滋养层细胞迁移及细胞外调节蛋白激酶(ERK)、MMP-9、VEGF表达的影响。
1 材料与方法
1.1 胎盘及试剂来源 胎盘来自本院自愿终止妊娠者[妊娠<3个月、年龄(27.6±5.8)岁,均为初孕,孕周(8.6±1.2)周,均知情同意]。鼠源GPR54抗体、鼠源抗人KP抗体、鼠源抗人β-actin抗体均购于BOSTER公司。KP抑制剂P234购于美国Abcam公司。本研究经医院伦理委员会批准。
1.2 滋养层细胞分离、培养及分组 取胎盘,无菌状态下剪取胎盘绒毛膜组织,用预先冰冷的PBS液漂洗3次,用眼科镊子剪成碎块,在含有0.25%胰蛋白酶和DNA酶(200 U/mL)溶液中37 ℃消化3次,30 min/次,收集悬浮细胞,去组织块,PBS液漂洗2次,以Percoll液梯度离心(3 000 r/min,20 min)分离细胞。将细胞收集于培养皿中,用RPMI1640液培养1 h,巨噬细胞贴壁,悬浮细胞,接种于24孔板,用含10%胎牛血清、1%青霉素与链霉素的RPMI1640培养液于37 ℃、5%CO2环境中培养,培养48 h。将滋养层细胞随机分为三组,对照组常规培养,KP组加入终浓度为100 nmol/L KP蛋白进行培养,KP+P234组加入终浓度为100 nmol/L KP蛋白及其抑制剂P234(终浓度5 μmol/L)进行培养,均培养30 min。
1.3 滋养层细胞迁移能力检测 采用细胞划痕实验。收集三组细胞,于6孔板中生长融合后,以吸头轻轻划痕,无菌PBS液轻柔冲去划痕中散落的细胞,于37 ℃、5% CO2环境中培养48 h。于显微镜下分别测量0、48 h划痕的宽度,计算迁移率。细胞迁移率=48 h划痕两边缘距离减小值/0 h划痕两边缘距离×100%,对照组迁移率为1。
1.4 细胞内KP、GPR54、MMP-9、VEGF mRNA表达检测 采用荧光定量PCR法。取各组细胞,采用TRIzol液常规提取细胞总RNA,将RNA逆转录成cDNA。反应产物进行荧光定量PCR。KP正向引物:5′-CTCACTGGTTTCTTGGCAGCTAC-3′、反向引物:5′-AGAGCCTACCCAGATGCTGAG-3′;GPR54正向引物:5′-GCTGGTACGTGAC GGTGTTC-3′、反向引物:5′-AGAGCCTACCCAGATGCTGAG-3′;MMP-9正向引物:5′-TGGAGGTTCGACGTGAAGG-3′、反向引物:5′-AAATAGGCTTTC TCTCGGTACTGG-3′;VEGF正向引物:5′-ACATCTTCAAGCCATCCTGTGTG-3′、反向引物:5′-TGGCCGTTGAGGTTGGAATG-3′。反应条件:95 ℃变性15 s,60 ℃复性和延伸40 s,40个循环。同时扩增内参β-actin。以2-ΔΔCt法计算基因相对表达量。
1.5 细胞内ERK蛋白表达检测 收集三组细胞,SDS-PAGE电泳,转PVDF膜,Western blotting法检测ERK和磷酸化的ERK(p-EKR),实验组蛋白相对表达量=p-ERK/ERK。
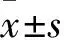
2 结果
2.1 三组滋养细胞迁移能力比较 对照组细胞迁移率为1,KP组为55.9%,KP+P234组为81.8%,三组比较差异有统计学意义(P均<0.05)。
2.2 三组KP、GPR54、MMP-9、VEGF mRNA表达比较 对照组KP、GPR54、MMP-9、VEGF mRNA相对表达量均为1,KP组分别为1.05±0.03、1.03±0.02、0.36±0.10、0.48±0.13,KP±P234组分别为0.58±0.12、1.04±0.06、0.62±0.15、0.85±0.17。KP组KP mRNA相对表达量较KP+234组高(P<0.05),与对照组比较差异无统计学意义(P>0.05);三组GPR54 mRNA相对表达量比较,P均>0.05;与对照组比较,KP组、KP±P234组MMP-9、VEGF mRNA相对表达量低(P均<0.05),KP组最低(P均<0.05)。
2.3 三组ERK蛋白表达比较 对照组p-ERK/ERK为1,KP组为2.3±0.5,KP+P234组为1.6±0.3,与对照组比较,KP组、KP±P234组ERK蛋白相对表达量低(P均<0.05),KP组最低(P均<0.05)。
3 讨论
KP结合G蛋白受体GPR54,可激活磷脂酶C,导致细胞内钙离子增加。KP能激活细胞中的ERK信号通路,使细胞永生化[4]。KP和GPR54最初均表达于受精卵合胞体细胞,与胎盘的形成有关;胎盘形成过程失调可致多种孕期并发症[5],如滋养层细胞入侵贫乏可致患者出现子痫前期症状、胎儿宫内生长受限;胎盘形成过度入侵则致胎盘异常增生[6]。绒毛膜滋养层细胞有KP和GPR54表达[7]。KP的转录表达在早期和末期胎盘中无差异;但GPR54在早期胎盘的表达高于末期胎盘[8]。这与怀孕早期滋养层细胞高侵入性而末期胎盘低侵入性相一致。本研究结果表明,早期胎盘滋养层细胞均表达GPR54、KP,提示GRP54、KP与早期胎盘的发育可能相关。
绒毛膜滋养层细胞对入侵血管的过程与肿瘤细胞相似,MMP、VEGF在其中发挥重要作用[9]。本研究结果显示,KP可抑制滋养层细胞迁移,影响子宫内壁的重塑。KP干预后,滋养层细胞ERK蛋白表达降低,加入KP抑制剂P234则ERK蛋白表达高。其作用机制可能为KP与其受体GPR54结合后,激活磷脂酶C,使二磷酸磷脂酰肌醇水解,产生细胞内第二信使三磷酸肌醇和甘油二酯,使细胞内钙离子增加,磷酸化ERK,从而产生生物学作用[10]。提示KP能刺激ERK磷酸化从而抑制ERK介导的细胞信号通路发挥作用。
MMP能降解细胞外基底膜,在绒毛膜滋养层细胞对螺旋动脉的重塑过程中起重要作用。MMP-9表达减少时,滋养层细胞入侵能力减弱,胎盘形成不良,易诱发子痫前期症状及胎儿宫内生长受限[11]。KP可控制MMP-9活性,其可能通过调节MMP的转录而发挥抑制作用。滋养层细胞入侵子宫内膜,通过替换血管内皮细胞,转化子宫内壁血管[12]。本研究结果显示,KP能降低滋养细胞内MMP-9、VEGF mRNA表达,提示MMP-9和VEGF参与胎盘形成过程。
综上所述,KP可抑制早期胎盘滋养层细胞迁移,抑制细胞内ERK、MMP-9及VEGF表达。
[1] Gupta S, Misra R, Ghosh UK, et al. Comparison of foetomaternal circulation in normal pregnancies and pregnancy induced hypertension using color Doppler studies[J]. Indian J Physiol Pharmacol, 2014,58(3):284-289.
[2] Pinilla L, Aguilar E, Dieguez C, et al. Kisspeptins and reproduction: physiological roles and regulatory mechanisms[J]. Physiol Rev, 2012,92(3):1231-1235.
[3] Matjila M, Millar R, van der Spuy Z,et al. The differential expression of Kiss1, MMP9 and angiogenic regulators across the feto-maternal interface of healthy human pregnancies: implications for trophoblast invasion and vessel development[J]. PLoS One, 2013,8(5):e63574.
[4] Ji K, Ye L, Ruge F, et al. Implication of metastasis suppressor gene, Kiss-1 and its receptor Kiss-1R in colorectal cancer[J]. BMC Cancer, 2014,14:723.
[5] Tsutsui K, Bentley GE, Kriegsfeld LJ, et al. Kriegsfeld discovery and evolutionary history of gonadotrophin-inhibitory hormone and kisspeptin: new key neuropeptides controlling reproduction[J]. J Neuroendocrinol, 2010,22(7):716-727.
[6] Gui S, Ni S, Jia J, et al. Inconformity of CXCL3 plasma level and placenta expression in preeclampsia and its effect on trophoblast viability and invasion[J]. PLoS One, 2014,9(12):e114408.
[7] Kulvinder KK, Allahbadia G, Singh M, et al. Kisspeptins in human reproduction future therapeutic potential[J]. J Assist Reprod Genet, 2012,29(10):999-1011.
[8] Francis VA, Abera AB, Matjila M, et al. Kisspeptin regulation of genes involved in cell invasion and angiogenesis in first trimester human trophoblast cells[J]. PLoS One, 2014,9(6):e9968010.
[9] Yu N, Yan W, Yin T, et al. HCG-activated human Peripheral Blood Mononuclear Cells(PBMC) promote trophoblast cell invasion[J]. PLoS One, 2015,10(6):e0125589.
[10] Szereszewski JM, Pampillo M, Ahow MR, et al. GPR54 regulates ERK1/2 activity and hypothalamic gene expression in a Gα(q/11) and β-arrestin-dependent manner[J]. PLoS One,2010,5(9):e12964.
[11] Patel A, Dash PR. Formation of atypical podosomes in extravillous trophoblasts regulates extracellular matrix degradation[J]. Eur J Cell Biol, 2012,91(3):171-179.
[12] Tuteja G, Chung T, Bejerano G, et al. Changes in the enhancer landscape during early placental development uncover a trophoblastinvasion gene-enhancer network[J]. Placenta, 2016,37:45-55.

