环磷酰胺对小鼠胚胎成骨细胞MC3T3-E1缝隙连接功能的影响
张媛,谭晓明,常惠礼(广州医科大学附属第六医院 清远市人民医院,广东清远511518)
细胞缝隙连接(GJ)是相邻细胞之间的特殊蛋白质连接通道,介导细胞间的物质交换和信号传递[1]。GJ由特殊的通道蛋白——连接蛋白(Cx)组成,由GJ介导的细胞间信号传导在同步细胞活动、维持细胞内环境稳定、调控细胞增殖、分化等方面发挥重要作用[2]。骨细胞的GJ主要由Cx43组成[3]。研究发现,糖皮质激素引起的骨质疏松与Cx43有密切关系[4];Cx43及其组成的GJ能够促进成骨细胞的分化[5]。因此,GJ可能是药物导致骨质疏松的相关靶点。环磷酰胺是临床常用的氮芥类化疗药物,
广泛应用于各种实体瘤和免疫性疾病等。骨髓抑制及骨质疏松是环磷酰胺在治疗过程中导致的最主要的不良反应,许多肿瘤患者在使用环磷酰胺化疗后发生骨量丢失、骨密度下降,从而继发骨质疏松[6,7]。2017年1~5月,本研究观察了环磷酰胺对小鼠胚胎成骨细胞MC3T3-E1 GJ功能的影响,现分析结果并探讨其是否与Cx43表达有关。
1 材料与方法
1.1 材料 细胞:小鼠MC3T3-E1细胞株购自美国ATCC细胞库。主要试剂:环磷酰胺、抗Cx43、HRP标记的羊抗鼠二抗均购自美国Sigma公司,DMEM高糖、0.25%胰酶、FBS购自美国Gibco公司,Calcein acetoxymethyl ester(calcein-AM)购自美国Invitrogen公司,CCK-8试剂盒(WST-8)购自日本Dojindo公司;其他常用试剂均为国产分析纯。主要仪器:倒置显微镜(CKX41)购自日本Olympus公司;荧光正置显微镜(DP73)购自日本Olympus公司;酶标仪(SPECTROstar Nano)购自德国BMG Labtech公司。
1.2 细胞培养及分组处理 将MC3T3-E1细胞培养于高糖DMEM培养液(含10% FBS),在37 ℃、5% CO2及饱和湿度孵箱中培养。将对数生长期MC3T3-E1细胞,以3 000个/孔的密度接种至96孔板,每孔100 μL。随机分为观察组和对照组,每组3个复孔。观察组分别加入浓度为0.02、0.2、2 μg/mL的环磷酰胺0.1 μL,对照组加入等体积二甲基亚砜。
1.3 细胞相对存活率检测 采用CCK-8法。参照1.2的方法进行分组处理,空白对照孔仅加入等量培养液。作用24 h后,更换培养液,每孔加入10 μL CCK-8溶液,继续培养4 h。设对照组存活率为100%,采用酶标仪检测450 nm波长处的光密度(OD)值,计算细胞相对存活率。细胞相对存活率(%)=(观察组OD450-空白对照孔OD450)/(对照组OD450-空白对照孔OD450)×100%。实验重复3次,取平均值。
1.4 细胞GJ功能检测 采用细胞接种荧光示踪法。将荧光指示剂Calcein-AM与天然表达Cx43的MC3T3-E1细胞共同孵育,制得“供体细胞”。参照1.2的方法进行分组处理,至细胞达到生长融合状态。将孵育绿色荧光染料的“供体细胞”以1∶50的密度接种到两组细胞(即“受体细胞”)中。培养4 h,荧光显微镜下观察并计数一个供体细胞周围含有绿色荧光受体细胞数,以此评价细胞GJ功能。实验重复3次,取平均值。
1.5 Cx43蛋白表达检测 采用Western blotting法。参照1.2的方法进行分组处理,作用4 h。细胞生长融合至90%时弃掉培养液,预冷PBS冲洗3次,加入细胞裂解液,超声破碎后离心提取总蛋白。取定量后的蛋白25 μg经上样缓冲液变性处理,SDS-PAGE凝胶电泳,电转于PVDF膜上。5%牛奶室温封闭1 h,加入一抗4 ℃摇床过夜(Cx43稀释倍数为1∶2 000,β-tublin稀释倍数为1∶10 000),加入二抗室温孵育1 h。采用Bio Imaging system(Gene Genius)对胶片进行灰度扫描分析。Cx43蛋白相对表达量以Cx43蛋白与内参β-tublin蛋白灰度值的比值表示。实验重复3次,取平均值。
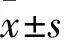
2 结果
2.1 两组细胞相对存活率比较 加入浓度为0.02、0.2、2 μg/mL环磷酰胺的观察组细胞相对存活率分别为(100.5±5.5)%、(101.0±12.0)%、(97.5±8.5)%,对照组为100%;加入不同浓度环磷酰胺的观察组与对照组比较P均>0.05,观察组不同浓度间比较P均>0.05。
2.2 两组细胞GJ功能比较 加入浓度为0.02、0.2、2 μg/mL环磷酰胺的观察组一个供体细胞周围含有绿色荧光受体细胞数分别为(5.2±0.11)、(4.7±0.19)、(3.9±0.34)个,对照组为(7.5±0.24)个;加入不同浓度环磷酰胺的观察组与对照组比较P均<0.05,观察组不同浓度间比较P均>0.05。
2.3 两组Cx43表达比较 加入浓度为0.02、0.2、2 μg/mL环磷酰胺的观察组Cx43相对表达量分别为0.82±0.05、0.86±0.09、0.82±0.06,对照组为0.90±0.06;加入不同浓度环磷酰胺的观察组与对照组比较P均>0.05,观察组不同浓度间比较P均>0.05。
3 讨论
环磷酰胺是临床常用的氮芥类化疗药物,广泛应用于各种实体瘤和免疫性疾病等的治疗。骨髓抑制及骨质疏松是环磷酰胺最主要的不良反应,许多肿瘤患者在使用环磷酰胺化疗后继发骨质疏松[6,7]。环磷酰胺可明显抑制骨形成,导致骨量减少、骨显微结构退化等典型骨质疏松症表现,其发生机制还未阐明。目前认为与以下因素有关:①核因子κB受体活化因子配体/骨保护素(RANKL/OPG)。RANKL/OPG在骨重塑过程中发挥重要作用,OPG由成骨细胞合成和分泌,可以抑制破骨细胞的分化并减弱骨吸收;RANKL/OPG与骨质疏松的形成密切相关[8];②DNA修复途径。环磷酰胺代谢过程中产生的大量活性氧自由基造成DNA损伤,从而影响DNA修复途径[9,10]。因此,细胞中RANKL/OPG信号和DNA修复途径在环磷酰胺导致骨质疏松的发病机制中具有关键作用。
成骨细胞促进骨形成,破骨细胞促进骨吸收,二者之间的精细平衡在维持骨的代谢稳态中具有至关重要的作用。GJ是相邻细胞间形成的一种能够开放和关闭的膜通道结构,介导细胞间直接的信号交流,某些信号分子可以通过GJ在细胞间进行传递。研究表明,成骨细胞富含Cx43组成的GJ[3]。Cx43在维持骨细胞功能方面发挥多个重要作用,包括促进成骨细胞的增殖、分化及骨愈合等[11]。研究证实,糖皮质激素通过下调成骨细胞Cx43表达而诱导骨质疏松,甲状旁腺素、双磷酸盐作用于成骨细胞后均可引起Cx43表达及其组成的GJ功能变化[12,13]。Cx43及其组成的GJ能够促进成骨细胞的分化,影响破骨细胞融合及其功能,Cx43通过调控细胞间第二信使如磷酸激酶传递以及信号通路,进而调控成骨细胞生成和细胞存活[11,14]。成骨细胞间由Cx43组成的GJ能够减轻氧化应激对其产生的细胞损伤[15],机械刺激骨细胞后,Cx43组成的半通道能够调控NAD+、前列腺素E2和ATP的释放,从而保护骨细胞[16~18]。双磷酸盐通过Cx43半通道进入破骨细胞,从而抑制破骨细胞形成[19]。因此,研究环磷酰胺对成骨细胞GJ的影响对阐明其导致骨质疏松的机制具有重要意义。
为了排除药物的细胞毒性对GJ功能的影响,本研究首先采用CCK-8法观察了不同浓度环磷酰胺对MC3T3-E1细胞增殖的影响。结果显示,加入0.02、0.2、2 μg/mL环磷酰胺的观察组细胞相对存活率与对照组比较无统计学差异,观察组不同浓度间比较无统计学差异;说明环磷酰胺在0.02~2 μg/mL浓度范围对MC3T3-E1细胞的毒性作用较小。Calcein-AM进入细胞后,其上所带的乙酰甲酯被细胞内脂酶水解而形成发绿色荧光的calcein,不能透过细胞膜,但能经GJ传递至相邻细胞。本研究结果显示,加入浓度为0.02、0.2、2 μg/mL环磷酰胺的观察组一个供体细胞周围含有绿色荧光受体细胞数均低于对照组,观察组不同浓度间比较差异均无统计学意义;说明环磷酰胺在0.02~2 μg/mL浓度范围内可降低MC3T3-E1细胞的GJ功能。同时本研究显示,加入0.02、0.2、2 μg/mL环磷酰胺的观察组细胞Cx43相对表达量与对照组比较,观察组不同浓度间比较,差异均无统计学意义;说明环磷酰胺降低MC3T3-E1细胞GJ功能的机制与Cx43蛋白表达无关。
参考文献:
[1] Sosinsky GE, Nicholson BJ. Structural organization of gap junction channels[J]. Biochim Biophys Acta, 2005,1711(2):99-125.
[2] Vinken M, Vanhaecke T, Papeleu P, et al. Connexins and their channels in cell growth and cell death[J]. Cell Signal, 2006,18(5):592-600.
[3] Stains JP, Civitelli R. Connexins in the skeleton[J]. Semin Cell Dev Biol, 2016,50:31-39.
[4] Shen C, Kim MR, Noh JM, et al. Glucocorticoid suppresses connexin 43 expression by inhibiting the Akt/mTOR signaling pathway in osteoblasts[J]. Calcif Tissue Int, 2016,99(1):88-97.
[5] Schiller PC, D′Ippolito G, Brambilla R, et al. Inhibition of gap-junctional communication induces the trans-differentiation of osteoblasts to an adipocytic phenotype in vitro[J]. J Biol Chem, 2001,276(17):14133-14138.
[6] Headley JA, Theriault RL, LeBlanc AD, et al. Pilot study of bone mineral density in breast cancer patients treated with adjuvant chemotherapy[J]. Cancer Invest, 1998,16(1):6-11.
[7] Saarto T, Blomqvist C, Vlimki M, et al. Chemical castration induced by adjuvant cyclophosphamide, methotrexate, and fluorouracil chemotherapy causes rapid bone loss that is reduced by clodronate: a randomized study in premenopausal breast cancer patients[J]. J Clin Oncol, 1997,15(4):1341-1347.
[8] Khosla S. Minireview: the OPG/RANKL/RANK system[J]. Endocrinology, 2001,142(12):5050-5055.
[9] Selvakumar E, Prahalathan C, Varalakshmi P, et al. Modification of cyclophosphamide-induced clastogenesis and apoptosis in rats by alpha-lipoic acid[J]. Mutat Res, 2006,606(1-2):85-91.
[10] Wang HT, Hu Y, Tong D, et al. Effect of carcinogenic acrolein on DNA repair and mutagenic susceptibility[J]. J Biol Chem, 2012,287(15):12379-12386.
[11] Plotkin LI, Stains JP. Connexins and pannexins in the skeleton: gap junctions, hemichannels and more[J]. Cell Mol Life Sci, 2015,72(15):2853-2867.
[12] Schilling AF, Filke S, Lange T, et al. Gap junctional communication in human osteoclasts in vitro and in vivo[J]. J Cell Mol Med, 2008,12(6A):2497-2504.
[13] Cherian PP, Xia X, Jiang JX. Role of gap junction, hemichannels, and connexin 43 in mineralizing in response to intermittent and continuous application of parathyroid hormone[J]. Cell Commun Adhes, 2008,15(1):43-54.
[14] Plotkin LI, Aguirre JI, Kousteni S, et al. Bisphosphonates and estrogens inhibit osteocyte apoptosis via distinct molecular mechanisms downstream of extracellular signal-regulated kinase activation[J]. J Biol Chem, 2005,280(8):7317-7325.
[15] Kar R, Riquelme MA, Werner S, et al. Connexin 43 channels protect osteocytes against oxidative stress-induced cell death [J]. J Bone Miner Res, 2013,28(7):1611-1621.
[16] Cherian PP, Siller-Jackson AJ, Gu S, et al. Mechanical strain opens connexin 43 hemichannels in osteocytes: a novel mechanism for the release of prostaglandin[J]. Mol Biol Cell, 2005,16(7):3100-3106.
[17] Fruscione F, Scarfì S, Ferraris C, et al. Regulation of human mesenchymal stem cell functions by an autocrine loop involving NAD+release and P2Y11-mediated signaling[J]. Stem Cells Dev, 2011,20(7):1183-1198.
[18] Genetos DC, Kephart CJ, Zhang Y, et al. Oscillating fluid flow activation of gap junction hemichannels induces ATP release from MLO-Y4 osteocytes[J]. J Cell Physiol, 2007,212(1):207-214.
[19] Plotkin LI, Manolagas SC, Bellido T. Transduction of cell survival signals by connexin-43 hemichannels[J]. J Biol Chem, 2002,277(10):8648-8657.

