新辅助化疗联合手术与单纯手术治疗结肠癌疗效的Meta分析
陶 勇,康清杰,向 征
重庆医科大学附属第一医院胃肠外科,重庆 400016
新辅助化疗是1982年由Frei提出恶性肿瘤的治疗方式,目前新辅助化疗的疗效已在食管癌[1]、乳腺癌[2]、直肠癌[3]等肿瘤治疗中得到证实,越来越多的研究[3]认为,更早地予以全身治疗可有效根除微转移、减少手术导致的早期生长因子等激活,从而延缓肿瘤进展。新辅助化疗可缩小肿瘤体积、降低数字肿瘤细胞脱落的风险及提高肿瘤的R0切除率,同样可降低手术后的复发及转移风险。同时,术前予以化疗可提高患者的耐受性,其疗效可评估及指导术后用药[4]。但是,新辅助化疗存在肿瘤治疗效果不佳,导致肿瘤进一步发展至肠梗阻、穿孔等需急诊手术处理情况,大大提高了围术期的风险及死亡率,同时可能导致肿瘤出现转移,导致不可手术风险。新辅助化疗的疗效及安全性在结肠癌的治疗中仍未达成共识。本研究运用循证医学的原理和方法,对比较新辅助化疗联合手术与单纯手术治疗结肠癌临床疗效的随机对照研究进行Meta分析,希望能为临床决策提供一定参考。
1 资料与方法
1.1文献检索策略计算机检索PubMed、EMbase、Cochrane Library、CNKI、万方数据库关于新辅助化疗联合手术(新辅助化疗组)与单纯手术(手术组)治疗结肠癌疗效比较的随机对照试验,检索时间为建库至2017年9月。中文检索词包括:结肠癌、新辅助化疗、术前化疗、随机等;英文检索词包括:colon cancer、colonic neoplasm、colonic cancer、neoadjuvant chemotherapy、preoperative chemotherapy、random等。
1.2纳入与排除标准
1.2.1 研究类型:随机对照试验。
1.2.2 研究对象:(1)病理证实为结肠癌,经辅助检查证实肿瘤可切除;(2)无合并其他肿瘤患者;(3)无国籍、种族、性别、年龄限制。
1.2.3 干预措施:新辅助化疗组接受新辅助化疗后行手术治疗,手术组行单纯手术治疗。
1.2.4 结局指标:R0切除率、腹腔感染、吻合口瘘、肿瘤直径、肿瘤浸润固有肌层深度、3年无病生存率(disease-free survival, DFS)、5年DFS、3年总生存率(overall survival, OS)、5年OS、远处转移率。
1.2.5 排除标准:(1)非中、英文文献;(2)重复发表文献;(3)肿瘤已明确有转移或不可切除;(4)无相关结局指标数据文献。
1.3文献质量评价采用Cochrane 协作网提供的“偏倚风险评估”工具对文献进行质量评价,包括6个方面:(1)随机分配方法;(2)分配方案隐藏;(3)对研究对象、治疗方案实施者、研究结果测量者采用盲法;(4)结果数据的完整性;(5)选择性报告研究的结果;(6)其他偏倚来源,如事先计划书中提到的问题是否得到回答;通过以上条件将研究文献分为低偏倚风险、偏倚不确定、高偏倚风险3大类。
1.4统计学分析应用RevMan 5.3统计软件进行分析,计数资料采用相对危险度(relative risk,RR),连续性变量采用加权均数差(weighted mean difference,WMD)表示,统计量都以95%作为可信区间(confidence interval,CI)表示。当试验存在异质性(P<0.1,I2>50%),首先分析异质性原因,若无临床异质性,则采用随机效应模型进行分析。采用敏感性分析检验结果的稳定性。P<0.05为差异有统计学意义。
2 结果
2.1文献基本特征共检索到10个符合要求的随机对照试验[5-14],共3 159例患者,其中1 595例患者接受新辅助化疗联合手术治疗,1 564例患者接受单纯手术治疗(见表1)。

表1 纳入文献一般情况 Tab 1 General information included in the literature
注:*新辅助化疗组包括结肠癌351例,直肠癌317例;手术组包括结肠癌358例,直肠癌329例。
2.2纳入研究的偏倚风险评估结果采用Cochrane 协作网提供的“偏倚风险评估”工具对文献进行质量评价。(1)随机分配方法:10项研究均采用随机分配方法;(2)分配方案隐藏:7项研究采用分配方案隐藏,3项未采用;(3)对研究对象、治疗方案实施者、研究结果测量者采用盲法:1项研究采用了盲法,其余研究均未使用盲法;(4)结果数据的完整性:7项研究结果数据保持完整,3项研究数据部分缺失;(5)选择性报道研究的结果:没有证据表明存在报道偏倚;(6)其他偏倚来源:本探究未分辨新辅助化疗的药物及方式,可能导致偏倚。纳入文献均为偏倚风险评估为“低风险”的文献(见图1)。
2.3Meta分析结果
2.3.1 R0切除率:共纳入3个研究,各研究间无明显异质性(P=0.13,I2=50%),采用固定效应模型进行Meta分析结果显示,新辅助化疗组的R0切除率高于单纯手术组,差异有统计学意义(OR=1.10,95%CI:1.05~1.16,P<0.0001)(见图2)。

图1 纳入研究的偏倚风险评估结果Fig 1 The risk of bias in integrated research
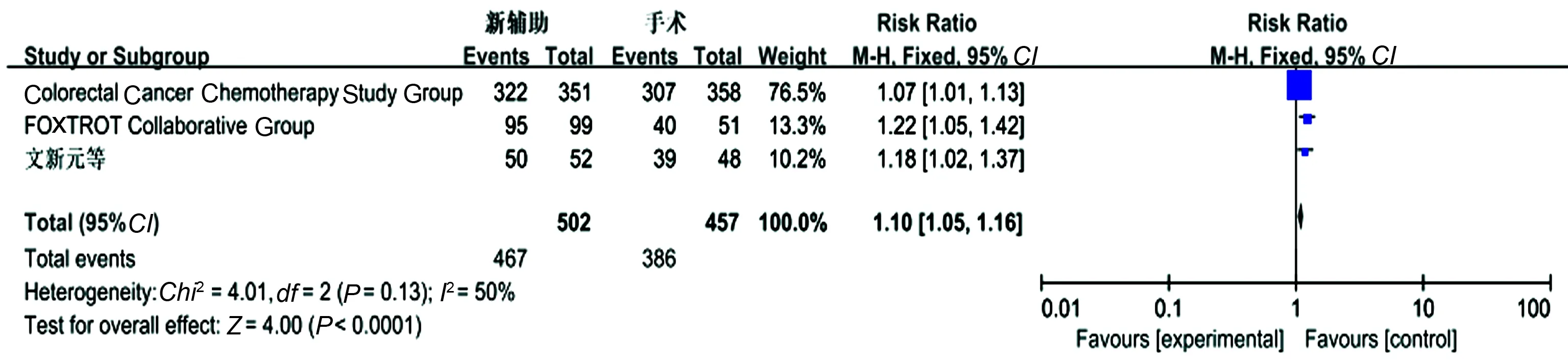
图2 R0切除率的Meta分析结果Fig 2 R0 resection rate of Meta-analysis
2.3.2 生存率:4个研究报道了3年OS,无明显异质性(P=0.24,I2=29%),采用固定效应模型分析显示,新辅助化疗组较单纯手术组有更好的3年OS,差异有统计学意义(OR=1.07,95%CI: 1.02~1.13,P=0.01)(见图3)。4个研究报道了5年OS,存在异质性(P=0.007,I2=75%),考虑异质性与新辅助化疗中给药途径不同导致,剔除文献ZHONG等[8],统计结论未发生变化,提示新辅助化疗组与单纯手术组之间5年OS差异无统计学意义(P>0.05)(见图4)。3个研究报道了5年DFS,无明显异质性(P=0.51,I2=0),采用固定效应模型分析显示,新辅助化疗组与单纯手术组5年DFS相比,差异无统计学意义(P>0.05)(见图5)。

图3 3年OS的Meta分析结果 Fig 3 Three-year overall survival of Meta-analysis
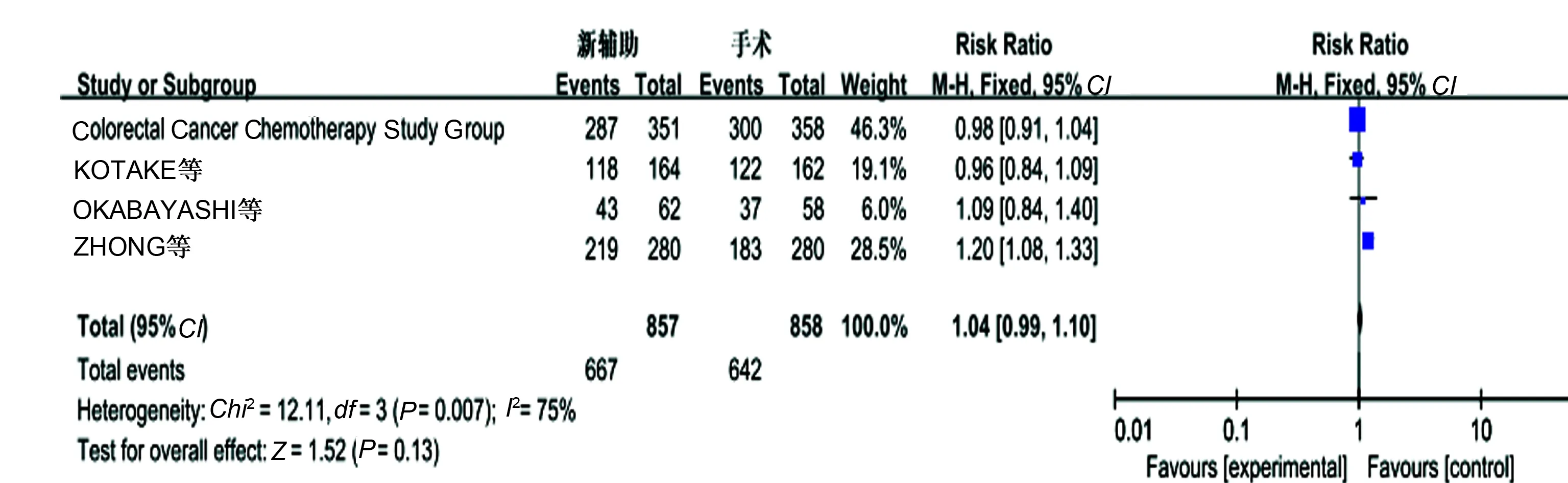
图4 5年OS的Meta分析结果Fig 4 Five-year overall survival of Meta-analysis

图5 5年DFS的Meta分析结果Fig 5 Five-year disease-free survival of Meta-analysis
2.3.3 腹腔感染: 6个研究报道了腹腔感染发生,无异质性(P=0.90,I2=0),采用固定效应模型分析,新辅助化疗组与单纯手术组腹腔感染发生率相比,差异无统计学意义(P>0.05)(见图6)。

图6 腹腔感染的Meta分析结果Fig 6 Abdominal infection of Meta-analysis
2.3.4 吻合口:6个研究报道了吻合口瘘,分析结果显示,各研究间未见明显异质性(P=0.80,I2=0),采用固定效应模型分析,新辅助化疗组与单纯手术组吻合口瘘发生率差异无统计学意义(P>0.05)(见图7)。
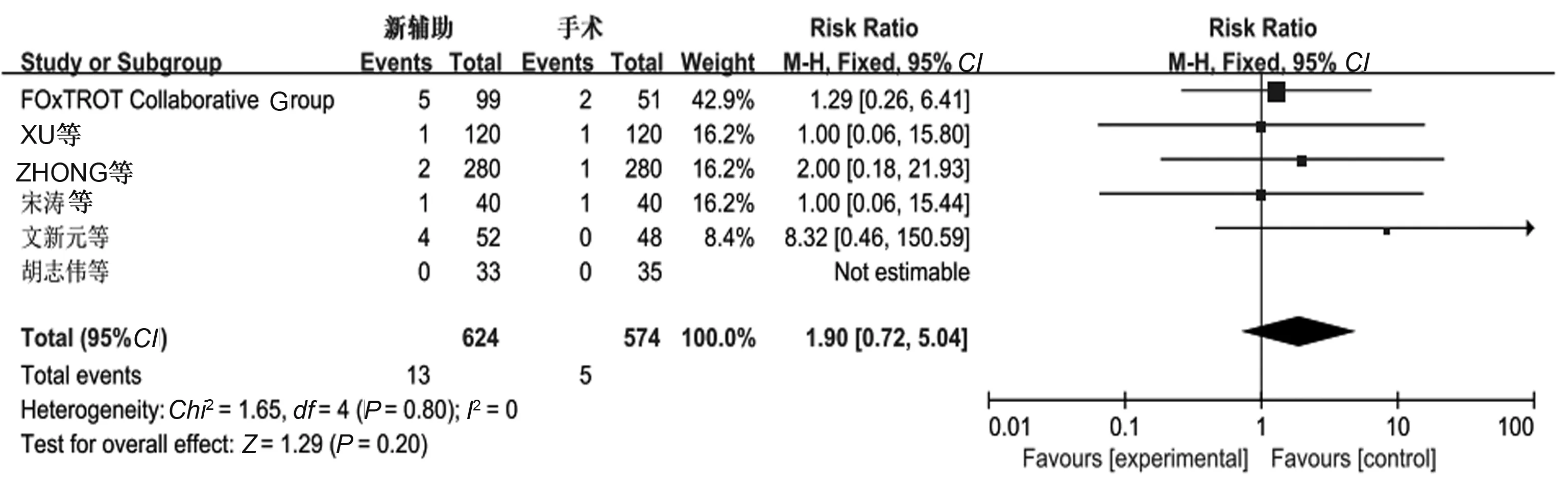
图7 吻合口瘘的Meta分析结果Fig 7 Anastomotic leakage of Meta-analysis
2.3.5 肿瘤直径:6个研究报道了大体标本肿瘤最大径,有明显异质性(P<0.00001,I2=96%)(见图8),考虑异质性来源于研究设计的不同,剔除宋涛等[11]和文新元等[12]2个选择偏倚较高的研究后,无明显异质性(P=0.36,I2=6%),采用固定效应模式分析显示,新辅助化疗组与单纯手术组的大体标本肿瘤最大径相比,差异有统计学意义(P<0.05)(见图9)。

图8 肿瘤最大径Meta分析结果 Fig 8 Tumor diameter of Meta-analysis
2.3.6 肿瘤浸润固有层深度:2个研究报道了肿瘤浸润固有肌层深度,无明显异质性(P=0.55,I2=0),采用固定效应模型分析,新辅助化疗组可以缩小肿瘤的浸润深度,差异有统计学意义(P<0.05)(见图10)。

图9 肿瘤最大径Meta分析的结果 Fig 9 Tumor diameter of Meta-analysis

图10 肿瘤浸润固有肌层深度的Meta分析结果Fig 10 Tumor infiltration propria of Meta-analysis
2.3.7 复发率:4个研究报道了复发率,存在异质性(P=0.22,I2=33%),采用随机效应模型进行Meta分析,结果显示新辅助化疗组与单纯手术组复发率比较,差异有统计学意义(P<0.05)(见图11)。

图11 复发率的Meta分析结果Fig 11 Recurrence rate of Meta-analysis
2.3.8 远处转移:3个研究报道了远处转移,无明显异质性(P=0.19,I2=40%),采用固定效应模式,新辅助化疗组远处转移发生率低,差异有统计学意义(P<0.05)(见图12)。
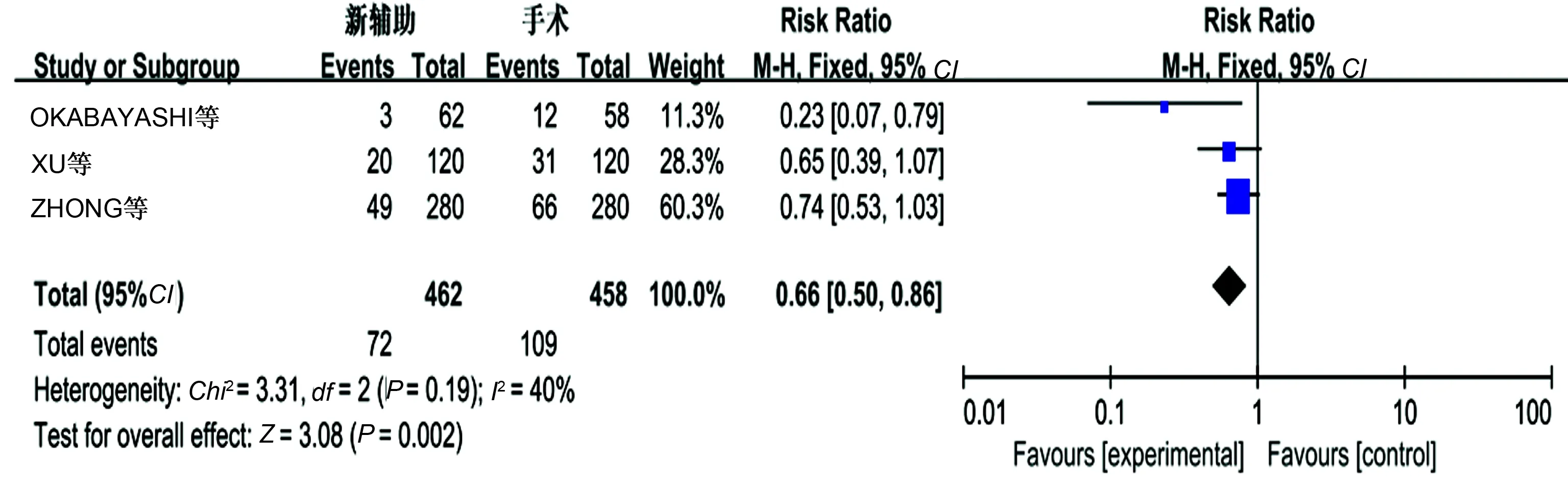
图12 远处转移的Meta分析结果 Fig 12 Tumor metastasis of Meta-analysis
2.4发表偏倚评价基于5年OS进行的发表偏倚漏斗图结果示,各研究在漏斗两侧分布未完全对称,提示可能存在一定的发表偏倚(见图13)。

图13 基于5年OS的发表偏倚漏斗图 Fig 13 Publication bias funnel map of 5-year overall survival
3 讨论
新辅助化疗是指在恶性肿瘤局部实施手术或放疗前应用的全身性化疗,它与术后辅助化疗不同,新辅助化疗有如下作用:(1)缩小肿瘤体积或临床降期,提高根治切除率,降低手术难度;(2)消除潜在的微转移灶,减少术中肿瘤细胞播散,降低术后的转移及复发;(3)验证肿瘤对化疗药物的反应性,指导术后用药[4]。本研究通过对有关新辅助化疗联合手术与单纯手术治疗结肠癌的RCTs进行Meta分析发现,新辅助化疗联合手术治疗可以提高结肠癌的R0切除率、缩小肿瘤直径、降低肿瘤的浸润深度而达到降期目的,同时可以提高患者3年的OS及减少肿瘤转移,且不增加围术期腹腔感染、吻合口瘘等相关并发症的发生率。
美国NCCN指南指出,针对可切除的、临床T4b的结肠癌患者,新辅助化疗可采用FOLFOX或CapeOx方案,新辅助化疗的可行性分析已在2012年进行报道,随机化的Ⅲ期FOXTROT试验正在评估新辅助化疗是否可改善结肠癌患者的DFS(NCT00647530)[15]。在一项多中心二期临床研究[16]中,77例临床可切除结肠癌患者接受术前予以卡培他滨+奥沙利铂化疗,野生型加用帕尼单抗,结果显示,新辅助化疗组复发率明显低于单纯手术组(新辅助化疗组6%,单纯手术组32%),新辅助化疗组3年DFS明显高于单纯手术组(新辅助化疗组94%,单纯手术组63%)。在另一项研究[17]中,47例局部进展期结肠癌患者接受卡培他滨+奥沙利铂术前化疗,术前化疗2个周期后进行CT评估提示肿瘤缩小率达68%,且仅有3例患者化疗不良反应达到3级。ZHOU等[18]予以23例Ⅲb期结肠癌奥沙利铂联合(伊立替康+亚叶酸钙+氟尿嘧啶)或卡培他滨术前化疗,发现21例患者新辅助化疗后肿瘤体积减小,达到了T分期和N分期的降期作用,但13例患者有3~4级化疗不良反应。一项回顾性研究报道[19],34例术前予以FOLFOX方案化疗和放疗的局部进展期结肠癌患者,9例达到病理完全缓解,2年的OS和DFS达到88.7%和73.6%。可切除结肠癌患者的新辅助化疗的可行性及安全性先已得到多个研究的证实。但DEHAL等[20]回顾分析美国癌症数据库的27 575例结肠癌患者,26 654例(97%)接受手术及术后辅助化疗,921例(3%)接受新辅助化疗后手术,结果提示,新辅助化疗组T4b结肠癌患者的生存率提高,但是对T4及T4a患者生存率无明显影响。结肠癌的新辅助化疗的化疗指针、化疗方案仍存在较大争议。
本次Meta分析存在许多不足之处,有待进一步改善。首先,纳入研究的化疗方案、化疗药物及化疗剂量及具体手术方式不完全一致,这些差异可能对Meta分析结果造成影响。其次,受纳入研究的数据限制,未能对化疗毒性、淋巴结阳性数目等指标进行分析。
综上所述,新辅助化疗联合手术治疗可以提高结肠癌的R0切除率,缩小肿瘤直径,降低肿瘤的浸润深度而达到降期,同时可以提高3年的OS及减少肿瘤转移的效果[21]。同时不增加围术期腹腔感染、吻合口瘘等相关并发症的发生率,受纳入研究数量和质量的限制,上述结论尚待开展更多的高质量研究予以验证。
[1] HERRMANN R, SCHLAG P, MANEGOLD C, et al. Neoadjuvant chemotherapy in esophageal cancer, results of an eortc phase Ⅱ pilot study [J]. J Cancer Res Clin, 1986, 111(1): S86-S86. DOI: 10.1007/BF02580114.
[2] LIEDTKE C, MAZOUNI C, HESS K R, et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer [J]. J Clin Oncol, 2008, 26(8): 1275-1281. DOI: 10.1200/JCO.2007.14.4147.
[3] GROSSO F, MANDALA M, MAGLIONE V, et al. Neoadjuvant therapy and mini-invasive total mesorectal excision for rectal cancer: feasibility and outcome analysis from a single institution prospectively collected data base [J]. Tumori, 2012, 98(6): 689-695. DOI: 10.1700/1217.13490.
[4] ASCHELE C, CIONINI L, LONARDI S, et al. Primary tumor response to preoperative chemoradiation with or without Oxaliplatin in locally advanced rectal cancer: pathologic results of the STAR-01 randomized phase Ⅲ trial [J]. J Clin Oncol, 2011, 29(20): 2773-80. DOI: 10.1200/JCO.2010.34.4911.
[5] KOTAKE K, KOYAMA Y, SHIDA S, et al. Neo-adjuvant chemotherapy with carmofur for colorectal cancer-a multi-institutional randomized controlled study [J]. Gan to Kagaku Ryoho, 2002, 29(11): 1917.
[6] Colorectal Cancer Chemotherapy Study Group of Japan-The 2nd Trial. Results of a randomized trial with or without 5-FU-based preoperative chemotherapy followed by postoperative chemotherapy in resected colon and rectal carcinoma [J]. Jpn J Clin Oncol, 2003, 33(6): 288-296.
[7] XU J, ZHONG Y, WWEIXIN N, et al. Preoperative hepatic and regional arterial chemotherapy in the prevention of liver metastasis after colorectal cancer surgery [J]. Ann Surg, 2007, 245(4): 583-590.
[8] ZHONG Y S, LU S X, XU J M. Tumor proliferation and apoptosis after preoperative hepatic and regional arterial infusion chemotherapy in prevention of liver metastasis after colorectal cancer surgery [J]. Zhonghua Wai Ke Za Zhi, 2008, 46(16): 1229-1233.
[9] OKABAYSHI K, HASEGAWA H, WATANABE M, et al. Usefulness of the preoperative administration of tegafur suppositories as alternative adjuvant chemotherapy for patients with resectable stage Ⅱ or Ⅲ colorectal cancer: a KODK4 multicenter randomized control trial [J]. Oncology, 2012, 83(1): 16-23. DOI: 10.1159/000337574.
[10] FOXTROT Collaborative Group. Feasibility of preoperative chemotherapy for locally advanced, operable colon cancer: the pilot phase of a randomised controlled trial [J]. Lancet Oncol, 2012, 13(11): 1152. DOI: 10.1016/S1470-2045(12)70348-0.
[11] 宋涛, 王铎, 肖嘎. 卡培他滨联合奥沙利铂术前新辅助化疗对结肠癌的临床疗效[J]. 贵州医科大学学报, 2017, 42(9): 1107-1110. DOI: 10.19367/j.cnki.1000-2707.2017.09.026.
SONG T, WANG D, XIAO G. Clinical efficacy of Capecitabine combined with Oxaliplation on preoperative neoadjuvant chemotherapy for colorectal cancer [J]. Journal of Guizhou Medical University, 2017, 42(9): 1107-1110. DOI: 10.19367/j.cnki.1000-2707.2017.09.026.
[12] 文新元, 雷雄, 肖本萍, 等. 可切除局部晚期结肠癌临床应用新辅助化疗的可行性分析[J]. 中国现代医学杂志, 2014, 24(14): 86-93.
WEN X Y, LEI X, XIAO B P, et al. Feasibility of preoperative chemotherapy for radiologically staged, locally advanced operable primary colon cancer [J]. China Journal of Modern Medicine, 2014, 24(14): 86-93.
[13] 胡志伟, 赖家骏, 黄钟情. 雷替曲塞联合奥沙利铂新辅助化疗对进展期结肠癌手术患者的疗效研究[J]. 临床医学工程, 2017, 24(9): 1211-1212. DOI: 10.3969/j.issn.1674-4659.2017.09.1211.
HU Z W, LAI J J, HUANG Z Q, et al. Study on the ccurative effect of raltitrexed combined with Oxaliplatin neoadjvant chemotherapy in patients undergoing advanced colorectal cancer surgery [J]. Clinical Medicine Engineering, 2017, 24(9): 1211-1212. DOI: 10.3969/j.issn.1674-4659.2017.09.1211.
[14] 王雅辉, 杨希恩. 手术前化疗对结肠癌患者手术及预后的影响[J]. 中国肿瘤临床与康复, 2013, 20(9): 1029-1030. DOI: 10.13455/j.cnki.cjcor.2013.09.045.
[15] TAZI E M, ESSADI I, BOUTAYEB S, et al. Biotherapy in the adjuvant treatment of colorectal cancer [J]. Gastroenterol Res, 2011,4(4): 162-167.
[16] JAKOBSEB A, ANDERSEN F, FISHHER A, et al. Neoadjuvant chemotherapy in locally advanced colon cancer. A phase II trial [J]. Acta Oncol, 2015, 54(10): 1-7. DOI: 10.3109/0284186X.2015.1037007.
[17] LIU F, YANG L, WU Y, et al. CapOX as neoadjuvant chemotherapy for locally advanced operable colon cancer patients: a prospective single-arm phase II trial [J]. Chin J Cancer Res, 2016, 28(6): 589-597. DOI: 10.21147/j.issn.1000-9604.2016.06.05.
[18] ZHOU H, SONG Y, JIANG J, et al. A pilot phase Ⅱ study of neoadjuvant triplet chemotherapy regimen in patients with locally advanced resectable colon cancer [J]. Chin J Cancer Res, 2016, 28(6): 598-605. DOI:10.21147/j.issn.1000-9604.2016.06.06.
[19] HUANG C M, HUANG M Y, MA C J, et al. Neoadjuvant FOLFOX chemotherapy combined with radiotherapy followed by radical resection in patients with locally advanced colon cancer [J]. Radiat Oncol, 2017, 12(1): 48. DOI: 10.1186/s13014-017-0790-3.
[20] DEHAL A, GRAFFBAKER A N, VUONG B, et al. Neoadjuvant Chemotherapy Improves Survival in Patients with Clinical T4b Colon Cancer [J]. J Gastrointest Surg, 2017, 152(5): 1-8. DOI: 10.1007/s11605-017-3566-z.
[21] 邢娟. 不同新辅助化疗方案对结直肠癌患者生存质量的前瞻性非随机观察研究[J]. 胃肠病学和肝病学杂志, 2015, 24(1): 37-39. DOI: 10.3969/j.issn.1006-5709.2015.01.011.
XING J. A prospective non-randomized observational study on the life quality of patients with colorectal cancer of neoadjvant chemotherapy [J]. Chin J Gastroenterol Hepatol, 2015, 24(1): 37-39. DOI: 10.3969/j.issn.1006-5709.2015.01.011.

