利用qRT-PCR技术对PVY重组株系的鉴定
尚 慧,韩树鑫,高艳玲,,张 威,范国权,申 宇,聂先舟,吕文河*,白艳菊,2*
(1.东北农业大学农学院,黑龙江 哈尔滨 150030;2.黑龙江省农业科学院克山分院,黑龙江 齐齐哈尔 161005;3.黑龙江省农业科学院植物脱毒苗木研究所,黑龙江 哈尔滨 150086;4.加拿大农业部马铃薯研究中心, 加拿大 弗莱德里克顿 E3B4Z7)
【研究意义】马铃薯作为中国第四大粮食作物,重要的经济和蔬菜作物,随着其栽培面积的扩大, 主粮化观点的提出,在生产中提高其产量及品质变得至关重要。但日益严重突出的病害危害问题, 严重影响马铃薯的产量和品质, 制约着马铃薯生产的发展。其中马铃薯Y 病毒(Potato virus Y, PVY)是导致马铃薯病毒病发生的重要病毒,PVY几乎在所有的马铃薯种植区都有分布。PVY会导致马铃薯退化, 降低马铃薯产量,严重的减产可达80 %左右[1]。植株被PVY 侵染后,会出现花叶、叶脉坏死和垂叶条斑坏死等症状。我国PVY 带毒率,其南部显著高于北部,造成我国中部和南部的马铃薯种植区不能自行留种,必须从东北、内蒙古等发病较轻的地区调种或直接购买脱毒种薯, 这一举措使生产成本大幅提高,形成巨大损失。【前人研究进展】马铃薯Y病毒(Potato virus Y, PVY)是马铃薯Y 病毒科(Potyviridae)、马铃薯Y 病毒属(Potyvirus) 的代表种。PVY为正义单链RNA病毒,其基因组全长约9.7 kb,5’末端具有基因组连接蛋白(Virus-encoded genome linked protein, VPg ),3’末端有poly (A)尾巴,5’端和3’端均有非翻译区(Untranslational region, UTR)[2]。PVY全基因组包含一个大的开放阅读框(open reading frame, ORF),在基因表达时先翻译成一个大约3062个氨基酸的多聚蛋白,再通过自身编码的蛋白酶将多聚蛋白切割成10个成熟的蛋白。加工后的成熟蛋白从N端到C端分别为:P1,HC-Pro,P3,6K1,CI ,6K2,VPg,NIa,NIb,CP[3-4]。PVY 基因组中存在频繁发生的基因重组,基因重组在PVY的进化过程中是一种重要而有效的手段,这使得PVY 株系分化严重。根据寄主植物反应不同,已被广泛认可的PVY 株系种类常见的3种分别为:普通株系(ordinary strain,PVYO)、点刻斜条株系(stipple streak strain,PVYC)和叶脉坏死株系(necrotic strain,PVYN)。但随着种植区域的全球化,PVY存在频繁变异,不断有新的重组株系出现[5],并在全球的不同地区蔓延[6]。这些新分化出的株系一般被认为由PVYN和PVYO重组而来,主要包括PVYNTN和PVYN-Wi株系。PVYNTN及PVYN-Wi分别发现于匈牙利和波兰[7],但在很短的时间内,在其它地区的薯块中,2种株系亦能被检出[8-9]。从目前田间检测及研究来看,PVYN-Wi株系可以侵染很多的马铃薯品种,但在症状的表现上却没有PVYN严重,有些受侵染的植株甚至没有症状表现[10-11]。而PVYNTN则可以导致具有PVY敏感性的马铃薯品种产生块茎坏死症状[12]。同时,Ali等[13]研究发现PVY 叙利亚分离物的基因组具有明显的PVYNTN和PVYN-Wi株系的重组特征,故将其命名为PVYNTN-NW株系。PVYNTN-NW株系可对马铃薯生产造成较严重的影响,研究发现其可使马铃薯块茎产生PTNRD,这与PVYN-Wi株系并不相同。对PVY株系进行科学、合理的分类、划分,进行及时准确的鉴定,既有助于PVY的检测检疫,更有助于在马铃薯生产实践中做到及时的防病、抗病,对提高马铃薯脱毒种薯的质量及商品薯的产量有极大的帮助。随着现代植物病毒病原检测技术的发展,由于各种检测方法均存在这各自的不足且人们在生产中的要求的提高,我们迫切的需要一种高效、稳定并且更为灵敏的方法在生产中应用,而简单的通过酶联免疫吸附测定(ELISA)、Ig 指示试纸法、免疫电镜、反转录RT-PCR检测、核酸斑点杂交(Nucleic acid spot hybridization, NASH)等方法,已不能满足我们对PVY的检测。【本研究切入点】本实验引入实时荧光PCR技术(Real-Time PCR),应用于PVY检测中。qRT-PCR作为目前检测灵敏度最高(是普通RT-PCR的1000倍左右),同时具有高特异性、定量、便捷、快速、自动化等优点的技术,广泛应用于医学、微生物和动植物疾病检疫等领域[14-16]。本实验应用实时荧光PCR技术(qRT-PCR),可同时成功的鉴别出基因结构相似的PVYN-Wi和PVYNTN-NW2种株系。【拟解决的关键问题】为今后更方便快捷的鉴定株系提供理论基础;同时因其具有超高的灵敏度,可更快速、便捷、精准的对田间疑似感染PVY的苗期样品的鉴定提供技术支持,更好的提高马铃薯脱毒种薯的质量及商品薯的产量。
1 材料与方法
1.1 试验材料
试管苗由黑龙江省农业科学院植物脱毒苗木研究所保存,选择编号BDH-2即PVYN-Wi株系,编号2013-W-369-12即PVYNTN-NW株系作为试验样品。
1.2 主要试剂
RNA提取试剂盒采购于艾德莱生物公司,各种酶制剂,dNTP等试剂采购自宝生物工程(大连)有限公司、Promega公司和Invitrogen公司,PVYO、PVYN和PVY、PVX、PVS、PVM、PVA、PLRV 6种病毒的DAS-ELISA试剂盒采自Agdia公司。
1.3 DAS-ELISA检测
对所取的新鲜叶片,进行样品提取,同时对PVYO、PVYN株系和PVY、PVX、PVS、PVM、PVA、PLRV 6种病毒分别取2份阴性材料(保存的冻干粉样品),2份阳性材料(保存的冻干粉样品),进行酶联免疫吸附测定(DAS-ELISA),每份样品进行3次重复,分别进行PVYO、PVYN株系和PVY、PVX、PVS、PVM、PVA、PLRV 6种病毒检测。
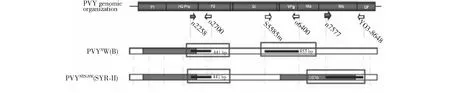
图1 PVY株系基因组结构多重PCR检测的引物位置(箭头)和预期产物(黑条)[7]Fig.1 Primer location (arrows) and expected products (black bar)[7]of genomic structure of PVY strains targeted by multiplex PCR assay
1.4 RNA的提取及cDNA的获得
利用PLANT pure通用植物总RNA快速提取试剂盒(艾德莱生物)提取样品叶片的总RNA,-20 ℃保存备用。2 μl总RNA进行反转录,得到cDNA,反转录使用TAKARA公司的反转录试剂盒,操作方法见说明书。
1.5 RT-PCR引物选择
根据2010年Ali[7]试验中对序列的分析总结(图1),选用其文中提到的n2258[17],o2700[7];S5585m[17],o6400[7]作为初步鉴定PVYN-Wi株系的特异扩增引物,n2258[17],o2700[7];n7577[7],YO3-8648[18]作为初步鉴定PVYNTN-NW株系的特异扩增引物(表1)。
1.6 RT-PCR扩增
利用多重RT-PCR方式完成扩增,进行PVY检测,PCR扩增采用25 μl体系,取上述反转录产物2 μl, 加5’端引物和3’端引物(10 μmol/L)各0.5 μl,10×PCR Buffer 2.5 μl,TaqDNA聚合酶0.15 μl, dNTP(2.5 mmol/L)0.25 μl, MgCl2(2.5 mol/L)2.6 μl,补水至25 μl。
PCR反应条件为:94 ℃ 5 min;94 ℃ 30 s,64 ℃ 30 s,72 ℃ 90 s,10个循环,94 ℃ 30 s,62 ℃ 30 s,72 ℃ 90 s,10个循环,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 90 s,10个循环;72 ℃ 5 min。PCR反应结束后取反应产物5 μl,利用1.0 %的琼脂糖凝胶电泳检测。
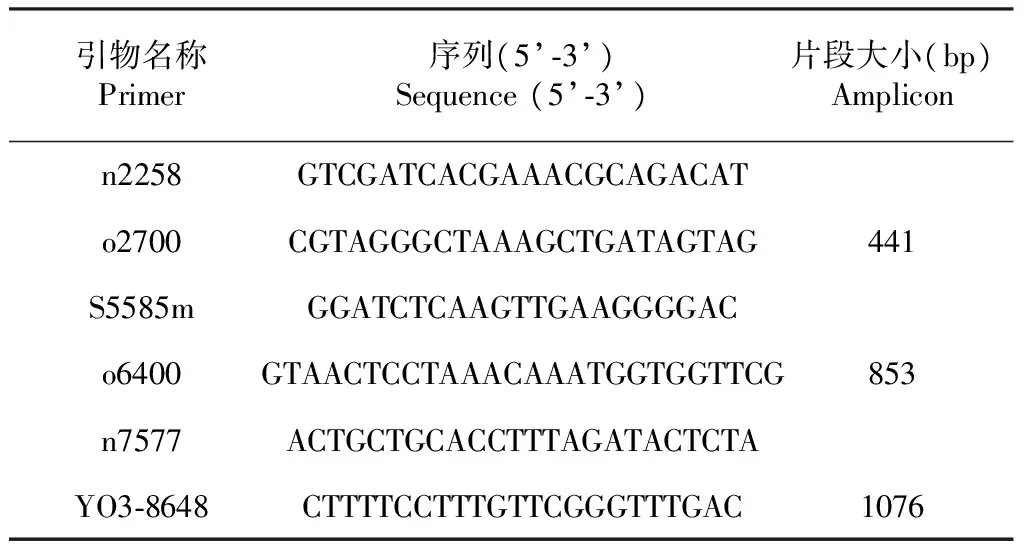
表1 本研究中所用引物Table 1 Primers used in this study
1.7 qRT-PCR引物的设计及合成
参考Boonham等[19]的方法(图2),通过Genebank查找马铃薯Y病毒PVYN-Wi和PVYNTN-NW株系的全基因组序列,并参照高芳銮等[20]对于PVY不同株系的基因组结构的分析,最终选择运用GenBank:KX184816作为PVYN-Wi株系的全基因组序列,GenBank:KY848008作为PVYNTN-NW株系的全基因组序列,根据比对结果,分别设计PVYN-Wi和PVYNTN-NW株系的qRT-PCR特异性引物(表2) ,引物送由生工生物工程(上海)有限公司合成,作为实时荧光定量PCR的引物。
1.8 qRT-PCR扩增
20 μl反应体系中, 取上述反转录产物2 μl, 加5’端引物和3’端引物(10 μmol/L)各0.4 μl,10×PCR Buffer 2 μl,TaqDNA聚合酶0.12 μl,dNTP(2.5 mmol/L)0.2 μl,MgCl2(2.5 mol/L)2 μl,染料(Eva-Green)1 μl,补水至20 μl。应条件为:94 ℃ 5 min;92 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,共40个循环;60~95 ℃测扩增产物的熔解曲线。

图2 PVY株系基因组序列比对[20]Fig.2 Genome sequence alignment of PVY strains[20]
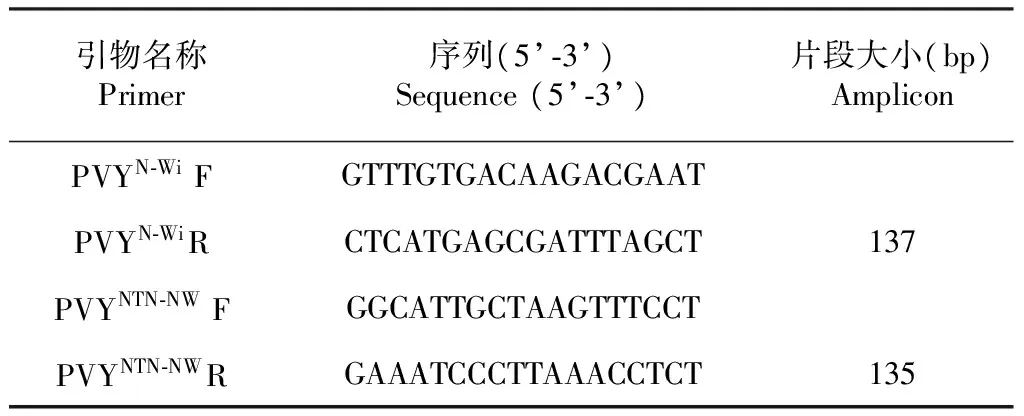
表2 引物设计Table 2 Design of primers
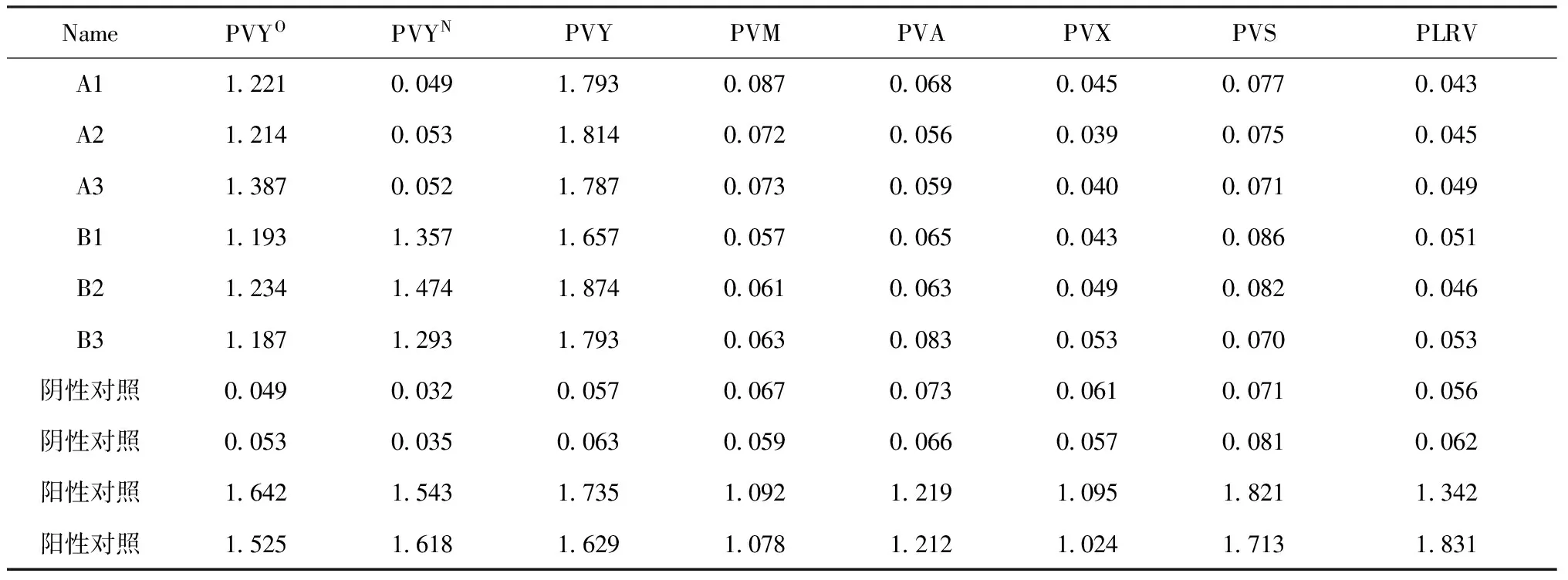
表3 样品的DAS-ELISA检测Table 3 DAS-ELISA test results of samples
注:A为BDH-2(PVYN-Wistrain)的样品(A1, A2, A3分别为3次重复); B为2013-W-369-12(PVYNTN-NWstrain)的样品(B1,B2,B3分别为3次重复)。
Note:A is the sample of BDH-2(PVYN-Wistrain; A1, A2, A3 are the three repetition of A); B is the sample of 2013-W-369-12(PVYNTN-NWstrain; B1,B2,B3 are the three repetition of B).
1.9 田间样品的qRT-PCR检测
通过对黑龙江地区进行田间普查,采集具有如花叶,脉坏死、斑块等显著PVY症状的马铃薯叶片样品,从中选出100份样品用于检测,置于-80 ℃冰箱中保存。利用所设计的qRT-PCR的引物,对留存的100份样品进行qRT-PCR检测。
2 结果与分析
2.1 PVYN-Wi、PVYNTN-NW株系样品的DAS-ELISA鉴定
利用PVYO、PVYN和PVY、PVX、PVS、PVM、PVA、PLRV 6种病毒的通用DAS-ELISA检测试剂盒对PVYN-Wi和PVYNTN-NW株系样品叶片的检测结果见表3, 其中,样品孔的OD405值大于阴性对照孔光密度值的2倍,即判为阳性反应。
所检测实验样品,对PVY检测显示为阳性,PVX、PVS、PVM、PVA、PLRV均为阴性,可初步证明,保存的试管苗没有受到其他病毒污染。同时,BDH-2和2013-W-369-12样品对于PVYO检测均表现为阳性,2013-W-369-12样品PVYN检测结果为阳性,BDH-2的PVYN检测结果为阴性。
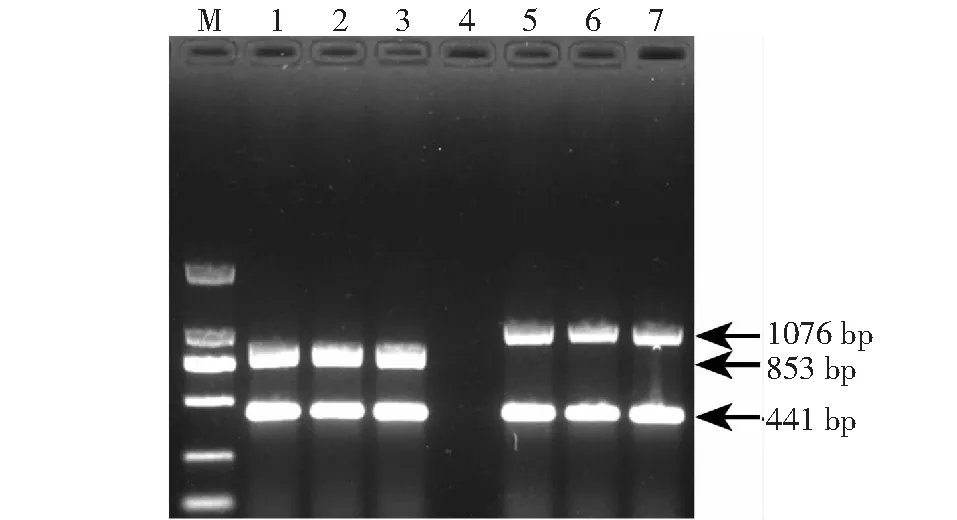
M:DNA marker;1,2,3列为BDH-2(PVYN-Wi strain)样品的条带; 5,6,7为2013-W-369-12(PVYNTN-NW strain)的样品的条带图3 样品的PCR检测Fig.3 Results of PCR detection for samples
2.2 PVYN-Wi、PVYNTN-NW株系样品的RT-PCR检测
用选择的相应引物对PVYN-Wi和PVYNTN-NW株系的样品叶片,6份样品进行RT-PCR检测,实验结表明,BDH-2样品,可以同时扩增出约400 和800 bp左右的产物,与方法中的PVYN-Wi株系检测结果一致,说明BDH-2为PVYN-Wi株系;而2013-W-369-12样品,则同时扩增出约400 和1000 bp左右的产物,与方法中的PVYNTN-NW株系检测结果一致,说明2013-W-369-12的样品为PVYNTN-NW株系 (图3)。
2.3 PVYN-Wi、PVYNTN-NW株系样品的qRT-PCR检测
利用设计的PVYN-Wi和PVYNTN-NW株系的特异性引物对试验中的6份样品,进行qRT-PCR检测,实验结果表明,PVYN-Wi株系的叶片样品的溶解曲线峰值为(87.59±0.03) ℃,PVYNTN-NW株系的叶片样品的溶解曲线峰值为(84.78±0.15) ℃(图4~5)。

图4 PVYN-Wi株系溶解曲线Fig.4 Dissolve curves of PVYN-Wi strains
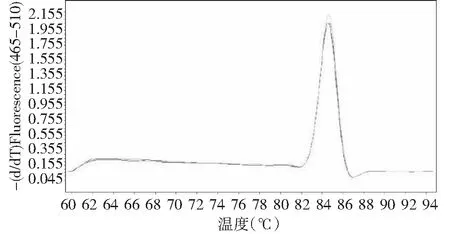
图5 PVYNTN-NW株系溶解曲线Fig.5 Dissolve curves of PVYNTN-NW strains
由实验结果可知,PVYN-Wi和PVYNTN-NW株系溶解曲线峰值不同,表明其具有不同的溶解温度。
2.4 样品验证
对随机采集的100份病毒症状的样品,运用本实验所设计的引物,进行多重qRT-PCR检测后,其中有32份样品,溶解曲线峰值为87.51 ℃左右,即这32份马铃薯样品,受到PVYN-Wi株系侵染;27份样品,溶解曲线峰值为84.78 ℃左右,表明这27份马铃薯样品,受到PVYNTN-NW株系侵染;同时存在9份样品,其溶解曲线存在84.78和87.51 ℃ 2个峰值,这9份样品可能同时受到PVYN-Wi、PVYNTN-NW株系的侵染(图6~7)。另32份样品,在87.51和84.78 ℃附近没有显著的峰值,故判定其没有受到PVYN-Wi、PVYNTN-NW株系侵染。同时对这100份样品进行DAS-FLISA和RT-PCR检测,实验结果和qRT-PCR一致。
3 讨 论
随着马铃薯Y病毒发病面积的逐步扩大,马铃薯的产量受到巨大影响,同时因其地理位置、气候等原因的改变,多种变异的产生,新的重组株系的出现,使科学家对其的研究热情也在逐步增加。
对于PVY的检测方法:①生物学方法。通过观察植株的相应病害症状,即指示植物接种后的表象症状观察及细胞超微结构的观察等。对于马铃薯本身,不同PVY株系在马铃薯品种上会引起不同的症状,对于叶片及叶脉可能产生花叶,脉坏死等,对于薯块可能产生PTNRD即马铃薯块茎坏死环斑病(potato tuber necrotic ringspot disease,PTNRD)[21]。另外,对于指示植物,PVY可在德伯尼烟、心叶烟、克利夫兰烟、光曼陀罗、番茄上引起相应的系统症状。因此可以根据这些相应症状及指示植物相应症状进行检测,但通过生物学检测方法,获得检测结果所需时间长,并且植物在不同的环境下会表现不同的症状,因而此方法很难用于大规模检测,大部分情况下还需结合电镜观察和血清学试验才能做出判断。②利用血清型划分PVY株系。可以利用O血清型特异单抗和N血清型特异单抗将PVY株系划分为O、N这2 组,PVYO、PVYC、PVYN-Wi、PVYN:O等株系对于O血清型特异单抗呈阳性;PVYN、PVYZ、PVYE、PVYNTN、PVYNA-N等株系对于N血清型特异单抗呈阳性[5,22]。但这种划分过于宽泛,还存在部分株系对两种抗体都表现为阳性,Ali等曾报道一个叙利亚的PVY分离物(PVY-12)可同时与这2 种特异单抗反应[9],即本文中提到的PVYNTN-NW株系就与这2种抗体都反应。目前市面上的许多血清型特异单抗可以和多个PVY株系反应,并不能完全用于PVY 株系的特异鉴定[22]。如果通过血清学方法对株系进行更好检测划分需要开发更优的特异单抗。③依据基因序列特征进行PVY 株系划分。随着PVY研究的深入,更多的PVY基因组序列的测定,PVY不同株系间的核苷酸序列差异逐渐明朗,最初利用PCR-RFLP(限制性片段长度多态性)技术和核酸分子杂交技术鉴定了PVYN株系[18,23]。随后依据各株系的特征性核苷酸位点差异,建立了PVY不同株系的一系列RT-PCR(反转录-聚合酶链式反应) 技术[24-27]。随着研究的深入,技术的进步,这些检测技术在发展过程中,逐渐出现一些不足需要完善。随之,qRT-PCR(实时荧光定量PCR) 技术的诞生,其优势显著,操作更加便捷,在PCR精准定性的基础上能够对样品进行定量检测,对样品的含毒量要求降低,在样品中病毒含量非常少、还未表现明显症状的情况下即可进行检测,可准确、及时的作出早期诊断[27],为日后的防病,控病提供数据支持,并有助于更好的提高商品薯的产量。
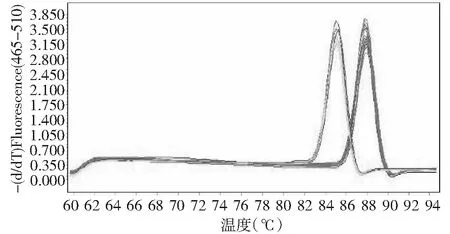
32份受PVYN-Wi株系侵染,27份受PVYNTN-NW株系侵染32 samples infected by PVYN-Wi strain, 27 samples infected by PVYNTN-NW strain 图6 检测样品溶解曲线Fig.6 Dissolution curves of tested samples
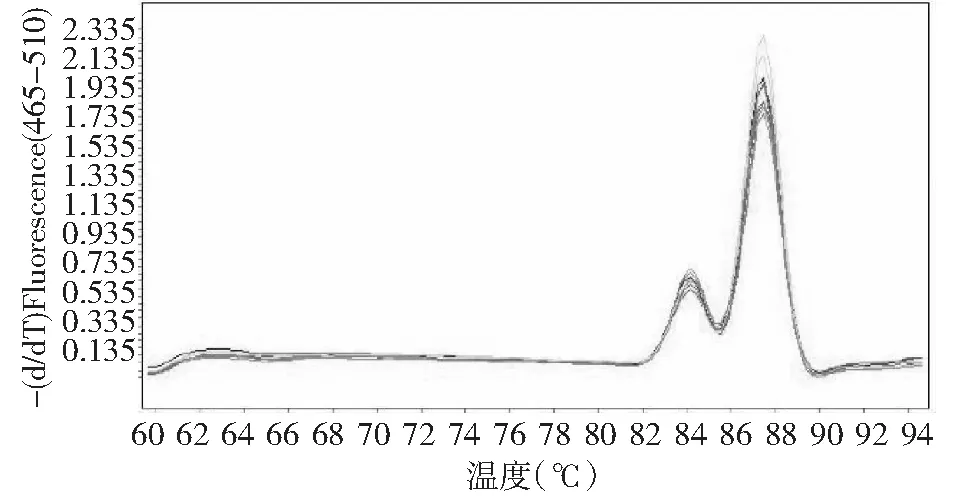
9份同时受PVYN-Wi、PVYNTN-NW株系侵染9 samples infected by PVYN-Wi and PVYNTN-NW strain图7 检测样品溶解曲线Fig.7 Dissolution curves of tested samples
近年来新发现的通过基因重组产生的亚株系,PVYNTN、PVYN-Wi、PVYN:O等重组株系,是PVYO和PVYN株系之间不同基因区段重组而成的[28]。采用本文设计的引物,对黑龙江省的样品进行检测,检测的结果表明PVYNTN-NW株系和PVYN-Wi株系的样品在田间的存在占较高的比例,与高芳銮等[29]对中国14个省PVY 分离物的检测鉴定结果相近,表明PVY 在马铃薯主要种植区普遍存在的多为重组株系,与沈林林等[30]采用多基因联合方法鉴定马铃薯Y 病毒株系的组成的结果,重组株系已经成为了田间的主流株系(100 %),包括PVYNTN-NW株系SYR-I 型、PVYNTN-NW株系SYR-II 型、PVYN-Wi株系和PVYE株系的结果相一致。
同时通过田间观察及检测来看,PVYN-Wi株系可侵染的马铃薯品种较多,但症状普遍较轻,有些甚至没有明显的症状表现[10-11]。而PVYNTN和PVYNTN-NW株系则可以导致部分对PVY敏感性的马铃薯品种产生重花叶,脉坏死甚至块茎坏死等症状[12]。PVY株系间因突变、缺失、插入、重组等原因,基因的遗传变异呈现多样化,尤其PVYN-Wi和PVYNTN-NW株系作为基因组结构极为相似的两种重组株系,但对马铃薯造成的症状和危害并不相同,故对马铃薯Y病毒,进行精准便捷的检测,鉴别其不同株系,变得至关重要。
对于PVY病毒的研究,重组株系被认为可能比非重组株系具有更强的致病力[28],并已在世界各马铃薯种植区越来越流行,因此生产上需要密切关注这些重组株系的发展动态。本文通过设计特异性引物,应用多重实时荧光定量PCR技术(qRT-PCR),成功并同时的鉴别出PVYN-Wi和PVYNTN-NW株系,为更方便快捷的鉴定株系提供了方法,但仍有很多我们需要去探索,希望在此基础上,对PVY株系的研究能够更好的继续深入下去。
[1]谷爱仙. 马铃薯病毒病及其防治[J]. 植物医生,1998,11(5):1-12.
[2]Fanigliulo A, Comes S, Pacella R, et al. Characterisation of potato virus Y nnp strain inducing veinal necrosis in pepper:a naturally occurring recombinant strain of PVY[J].Archives of Virology, 2005, 150(4):709-720.
[3]Carrington J C, Cary S M, Dougherty W G. Mutational analysis of tobacco etch virus polyprotein processing:cis and trans proteolytic activities of polyproteins containing the 49-kilodalton proteinase[J]. Journal of Virology, 1988, 62(7):2313-2320.
[4]Urcuqui-Inchima S, Haenni A L, Bernardi F. Potyvirus proteins:a wealth of functions[J]. Virus Research, 2001, 74(1-2):157.
[5]Singh R P, Valkonen J P, Gray S M, et al. Discussion paper:The naming of potato virus Y strains infecting potato[J].Archives of Virology, 2008, 153(1):1-13.
[6]Quenouille J, Vassilakos N, Moury B. Potato virus Y:a major crop pathogen that has provided major insights into the evolution of viral pathogenicity[J]. Molecular Plant Pathology, 2013, 14(5):439-452.
[7]Ali M C, Maoka T, Natsuaki K T, et al. The simultaneous differentiation of potato virus Y strains including the newly described strain PVYNTN-NWby multiplex PCR assay[J]. Journal of Virological Methods, 2010, 165(1):15-20.
[8]Kerlan C, Tribodet M, Glais L, et al. Variability of potato virus Y in potato crops in France[J]. Journal of Phytopathology, 1999, 147(12):643-651.
[9]Ali M C, Maoka T, Natsuaki K T. The occurrence and characterization of new recombinant isolates of PVY displaying shared properties of PVYNWand PVYNTN[J]. Journal of Phytopathology, 2007, 155(8):409-415.
[10]Chrzanowska M. New isolates of the necrotic strain of potato virus Y (PVYN) found recently in Poland[J]. Potato Research, 1991, 34(2):179-182.
[11]Glais L, Tribodet M, Kerlan C. Specific detection of the PVY(N)-Wvariant of potato virus Y[J]. Journal of Virological Methods, 2005, 125(2):131-136.
[12]Jejmvanden H, Raavander V, Verbeek M, et al. Characteristics of a resistance-breaking isolate of potato virus Y causing potato tuber necrotic ringspot disease[J]. European Journal of Plant Pathology, 1994, 100(5):347-356.
[13]Ali MC, Maoka T, Natsuaki T, et al. PVYNTN-NW, a novel recombinant strain of potato virus Y predominating in potato fields in Syria[J]. Plant Pathology, 2010, 59(1):31-41.
[14]Balka G, ákos Hornyák, ádám Bálint, et al. Development of a one-step real-time quantitative PCR assay based on primer-probe energy transfer for the detection of porcine reproductive and respiratory syndrome virus[J]. Journal of Virological Methods, 2009, 158(2):41-45.
[15]谢芝勋,谢丽基,庞耀珊,等. WSSV和IHHNV二重实时荧光PCR检测方法的建立[J]. 水生生物学报,2009,33(1):22-27.
[16]谢芝勋,谢丽基,刘加波,等. 禽流感和新城疫病毒二重荧光定量RT-PCR检测方法的建立[J]. 生物技术通讯, 2008,19(3):410-413.
[17]Lorenzen J H, Piche L M, Gudmestad N C, et al. A multiplex PCR assay to characterize potato virus Y isolates and identify strain mixtures[J]. Plant Disease, 2006, 90(7):935-940.
[18]Schubert J, Fomitcheva V, Sztangretwišniewska J. Differentiation of potato virus Y strains using improved sets of diagnostic PCR-primers[J]. Journal of Virological Methods, 2007, 140(1-2):66-74.
[19]Boonham N, Pérez L G, Mendez M S, et al. Development of a real-time RT-PCR assay for the detection of potato spindle tuber viroid[J]. Journal of Virological Methods, 2004, 116(2):139-146.
[20]高芳銮,常 飞,沈建国,等. PVYNTN-NW榆林分离物的全基因组序列测定与分析[J]. 中国农业科学,2015,48(2):270-279.
[21]Karasev A V, Gray S M. Continuous and emerging challenges of potato virus Y in potato[J]. Annual Review of Phytopathology, 2013, 51(51):571-586.
[22]Karasev A V, Gray S M. Genetic diversity of potato virus Y, complex[J]. American Journal of Potato Research, 2013, 90(1):7-13.
[23]Kerlan C, Nikolaeva O V, Hu X, et al. Identification of the molecular make-up of the potato virus Y strain PVYZ:genetic typing of PVY(Z)-NTN[J]. Phytopathology, 2011, 101(9):1052-1060.
[24]Rosner A, Maslenin L. Differentiating PVYNTNfrom PVYNby annealing to reference RNA transcripts[J]. Journal of Virological Methods, 2001, 97(1-2):125-131.
[25]Mallik I, Anderson N R, Gudmestad N C. Detection and differentiation of potato virus Y, strains from potato using immunocapture multiplex RT-PCR[J]. American Journal of Potato Research, 2012, 89(3):184-191.
[26]Rigotti S, Gugerli P. Rapid identification of potato virus Y strains by one-step triplex RT-PCR.[J]. Journal of Virological Methods, 2007, 140(2):90-94.
[27]Kogovsek P, Gow L, Pompe-Novak M, et al. Single-step RT real-time PCR for sensitive detection and discrimination of potato virus Y isolates[J]. Journal of Virological Methods, 2008, 149(1):1-11.
[28]史凤阳,高芳銮,沈建国,等. 马铃薯Y病毒福建分离物P1基因的分子变异和结构特征[J]. 遗传, 2014,36(7):713-722.
[29]高芳銮,沈建国,史凤阳,等. 中国马铃薯Y病毒的检测鉴定及CP基因的分子变异[J]. 中国农业科学,2013,46(15):3125-3133.
[30]沈林林,邹文超,高芳銮,等. 采用多基因联合方法鉴定福建长乐和福清产区马铃薯Y病毒株系组成[J]. 中国农业科学,2016,49(20):3918-3926.

