氨氮对异养硝化菌Acinetobactor sp.活性影响及动力学特性分析
王秀杰,王维奇,李 军,王思宇,张 晶,魏 佳,赵白航
氨氮对异养硝化菌sp.活性影响及动力学特性分析
王秀杰,王维奇,李 军*,王思宇,张 晶,魏 佳,赵白航
(北京工业大学建筑工程学院,北京 100124)
异养硝化菌株sp.JQ1004能够在初始氨氮浓度为0~2000mg/L范围内进行生长和氮源代谢,菌株在初始氨氮浓度为2500mg/L条件下被完全抑制,无法生长.当菌株在温度为30℃, pH7.5,转速为160r/min,初始氨氮浓度分别为100,300,500, 700,1000,1500,2000,2500mg/L条件下培养时,菌株的最大比生长速率分别为0.251, 0.308, 0.286, 0.243, 0.197, 0.115, 0.088h-1,相应的最大比氨氮降解速率分别为1.335, 1.906, 1.859, 1.759, 1.562, 1.286, 0.965g/(gDCW·d).在高浓度氨氮和游离氨的抑制作用下,菌株的比生长速率及对氨氮的比降解速率随初始氨氮浓度的增加呈先增加后降低的趋势.3种基质抑制动力学模型(Haldane, Yano, Aiba模型)均能够很好地模拟菌株随初始氨氮浓度的生长变化规律,对应地相关系数分别为0.9944,0.9983和0.9929.由Haldane模型可知,菌株在不同初始氨氮浓度(游离氨)条件下的最大氨氮比降解速率max为2.604h-1,基质亲和系数s为22.57mg/L,基质抑制系数i为1445.31mg/L.其中由i值远大于自养菌(硝化细菌及厌氧氨氧化菌等)的值,这表明异养硝化菌株sp.JQ1004比自养菌具有更强的抗抑制能力.另外,菌株在游离氨浓度为5.436mg/L时,比生长速率达到最大值0.583h-1.以上研究结果表明,菌株JQ1004在处理高氨氮废水中具有潜在的应用前景.
异养硝化;动力学;高氨氮;氨氮抑制
近年来,对高氨氮废水的处理已成为污水处理的一个难点.高氨氮废水若处理不当直接排入受纳水体,会造成水体富营养化等问题,对环境造成严重危害.通常,将含氨氮浓度超过500mg-N/L的废水称为高氨氮废水[1].高氨氮废水主要来源于垃圾渗滤液[2]、养殖废水[3]、焦化废水[4]等.由于生物处理工艺具有能耗低、效率高等优点,已经被越来越多应用于高氨氮废水的处理中.常用的工艺有短程硝化[5]、同步硝化反硝化(SND)[6]等以及它们的一些组合工艺.这些传统生物处理工艺大多数依赖于自养型好氧/厌氧菌(硝化菌、厌氧氨氧化菌等),由于自养菌的世代周期长,且抗氨氮及有机碳等冲击负荷能力差,导致了生物处理系统的不稳定性[7].
Verstraete等[8]在1972年从自然界中成功分离出第一株异养硝化菌sp.之后, Robertson和Kuenen[9]又从活性污泥中分离出了一株同时兼有异养硝化和好氧反硝化功能的菌株(现已更名).在这之后越来越多异养硝化好氧反硝化菌株被分离出来,如CF-S27[10],Y-11[11],YB[12]等.很多异养硝化好氧反硝化菌株具有能够在高浓度氨氮条件下生长代谢的特点[13].研究者们利用这一特点将该类异养硝化好氧反硝化菌应用于高氨氮废水的处理中.Joo等[14]将异养硝化菌株strain No. 4应用于实际的养猪废水处理中,并取得了很好的去除效果.Chen等[15]建立一个处理高盐高氨氮废水的生物脱氮系统,并实现了稳定运行,利用PCR-DGGE技术检测到系统中优势菌株为异养硝化好氧反硝化菌和.菌株等[16]被以生物添加的方式应用于SBR工艺中处理高氨氮废水并同样取得了很好的效果.以上工艺的建立均表明,异养硝化好氧反硝化菌株在处理高氨氮废水中具有很好的应用前景.本研究通过批式实验研究了菌株在不同初始氨氮浓度条件下的生长及代谢规律,并确定了氨氮及游离氨浓度对菌株的抑制动力学模型,以期为菌株在处理高氨氮废水中的应用提供基础.
1 材料与方法
1.1 实验菌株和培养基
1.1.1 菌株来源 实验菌株sp. JQ1004为一株异养硝化好氧反硝化菌[17],分离自北京市高碑店污水厂中试设备的活性污泥,已被证实能够在好氧条件下,以琥珀酸钠为碳源,分别以氨氮和硝氮为氮源进行生长代谢.当氨氮作为唯一氮源时,菌株能够迅速利用氨氮和有机碳进行生长代谢, 当培养基中不添加有机碳源时,菌株JQ1004无法生长,这表明菌株具有异养硝化作用.另外,菌株JQ1004能够在好氧条件下,以硝氮为氮源进行生长代谢,这表明菌株具有好氧反硝化作用.
1.1.2 培养基 实验用培养基为异养硝化培养基[12],其配方为(NH4)2SO40.47g,(CH2COONa)2·6H2O4.219g, 50mL维氏盐溶液, 950mL超纯水,通过改变加入(NH4)2SO4的质量改变培养基初始氨氮浓度,固定TOC/TN=7.5.维氏盐溶液配方为K2HPO4·3H2O 6.55g, MgSO4·7H2O 2.5g, NaCl 2.5g, MnSO4·H2O 0.038g, FeSO4·7H2O 0.05g, 1000mL超纯水.培养基在使用前用Na2HPO4和NaH2PO4缓冲溶液调整pH=7.5,121℃高压蒸汽灭菌15min.平板培养基需加入1.5%~2%琼脂粉.
1.2 批次实验
1.2.1 不同初始氨氮条件下菌株降解实验 将新鲜平板培养基上生长茁壮的单菌落接种于液体异养硝化培养基中进行活化,然后8000r/min离心5min收集菌体,用磷酸缓冲溶液反复洗涤3次,重悬于无菌水中作为接种液,固定接种液OD600值约0.5.菌株在不同初始氨氮浓度条件下的降解实验设置8个批次,初始氨氮浓度分别设定为:100,300,500,700,1000,1500,2000,2500mg/L.每个批次均设置不加接种液的空白组作为对照.培养条件为30℃,160r/min.定时取样测定氨氮、硝氮、亚氮、COD浓度以及菌悬液OD600值,数据测定3次取平均值.
1.2.2 细胞浓度的测定[18]首先通过实验确定菌株细胞浓度(细胞干重,mg/L)与菌悬液吸光度(OD600)之间的标准曲线.以液体培养基做空白,在600nm波长下测定菌悬液的吸光度,再根据标准曲线将OD600值换算为细胞干重(mg/L).细胞干重采用干燥法测定.
1.2.3 菌株比生长速率、氨氮比降解速率、产率系数以及游离氨浓度的计算[19-20]
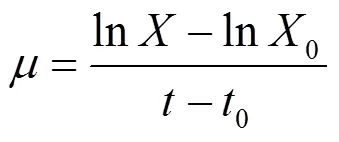
式中:为菌株的比生长速率,h-1;为时刻时菌株的细胞浓度,mg/L;0为0时刻细胞浓度,mg/L;0为菌株培养任一阶段的初始时刻,h;为菌株培养任一阶段的结束时刻,h.
= -[(0-)/(0-)]/0(2)
式中:为比降解速率, g/(g DCW·d);0为初始时刻0氨氮浓度,mg/L;为时刻氨氮浓度, mg/L;0为0时刻菌株的细胞浓度,mg/L; DCW为细胞干重.

式中:为产率系数, mg DCW/mg N;0为初始时刻细胞浓度, mg/L;为结束时刻细胞浓度, mg/L;0为初始时刻氨氮浓度, mg/L;为结束时刻氨氮浓度, mg/L.

1.3 分析项目和方法
NH4+-N:纳氏试剂分光光度法; NO2--N: N-(1-萘基)-乙二胺分光光度法; NO3--N:麝香草酚分光光度法; CODcr:重铬酸钾法; OD600值:分光光度法; pH值、温度: WTW/Multi3420便携式测定仪.
2 结果与讨论
2.1 不同初始氨氮浓度对菌株活性及基质降解速率的影响

(A)~(G)初始氨氮浓度分别为100,300,500,700,1000,1500,2000mg/L

表1 不同初始氨氮浓度下菌株的比生长速率及氨氮比降解速率
注:温度为30℃, pH值约为7.5.
图1展示了菌株在不同初始氨氮浓度条件下,菌株对碳源和氮素的降解以及菌株自身细胞浓度的变化情况.在不同初始氨氮浓度条件下菌株细胞浓度的增长规律均为先经过一定时间的迟滞期,且初始氨氮浓度越大迟滞期越长,之后进入对数生长期,在此时期菌株的比生长速率达到最大.表1显示了不同初始氨氮浓度条件下,菌株的最大比生长速率、氨氮比降解速率以及在最大比生长速率发生时间段内菌株的产率系数值.由此可知,当初始氨氮浓度设置为100~2500mg/L时,菌株的比生长速率随氨氮浓度的增加而降低,并且在浓度为2500mg/L时,菌株被完全抑制.相应地,菌株对氨氮的比降解速率规律也是随初始氨氮浓度的增加呈降低趋势.菌株在初始氨氮浓度为100mg/L时,比生长速率及比降解速率达到最大,分别为0.308h-1,2.021g/(g DCW·d).Zhang等[21]研究了菌株WSW-1001在初始氨氮浓度分别为5~1000mg/L时,菌株的代谢规律,得到了同样的规律,菌株在初始氨氮浓度越低时,生长及降解速率越快.与已报道过的异养硝化好氧反硝化相比,菌株JQ1004的最大比生长速率大于菌株sp. S1(最大比生长速率为0.186h-1)[22],菌株No.4(最大比生长速率为0.2h-1)[23]等.
图1还展示了菌株在不同初始氨氮浓度下,菌株对氨氮的降解特性.由表1可知,当初始氨氮浓度设置为100~2500mg/L时,菌株对氨氮的比降解速率随初始氨氮浓度增加而降低,这与比生长速率的变化趋势一致.由表1可知,当初始氨氮浓度为100,300,500,700,1000,1500,2000mg/L时,菌株对氨氮的比降解速率分别为2.021,1.960, 1.859,1.759,1.562,1.286,0.965[g/g DCW·d]].另外,实验表明菌株可在0~2000mg NH4+-N/L条件下生长,在氨氮浓度为2500mg/L时,菌株的生长被完全抑制.许多研究已表明,异养硝化好氧反硝化菌能够在高负荷氨氮浓度下进行生长繁殖.例如,Joo等[14]研究表明,菌株可在1200mg N/L的条件下生长;Ren等[24]研究发现,菌株YB在1000mg N/L条件下仍然可以有较高地生长速率;菌株sp. Y1-5[25]等被证实了可以在初始氨氮为1600mg N/L条件下生长.同时,由图1可知,菌株在进行代谢的过程中需要较多的碳源,即培养基中有较高COD浓度.由图1可知,COD浓度的变化与氨氮浓度的变化一致,即先经过一定的缓慢迟滞期,菌株进入对数生长期后,COD浓度迅速被降解,最后进入稳定期后氮素和碳源降解速率缓慢降低,直到菌株停止生长.在菌株生长过程中,均未检测到亚氮和硝氮的浓度变化.分析原因可能为以氨氮为氮源时,亚氮和硝氮作为中间产物在代谢过程中被迅速转化并未产生积累;另一原因可能为菌株将氨氮直接转化为气态氮,并未转化为硝氮或亚氮等中间产物.
2.2 不同初始氨氮浓度条件下菌株的降解动力学特性分析

表2 各种动力学模型参数的估计值
注:max为不同初始氨氮浓度条件下菌株的最大比生长率;s为基质亲和常数;i为基质抑制常数;为Yano模型中的常数.
高负荷氨氮浓度会对菌株本身产生毒害作用从而抑制其对氨氮地降解.为探究最佳拟合模型,用3种不同的基质抑制动力学模型(Haldane模型, Aiba模型, Yano模型)来描述菌株对氨氮的比降解速率随初始氨氮浓度(0~ 2000mg N/L)的变化,拟合后得到的动力学参数及相关系数(R)如表2所示.由图2可知,3种模型均能很好地模拟实验数据,相关系数(2)分别为0.9944,0.9983和0.9929. 3种模型的变化趋势均为菌株对氨氮的比降解速率随氨氮浓度的上升呈先上升后下降的趋势,由Haldane模型可知,菌株JQ1004对氨氮的最大比降解速率为2.604g/(gDCW·d),发生最大比降解速率时的底物浓度可通过公式计算:

在Haldane模型中,Ks为基质亲和常数,Ks值越小,则酶与底物的亲和力越大,本实验中Ks值为22.57mg/L,这表明菌株中含有的氨氧化酶与氨氮有较高的亲和力;另外,Ki为基质抑制常数, Ki值越小表明基质对菌株的抑制作用越强,反之,越大表示菌株的抗抑制能力越强[26].本研究中,异养硝化菌株Acinetobactor sp.JQ1004的Ki为1445.31mg/L,其值远大于自养硝化菌[27][Ki为(59±5)mg/L],厌氧氨氧化菌[28](Ki为67.234mg/L),这表明菌株JQ1004具有更强的抗抑制能力,原因可能是菌株为异养好氧菌,与自养菌相比有更短的世代周期,且对环境的耐受性更强.
2.3 不同浓度游离氨对菌株活性的抑制作用
由Haldane模型拟合结果可知,菌株在不同初始氨氮浓度条件下对氨氮的降解呈先增加后降低的趋势.原因是在一定浓度范围内,底物浓度的增加促进了菌株的生长代谢,当底物浓度过高时会对菌株活性产生抑制.而高浓度氨氮对菌株产生抑制的原因是氨氮在环境中形成较高浓度的游离氨,过高的游离氨浓度会对菌株活性及生长产生抑制.为分析游离氨对菌株生长的抑制规律,采用Haldane模型模拟菌株在不同浓度游离氨条件下菌株的比生长速率变化情况.由图3可知,在不同初始游离氨浓度条件下,菌株的比生长速率随初始游离氨浓度的增加呈先增加而后降低的趋势.这是由于氨氮在微碱性环境中形成了一定浓度的游离氨,较低浓度的游离氨有利于氨单加氧化酶的氧化[29],而过高浓度的游离氨会对菌株产生一定的抑制作用[20].基质抑制动力学模型Haldane模型很好地模拟了其生长规律,相关系数2为0.956.由公式计算可知,菌株在游离氨浓度为

时,菌株达到最大比生长速率为0.583h-1.当游离氨浓度超过该浓度时会对菌株产生抑制作用.
3 结论
3.1 菌株JQ1004能够在高氨氮负荷(100~ 2000mg NH4+-N/L)条件下进行生长繁殖,并对氨氮具有一定的降解作用,在初始氨氮浓度为2500mg/L时,菌株生长被完全抑制.并且,菌株的生长与对氨氮的代谢速率随初始氨氮浓度增加而降低.
3.2 Haldane模型、Aiba模型以及Yano模型能够很好地拟合菌株在不同初始氨氮浓度条件下的降解动力学特性,相关系数(2)均在0.99以上.由Haldane模型可知,菌株在初始氨氮浓度为180.61mg/L时,氨氮比降解速率最大值2.604g/ (gDCW·d).由i值可知,与自养菌相比,异养硝化菌JQ1004对氨氮具有更强抗抑制能力.
3.3 Haldane模型同样能够较好的拟合初始游离氨(FA)浓度对菌株比生长速率的影响,相关系数2为0.956.菌株的生长随FA浓度的增加而减慢,在FA浓度为5.436mg/L时,比生长速率达到最大值0.583h-1.
[1] 孙锦宜.含氮废水处理技术与应用[M]. 北京:化学工业出版社, 2003.
[2] Liu J, Luo J, Zhou J, et al. Inhibitory effect of high-strength ammonia nitrogen on bio-treatment of landfill leachate using EGSB reactor under mesophilic and atmospheric conditions [J]. Bioresource Technology, 2012,113:239-243.
[3] Wang S, Wang L, Deng L, et al. Performance of autotrophic nitrogen removal from digested piggery wastewater [J]. Bioresource Technology, 2017,241:465-472.
[4] Ahmad M, Liu S, Mahmood N, et al. Synergic adsorption– biodegradation by an advanced carrier for enhanced removal of high-strength nitrogen and refractory organics [J]. ACS Applied Materials & Interfaces, 2017,9(15):13188-13200.
[5] Ren Y, Yan L, Hao G, et al. Shortcut nitrification treatment of high strength ammonia nitrogen wastewater by aerobic granular sludge [J]. Journal of the Chemical Society of Pakistan, 2016,38(6):1222-1222.
[6] Sun X, Zhang H, Cheng Z. Use of bioreactor landfill for nitrogen removal to enhance methane production through ex situ simultaneous nitrification-denitrification and in situ denitrification [J]. Waste Management, 2017,66:97-102.
[7] Tang C J, Zheng P, Wang C H, et al. Performance of high-loaded ANAMMOX UASB reactors containing granular sludge [J]. Water Research, 2011,45(1):135-144.
[8] Verstraete W, Alexander M. Heterotrophic nitrification bysp [J]. Journal of Bacteriology, 1972,110(3):955-961.
[9] Robertson L A, Kuenen J G.gen. nov. sp. nov., a facultatively anaerobic, facultatively autotrophic sulphur bacterium [J]. Microbiology, 1983,129(9):2847-2855.
[10] Padhi S K, Tripathy S, Mohanty S, et al. Aerobic and heterotrophic nitrogen removal byCF-S27 with efficient utilization of hydroxylamine [J]. Bioresource Technology, 2017,232:285-296.
[11] He T, Li Z, Sun Q, et al. Heterotrophic nitrification and aerobic denitrification byY-11without nitrite accumulation during nitrogen conversion [J]. Bioresource Technology, 2016,200:493-499.
[12] Yang L, Ren Y X, Liang X, et al. Nitrogen removal characteristics of a heterotrophic nitrifierYB and its potential application for the treatment of high-strength nitrogenous wastewater [J]. Bioresource Technology, 2015,193:227-233.
[13] Taylor S M, Yiliang H, Bin Z, et al. Heterotrophic ammonium removal characteristics of an aerobic heterotrophic nitrifying- denitrifying bacterium,YL [J]. Journal of Environmental Sciences, 2009,21(10):1336-1341.
[14] Joo H S, Hirai M, Shoda M. Piggery wastewater treatment usingstrain No. 4with heterotrophic nitrification and aerobic denitrification [J]. Water Research, 2006,40(16):3029-36.
[15] Chen J, Han Y, Wang Y, et al. Start-up and microbial communities of a simultaneous nitrogen removal system for high salinity and high nitrogen organic wastewater via heterotrophic nitrification [J]. Bioresource Technology, 2016,216:196-202.
[16] Phatak P S, Trivedi S, Garg A, et al. Start-up of sequencing batch reactor withfor treatment of high- strength nitrogenous wastewater and sludge characterization [J]. Environmental Science and Pollution Research, 2016,23(20):20065-20080.
[17] 王秀杰,王维奇,李 军,等.异养硝化菌sp.的分离鉴定及其脱氮特性研究[J] 中国环境科学, 2017,37(11):4241-4250.
[18] Yan J, Wen J, Li H, et al. The biodegradation of phenol at high initial concentration by the yeast[J]. Biochemical Engineering Journal, 2005,24(3):243-247.
[19] Medhi K, Singhal A, Chauhan D K, et al. Investigating the nitrification and denitrification kinetics under aerobic and anaerobic conditions byISTOD1 [J]. Bioresource Technology, 2017,242:334-343.
[20] Anthonisen A C, Loehr R C, Prakasam T B, et al. Inhibition of nitrification by ammonia and nitrous acid [J]. Journal - Water Pollution Control Federation, 1976,48(5):835.
[21] Zhang S, Sha C, Jiang W, et al. Ammonium removal at low temperature by a newly isolated heterotrophic nitrifying and aerobic denitrifying bacteriumwsw- 1001 [J]. Environmental Technology, 2015,36(19):2488-2494.
[22] Sun Z, Lv Y, Liu Y, et al. Removal of nitrogen by heterotrophic nitrification-aerobic denitrification of a novel metal resistant bacteriumsp. S1 [J]. Bioresource Technology, 2016,220:142-150.
[23] Joo H S, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification byNo.4 [J]. Journal of Bioscience and Bioengineering, 2005,100(2):184-191.
[24] Ren Y X, Yang L, Liang X. The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium,YB [J]. Bioresource Technology, 2014,171:1-9.
[25] Li Y, Wang Y, Fu L, et al. Aerobic-heterotrophic nitrogen removal through nitrate reduction and ammonium assimilation by marine bacteriumsp. Y1-5 [J]. Bioresource Technology, 2017,230:103-111.
[26] Deng X, Wei C, Ren Y, et al. Isolation and identification ofsp. DN-06and evaluation of its pyridine degradation kinetics [J]. Water, Air, & Soil Pollution, 2011, 221(1-4):365.
[27] Ouyang Y, Norton J M, Stark J M. Ammonium availability and temperature control contributions of ammonia oxidizing bacteria and archaea to nitrification in an agricultural soil [J]. Soil Biology and Biochemistry, 2017,113:161-172.
[28] 李 芸,熊向阳,李 军,等.膜生物反应器处理晚期垃圾渗滤液亚硝化性能及其抑制动力学分析[J]. 中国环境科学, 2016, 36(2):419-427.
[29] Mével G, Prieur D. Heterotrophic nitrification by aspecies as influenced by different culture conditions [J]. Canadian Journal of Microbiology, 2000,46(5):465-473.
Inhibition of initial ammonia and free ammonia nitrogen onsp. and their biokinetics.
WANG Xiu-jie, WANG Wei-qi, LI Jun*, WANG Si-yu, ZHANG Jing, WEI Jia, ZHAO Bai-hang
(The College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 100124, China)., 2018,38(3):943~949
The strain JQ1004 with capability of heterotrophic nitrification were able to grow and metabolism under different initial ammonium concentrations in range of 0~2000mg/L. However, the strain were completely inhibited in concentration of 2500mg/L. When strain JQ1004 was cultivated at 30℃, pH 7.5, 160rpm with the initial ammonium of 100, 300, 500, 700, 1000, 1500, 2000mg/L, the maximum specific growth rates were 0.251, 0.308, 0.286, 0.243, 0.197, 0.115, 0.088h-1, and the corresponding ammonium specific removal rates reached 1.335, 1.906, 1.859, 1.759, 1.562, 1.286, 0.965g/g (DCW·d), respectively. Due to the inhibition of free ammonia and high-strength concentration of ammonium, the specific growth rate and degradation rate of ammonia increased at first and decreased with the increase of initial concentration of ammonia nitrogen (free ammonia). Three kinetic models (Haldane, Yano, Aiba) were fitted well to the experimental growth kinetic data with the correlation coefficients (2) of 0.9944,0.9983 and 0.9929. For Haldane model, the values ofmax,s, andiwere 2.604h-1, 22.57mg/L, and 1445.31mg/L, respectively. The large values ofi, far greater than that of autotrophic nitrifiers or anaerobic ammonium-oxidizing bacteria, indicated that JQ1004 had good tolerance against high ammonium concentrations. Besides, the specific growth rate reached a maximum value of 0.583h-1when the concentration of free ammonia was 5.436mg/L.These results indicated possible future applications of JQ1004 in removing nitrogen and organic carbon from high-strength ammonium wastewater.
heterotrophic nitrification;biokinetics;high-strength ammonium;ammonia inhibition
X703.5
A
1000-6923(2018)03-0943-07
王秀杰(1991-),女,山东潍坊人,博士研究生,主要从事生物脱氮及环境分子生物学研究.发表论文2篇.
2017-08-06
国家水体污染控制与治理科技重大专项(2014ZX07201-011);16人才培养质量建设-双培养计划新兴专业建设(004000542216031)
* 责任作者, 教授, 18810925108@163.com

