绝经后女性原发性高血压患者颈动脉斑块稳定性与LP-PLA2、A-FABP和hs-CRP的关系
渠莉,刘霞,闫晓艳,韦涌涛
研究发现,女性绝经期前高血压和动脉硬化发病率普遍低于年龄相匹配的男性,而绝经后发病风险均明显增加。随着动脉硬化炎症机制研究的深入,一些新的炎症标志物如血清脂蛋白相关磷脂酶A2(LP-PLA2)、脂肪细胞型脂肪酸结合蛋白(A-FABP)被发现,其水平升高会增加心血管事件的风险,且在男性与女性中获得的结果无差异[1,2]。本研究分析了绝经后女性高血压患者颈动脉斑块与LP-PLA2、A-FABP水平的关系。
1 资料与方法
1.1 研究对象 选择2014年8月~2015年11月于青岛市第八人民医院住院的女性原发性高血压患者125例,年龄55~81岁,平均(65.98±7.47)岁。入选标准:均绝经≥5年;符合《中国高血压防治指南2010》中高血压的诊断[3]:在未服用抗高血压药的情况下,收缩压≥140 mmHg和(或)舒张压≥90 mmHg(1 mmHg=0.133kPa);既往有高血压病史,目前正服用降压药,血压虽未达到上述水平,亦可诊断为高血压;均行彩色多普勒超声检查确定有颈动脉斑块形成。排除标准:继发性高血压、冠状动脉粥样硬化性心脏病(冠心病)、心功能不全;肝、肾功能不全、脑血管疾病、外周血管疾病、内分泌疾病(如糖尿病等);急慢性感染、肿瘤、近期手术或创伤、结缔组织病。所有入选者均知情同意,且本研究获得青岛市第八人民医院伦理委员会批准。
1.2 方法
1.2.1 一般资料收集 询问病史,并测定身高、体重,计算体质指数(BMI)。受试者休息15 min后,用标准汞柱式血压计测定坐位右上臂血压3次取均值。测定腰围与臀围。
1.2.2 实验室检查 受试者禁食12 h后于清晨采空腹静脉血,采用OLYMPUS AU2700自动生物化学分析仪检测空腹血糖(FPG)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。LP-PLA2、A-FABP采用酶联免疫吸附法(ELISA)检测,配套试剂购自美国R&D公司,操作严格按试剂盒说明书进行。
1.2.3 超声检查 颈动脉超声检查采用PHILIPSiu22型彩色多普勒超声诊断仪,周围血管探头频率为5~15 Hz,由高年资医师专人操作。受试者于测试前休息10~15 min,仰卧,头转向对侧,肩部垫高颈后仰,探头从锁骨内侧端逐节段检查双侧颈总动脉内径(分叉近2.0 cm处)及颈动脉内膜-中膜厚度(IMT)。观察颈内动脉、颈总动脉和颈动脉分叉处斑块情况。
1.2.4 分组 根据斑块特征分为:①低回声斑块:纤维帽薄或不清,内部以脂质低回声成分为主;②中等回声斑块:纤维帽较厚,内部以中等水平回声的纤维成分为主;③强回声斑块:内部回声明显增强,以钙化为主,斑块深部出现衰减;④混合回声斑块:斑块内部>20%的面积出现声学特征不一致(有两种以上的组织成分混合或伴出血)。根据斑块特征[4]将中等回声和强回声斑块归为稳定斑块,低回声和混合回声斑块归为不稳定斑块。详细记录所有患者颈部动脉斑块类型,并根据超声结果分为稳定斑块组(96例)和不稳定斑块组(29例)。1.3 统计学处理 采用SPSS 20.0软件进行统计分析。计量资料采用均数±标准差(±s)表示,两组间均数的比较采用t检验,计数资料采用例数(构成比)表示,组间比较采用χ2检验。LPPLA2、A-FABP、高敏C反应蛋白(hs-CRP)水平与颈动脉斑块稳定性的关系采用Logistic回归分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组一般资料比较 不稳定斑块组与稳定斑块组在年龄、BMI、WHR、TG、TC、HDL-C、LDL-C、FPG、hs-CRP、LP-PLA2及A-FABP等方面比较,差异无统计学意义(P均>0.05)。不稳定斑块组的hs-CRP水平显著高于稳定斑块组,差异有统计学意义(P<0.05)(表1)。
2.2 绝经后女性高血压患者hs-CRP、LPPLA2、A-FABP水平与颈动脉斑块稳定性的关系 经多因素Logistic回归分析,绝经后女性原发性高血压患者血清hs-CRP(OR=2.162,95%CI:1.189~4.032)、A-FABP(OR=1.017,95%CI:1.001~1.038)是颈动脉斑块稳定性的影响因素(表2)。
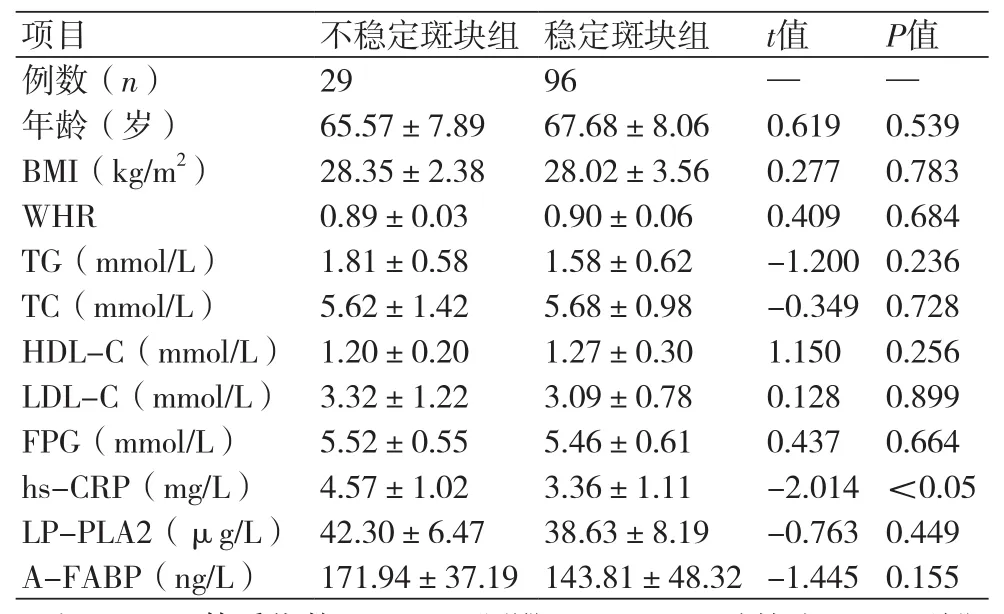
表1 两组一般资料比较

表2 血清LP-PLA2、A-FABP、hs-CRP水平与颈动脉斑块稳定性的Logistic回归分析
3 讨论
近年来炎症在动脉粥样硬化性疾病的作用已得到广泛认可,有学者提出,高血压也是一种低度的炎症疾病[5,6],高血压与炎症因子间相互影响,在炎症因子的刺激下引发动脉硬化。多数心血管事件是由斑块不稳定、破裂、继发血栓形成引起,炎症在斑块不稳定和破裂中发挥重要作用。超声检测颈动脉硬化斑块稳定程度可作为心血管事件的筛选参考[7]。
目前研究[7-10]发现,C反应蛋白(CRP)参与了动脉粥样硬化的形成。美国一项研究发现[11],在随访的6年时间内,hs-CRP水平持续增高的人群发生冠心病、脑卒中、心力衰竭及死亡的风险明显高于低水平人群。本研究发现,绝经后女性高血压患者,hs-CRP水平与颈动脉斑块稳定性相关,与国内外研究结果相近[11,12]。
LP-PLA2是近年来新发现的炎症标志物,其在血浆中80%与低密度脂蛋白结合,通过水解氧化低密度脂蛋白上的氧化卵磷脂,产生具有促炎和致动脉粥样硬化作用的溶血卵磷脂和氧化游离脂肪酸[13]。单核细胞在内膜聚集后衍生为巨噬细胞,巨噬细胞吞噬氧化低密度脂蛋白变成凋亡的泡沫细胞。而这些活化的巨噬细胞和泡沫细胞会产生更多的Lp-PLA2重返至循环中[14]。凋亡的泡沫细胞聚集成动脉粥样硬化斑块,斑块释放细胞因子和蛋白酶,降解纤维帽的平滑肌细胞和胶原基质,使斑块变得脆弱、破裂,导致血栓形成和心血管事件[15]。Garg等[16,17]研究表明,LPPLA2可独立预测心血管事件发生的风险。多项研究显示男性LP-PLA2水平高于女性[18-20],这种差异是由于性别所致,还是其他因素尚无定论。WOSCOPS研究[21]认为LP-PLA2可预测男性高脂血症患者的心血管事件,但以女性为研究对象的WHS研究[1]发现LP-PLA2水平不能预测心血管事件(冠心病、非致死性心肌梗死和卒中)。本研究选取绝经后女性高血压患者,结果发现,LPPLA2水平与颈动脉斑块稳定性无明显相关。
研究表明血清A-FABP水平与亚临床及临床动脉粥样硬化显著相关,高水平的A-FABP通过刺激脂多糖诱导的JNK磷酸化进而引发炎症反应,而JNK又参与调节脂多糖诱导下的A-FABP基因的转录激活。二者不断互相影响,加重炎症反应[22]。Peeters等[23]通过免疫组化染色发现A-FABP 主要在粥样斑块内的纤维帽区和肩部区表达,可能影响斑块的易损性;并且斑块A-FABP水平升高的患者发生非致命性脑卒中风险增加。Chow等[24]对中国人群进行随访后(中位数为9.4年)发现,校正传统危险因素后,A-FABP预测心血管疾病的风险比为1.57(95%CI:1.14~2.16)。本研究结果显示,绝经后女性高血压患者A-FABP水平与颈动脉斑块稳定性相关。
[1] Blake GJ,Dada N,Fox JC,et al. A prospective evaluation of lipoproteinassociated phospholipaseA (2) levels and the risk of future cardiovascular events in women[J]. J Am Coll Cardiol,2001,38(5):1302-6.
[2] Miyoshi T,Onoue G,Hirohata A,et al. Serum adipocyte fatty acidbinding protein is independently associated with coronary atherosclerotic burden measured by intravascular ultrasound[J].Atherosclerosis,2010,211(1):164-9.
[3] 丁士芳,张运,张梅. 颈动脉粥样斑块稳定性与急性脑梗死发病机制关系的临床研究[J]. 中华超声影像学杂志,2006,15(8):597-600.
[4] Sztajzel R. Ultrasonographie assessment of the morphological characteristics of the carotid plaque[J]. Swiss Med Wkly,2005,135(43/44):635-43.
[5] Enlen M,Kocaman SA,Poyraz F,et al. Incremetal effects of serum unicacid levels, autonomic dysfunction,and low-grade inflammation on nocturnal blood pressure in untreated hypertensive patients and normotensive individuals[J]. Turk Kanliyol Dern Ars,2011,39(7):531-9.
[6] Libby P,Okamoto Y,Rocha VZ,et al. Inflammation in atherosclerosis:transition from theory[J]. Circ J,2010,74(2):213-20.
[7] 高瑛子,高传玉. 颈动脉硬化与冠心病的相关性[J]. 中国动脉硬化杂志,2015,23(9):942-4.
[8] Ishikawa T,Hatakeyama K,Imamura T,et al. Involvement of C-reactive protein obtained by directional coronary atherectomy in plaque instability and developing restenosis in patients with stable or unstable angina pectoris[J]. Am J Cardiol,2003,91(3):287-92.
[9] Bouki KP,Katsafados MG,Chatzopoulos DN,et al. Inflammatory markers and plaque morphology: an optical coherence tomography study[J]. Int J Cardiol,2012,154(3):287-92.
[10] 吴溪曾,玉杰. 冠状动脉易损斑块血管内超声形态特征及患者血浆高敏C反应蛋白和基质金属蛋白酶9水平对其预测作用[J]. 中国医药,2016,11(2):158-61.
[11] Parrinello CM,Lutsey PL,Ballantyne CM,et al. Six-year change in high-sensitivity C-reactive protein and risk of diabetes,cardiovascular disease,and mortality[J]. Am Heart J,2015,170(2):380-9.
[12] 李梦,陈阳美. 缺血性脑卒中患者颈动脉粥样硬化斑块危险因素的分析[J]. 中国循证医学杂志,2006,6(5):385-9.
[13] Macphee CH,Moores KE,Boyd HF,et al. Lipoprotein-associated phospholipase A2,platelet- activating factor acetylhydrolase,generates two bio- active products during the oxidation of low-density lipoprotein:use of a novel inhibitor[J]. Biochem J,1999,338(Pt 2):479-87.
[14] Lavi S,McConnell JP,Rihal CS,et al. Local production of lipoproteinassociated phospholipase A2 and lyso-phosphatidylcholine in the coronary circulation:association with early coronary atherosclerosis and endothelial dysfunction in humans[J]. Circulation,2007,115:2715-21.
[15] Macphee CH,Nelson J,Zalewski A. Role of lipoprotein-associated phospholipase A 2, in atherosclerosis and its potential as a therapeutic target[J]. Curr Opin Pharmacol,2006,6(2):154-61.
[16] Garg PK,McClelland RL,Jenny NS,et al. Lipopmtein-Associated Phospholipase A(2) and Risk of Incident Cardiovascular Disease in a Multi-Ethnic Cohort:The Multi Ethnic Study of Atherosclerosis[J].Atherosclemsis,2015,24l(1):176-82.
[17] 张举,袁杭,毛源,等. 同型半胱氨酸与脂蛋白(a)及脂蛋白相关磷脂酶A2联合检测对冠状动脉粥样硬化性心脏病的诊断价值[J].中国医药,2017,12(5):664-8.
[18] Thompson A,Gao P,Orfei L,et al. Lipoprotein-associated phospholipase A(2) and risk of coronary disease,stroke,and mortality:collaborative analysis of 32 prospective studies[J]. Lancet,2010,375(9725):1536-44.
[19] Liping Hou,Shufeng Chen,Hongjiang Yu,et al. Associations of PLA2G7 gene polymorphisms with plasma lipoprotein-associated phospholipase A2 activity and coronary heart disease in a Chinese Han population: the Beijing atherosclerosis study[J]. Human Genetics,2009,125(1):11.
[20] 贾张蓉,赵冬,齐明,等. 脂蛋白相关磷脂酶A2活性水平的性别差异及其与心血管病危险因素的关系[J]. 中华心血管病杂志,2013,41(11):962-7.
[21] Packard CJ,O’Reilly DS,Caslake MJ,et al. Lipoprotein-associated phospholipase A2 as an independ entpre dictor of Coronary heart disease. West of Scoronary Prevention Study Group[J]. N Engl J Med,2000,343(16):1148-55.
[22] Hui X,Li H,Zhou Z,et al. Adipocyte fatty acid-binding protein modulates inflammatory responses in macrophages through a positive feedback loop involving c-Jun NH2-terminal kinases and activator protein-1[J]. J Biol Chem,2010,285(14):10273-80.
[23] Peeters W,de Kleijn DP,Vink A,et al. Adipocyte fatty acid binding protein in atherosclerotic plaques is associated with local vulnerability and is predictive for the occurrence of adverse cardiovascular events[J]. Eur Heart J,2011,32(14):1758-68.
[24] Chow WS,Tso AW,Xu A,et al. Elevated circulating adipocyte-fatty acid binding protein levels predict incident cardiovascular events in a community-based cohort: a 12-year prospective study[J]. J Am Heart Assoc,2013,2(1):e004176.

